導讀
2022年,國家藥監局(NMPA)共批準了49款新藥,其中進口新藥30款,國產新藥19款。從類型上看,包括27款化藥、13款生物制品、5款疫苗以及4款中藥。
據相關媒體統計,2019年國家藥監局共批準了51款新藥,2020年批準了48款新藥,2021年創紀錄地批準了83款新藥。就數量而言,2022年似乎又回到了常態。
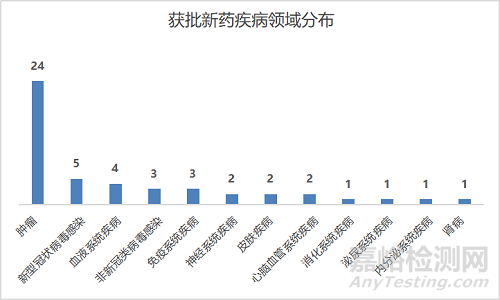
從疾病領域看,2022年NMPA批準的新藥中,抗腫瘤(實體瘤+血液瘤)藥物獨占鰲頭,占比49%;治療新冠藥物(口服藥+疫苗)位居第二,占比10.2%;其次是血液疾病新藥,占比8.2%、非新冠類病毒感染新藥占比6.1%、免疫系統疾病新藥占比6.1%等。
從審評角度看,通過優先審評審批/應急審評審批方式獲批上市的新藥有24款,占比49%,化藥、生物藥、中藥均有涉及。
通過優先審評審批/應急審評審批方式獲批的新藥
總體而言,2022年NMPA批準的新藥中有不少亮點,在具體產品類別上也帶來多款“首個”。這些新藥的上市,為多種疾病提供了全新的療法和更多的治療選擇。
本文將節選部分2022年獲NMPA批準上市的新藥進行回顧總結,供大家參考。
國產創新藥表現亮眼
我國創新藥在2022年迎來了新的突破,多款全新機制新藥獲批上市。這不僅標志著本土藥企迎來了研發的收獲期,也代表著中國創新藥發展體系進一步靠近國際先進水平。
去年6月29日,國家藥監局附條件批準康方生物自主研發的PD-1/CTLA-4雙特異性抗體藥物開坦尼(卡度尼利單抗注射液)上市,用于治療復發或轉移性宮頸癌。這是國內獲批上市的首款雙抗藥物,也是首款獲批用于晚期宮頸癌的免疫治療藥物,同時還是全球獲批的首款PD-1/CTLA-4雙抗,填補了國產雙特異性抗體藥物研發的市場空白,亦或標志著中國創新藥發展體系進一步靠近國際先進水平。
根據已披露的數據現實,作為一種基于PD-1免疫檢查點的全新雙特異性抗體新藥,卡度尼利單抗既可以充分發揮PD-1和CTLA-4兩個免疫檢查點的協同抗腫瘤作用,同時副作用較兩個靶點的單抗聯合治療明顯降低,優異的抗腫瘤療效和安全性將為全球廣大腫瘤患者帶來切實的臨床獲益提升。
去年10月,華領醫藥first in class降糖藥多格列艾汀獲批上市,用于改善成人2型糖尿病患者的血糖控制。這是全球范圍內首個獲批上市的葡萄糖激酶啟動劑(GKA)藥物,是過去近十年來糖尿病領域首個全新機制的原創新藥,也是首次在中國推出2型糖尿病全球首創新藥。
新冠口服藥應急批準上市
伴隨著疫情的不斷變化,新冠口服藥似乎成為了新的曙光。2022年,藥監局不僅批準了首個國產新冠口服藥——阿茲夫定,還應急附條件批準了兩款進口新冠口服新藥。
去年2月,藥監局按照藥品特別審批程序,進行應急審評審批,附條件批準輝瑞Paxlovid(奈瑪特韋片/利托那韋片組合包裝)進口注冊,用于治療成人伴有進展為重癥高風險因素的輕至中度新型冠狀病毒肺炎(COVID-19)患者。
Paxlovid是3CL蛋白酶抑制劑nirmatrelvir與低劑量利托那韋(Ritonavir)的復方制劑,由300mg(兩片150mg片劑)的nirmatrelvir和一片100mg的利托那韋片進行組合給藥供新冠患者口服,每日給藥2次,持續5天。利托那韋有助于減緩nirmatrelvir的代謝或分解,使其在體內有效濃度維持較長時間,持久對抗病毒。
根據已披露的臨床試驗數據現實,Paxlovid一項治療非住院、具有發展成重癥疾病的高風險成人COVID-19感染患者的隨機、雙盲、II/III期EPIC-HR研究的期中分析結果。數據顯示,在癥狀出現三天內接受治療的患者中,與安慰劑相比,Paxlovid可使COVID-19相關的住院或因任何原因死亡的風險降低89%(主要終點)。癥狀出現五天內接受治療的患者中,與COVID-19相關的住院或死亡也有類似的減少。
去年12月,藥監局按照藥品特別審批程序進行應急審評審批,附條件批準默沙東公司新冠病毒治療藥物莫諾拉韋膠囊進口注冊,用于治療成人伴有進展為重癥高風險因素的輕至中度COVID-19患者。
在作用機制上,與輝瑞的Paxlovid不同的是,Molnupiravir是一種RNA聚合酶(RdRp)抑制劑,通過阻斷新冠病毒RNA依賴的RNA聚合酶的合成,達到抑制或清除病毒的作用。而Paxlovid屬于3CL蛋白酶抑制劑,其通過阻斷新冠病毒3CL蛋白酶的活性,從而破壞病毒RNA的復制過程。
在基于全部隨機入組患者(n=1433)的分析中,Molnupiravir降低了住院或死亡風險:對照安慰劑組中9.7%(68/699)的患者住院或死亡,服用Molnupiravir的患者中有6.8%(48/709)的患者住院,絕對危險度下降3.0%(95%置信區間[CI]: 0.1, 5.9)。安慰劑組有9例死亡報告,Molnupiravir有1例死亡報告。
去年9月,默沙東/國藥集團聯合宣布雙方簽署合作框架協議,默沙東將其和Ridgeback公司將Molnupiravir的經銷權和獨家進口權授予國藥集團,同時雙方將評估技術轉讓的可行性,以便該藥物在中國境內生產、供應和商業化。
中藥創新藥研發熱情高漲
近些年,在諸多利好政策及審評持續優化的驅動下,中藥創新藥獲批品種數、申報上市品種數及申報臨床品種數逐年上漲,中藥創新藥研發熱情高漲。2022年,藥監局批準了淫羊藿素軟膠囊、廣金錢草總黃酮膠囊、參葛補腎膠囊、芪膠調經顆粒4款1類中藥創新藥上市。
去年1月,NMPA批準了北京珅諾基1.2類中藥創新藥淫羊藿素軟膠囊的上市申請,用于治療既往未接受過全身系統性治療的不可切除的肝細胞癌。該藥物的主要成分是從淫羊藿中提取、分離、純化得到的活性藥物單體。
根據相關報道顯示,全國28家研究中心共同參與完成的多中心、隨機、雙盲、雙模擬Ⅲ期研究中,淫羊藿素軟膠囊用于不可切除的晚期肝細胞癌一線治療,在預后更差的富集人群中相較于華蟾素對照組顯示出持續顯著生存獲益和更優的安全性及生活質量。在最新更新的《CSCO肝癌診療指南(2022版)》正式將淫羊藿素軟膠囊納入晚期肝癌一線治療推薦藥物目錄(Ⅰ級專家推薦)。國家衛健委發布的《原發性肝癌診療指南(2022版)》也將淫羊藿素軟膠囊作為推薦方案。
去年9月,NMPA批準了人福醫藥1.2類中藥創新藥廣金錢草總黃酮膠囊的上市申請,適應癥為清除濕熱、利尿排石,用于濕熱蘊結所致的淋瀝澀痛,輸尿管結石和上述證候者。該藥的主要成份是從廣金錢草中提取得到的總黃酮類成份。
去年12月,NMPA批準了安邦制藥中藥新復方制劑芪膠調經顆粒上市。該藥品由黃芪、阿膠、黨參、白芍等9味藥組方,具有益氣補血、止血調經功效,用于上環所致經期延長中醫辨證屬氣血兩虛證。
去年12月,NMPA批準了新疆華春生物藥業1.1類中藥創新藥參葛補腎膠囊的上市申請。該藥品開展了隨機、雙盲、安慰劑平行對照的多中心臨床試驗,臨床試驗研究結果顯示,主要療效指標HAMD -17評分與基線的差值,試驗組療效與氟西汀(Fluoxetine)相當,優于安慰劑組。
該藥品益氣,養陰,補腎,適用于輕、中度抑郁癥中醫辨證屬氣陰兩虛、腎氣不足證。該藥品的上市為抑郁癥患者提供了又一種治療選擇。
罕見病療法層出不窮
去年1月,國家藥監局藥審中心發布了《罕見疾病藥物臨床研發技術指導原則》,這也是國家層面為推動更多藥物研發、生產機構關注罕見病群體的需求,研發罕見病治療藥物做出的貢獻。2022年藥監局批準的新藥中,罕見病也是獲批新藥較多的治療領域。
去年1月,安進/日本協和麒麟(Kyowa Kirin)研發的第二代TPO受體激動劑注射用羅普司亭獲得NMPA批準上市,用于治療原發慢性免疫性血小板減少癥(ITP)。
同月,新基(BMS)研發的紅細胞成熟劑注射用羅特西普獲得NMPA批準上市,用于治療β地中海貧血患者。羅特西普是中國首個且唯一獲批的紅細胞成熟劑,也是十余年來中國首個獲批治療β-地中海貧血的創新藥物。
去年3月,蘇庇醫藥(Sobi)研發的干擾素γ(IFNγ)靶向療法依馬利尤單抗獲得NMPA批準上市,用于特定的原發性噬血細胞性淋巴組織細胞增多癥(HLH)成人和兒童患者的治療。
依馬利尤單抗(emapalumab)最初由Novimmune SA公司開發,Swedish Orphan Biovitrum AB(蘇庇醫藥)于2018年通過獨家許可協議獲得了依馬利尤單抗的全球權益。這是一款與干擾素γ(IFNγ)結合的單克隆抗體,能夠中和IFNγ的作用。IFNγ是誘導細胞凋亡的關鍵細胞因子,IFNγ的大規模過度表達被認為是導致免疫系統過分激活的主要原因,這最終會導致器官衰竭。
同日,豪森制藥引進的抗CD19單抗伊奈利珠單抗獲批用于治療抗水通道蛋白4(AQP4)抗體陽性的視神經脊髓炎譜系疾病(NMOSD)成人患者。伊奈利珠單抗是翰森制藥首款上市的生物藥,也是國內上市的首款CD19單抗。
去年12月,勃林格殷格翰罕見皮膚病靶向生物制劑佩索利單抗(商品名:圣利卓/Spevigo)獲得NMPA批準上市,用于治療成人泛發性膿皰型銀屑病(GPP)發作。佩索利單抗是一款可阻斷白介素-36受體(IL-36R)激活的單克隆抗體,可抑制IL-36的信號傳導,也是中國首個獲批專門用于治療成人GPP發作的治療藥物。
佩索利單抗注射液的獲批是基于其全球關鍵性Effisayil 1 II期臨床研究。該研究是全球首項針對GPP發作患者進行的國際多中心、雙盲、隨機對照研究,覆蓋了全球12個國家/地區,包括中國。研究表明:54.3%的患者經佩索利單抗注射液治療1周便達到皮膚無可見膿皰;42.9%的患者經佩索利單抗注射液治療1周可達到皮膚癥狀清除或幾乎清除。同時在整個研究中,佩索利單抗注射液的安全性數據是可接受的,患者常見的不良事件包括發熱和輕度至中度感染。
附表:2022年NMPA批準的新藥