您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-09-25 23:49
因罕見病患者數量太少,而致研發成本高,如單從經濟角度來看,罕見病藥物(又稱“孤兒藥”)研發很不劃算。但隨著我國對罕見病藥物系列鼓勵政策的出臺,以及企業為了避開過于擁擠的賽道,近年來,我國罕見病藥物的研發不斷提速,本文將從研發階段、企業排名、孤兒藥認定和納入優先審評審批情況等四個方面,對我國罕見病藥物的研發進展做一分析。
PART 01 研究階段
2018年5月22日,由國家衛健委、科技部等五部委聯合發布的《第一批罕見病》,共涉及121種疾罕見病。如按這121種罕見病適應癥來統計新藥數量的話,全球共有2595個藥品成分在研,1058個尚處于臨床前,國內在研藥品成分為331個,顯著少于全球僅占全球的12.8%。
我國已批準上市了74種罕見病用藥,占了全球282個上市罕見病藥物的26%,我國處于臨床III期和I期間的分別有49個和41個,臨床I期、II期、III期的在研罕見病藥物分別有41個、36個和49個,分別占全球的10%、6%和20%。,我國占全球比重最大的是批準臨床的罕見病藥物研發,共有38個,占了全球50個的76%,其次是申請上市的有11個,占了全球的38%。(詳見圖一)

PART 02 企業排名
1、按藥物排
全球研發罕見病藥物數量最多的企業是瑞士諾華,共有138個罕見病藥物在研,占了其新藥研發總數213個的65%,其次是施貴寶和輝瑞,研發的罕見病藥物分別有108個和98個,分別占其研發藥物總數的64%和58%,羅氏和賽諾菲都各有96個,分別占各自研發藥物總數的48%和64%。在研罕見病藥物數量占其研發新藥總數的比重最大的是ShapeTherapeutics,共有37個罕見病藥物在研,占了其研發新藥總數的70%。占比在60%以上的依次是安進(占65%)、諾華(占65%)、施貴寶(64占%)、賽諾菲(64占%)和渤健(占61%)。
在Top20企業中,占比最小的是禮來,其研發罕見病藥物的數量僅占研發新藥總數的不到三分之一(28%),而且是針對一種罕見病開發的,與諾華65%的巨大高占比形成了鮮明對比,其次是默克和日本大冢,分別只占35%和41%。
我國也有一家企業躋身Top20,即百濟神州,共有36個罕見病藥物在研,排第19位,占其新藥研發總數的比例為55%。(詳見圖二)
盡管經濟回報不是最劃算,但全球頭部藥企罕見病藥物研發的占比都比較高。

2、按成分排
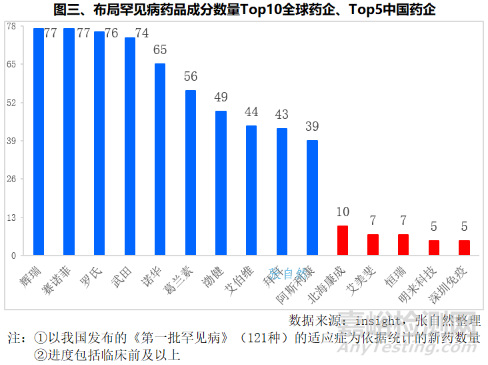
如按涉及的藥品成分來劃分的話,全球研發立項70個以上罕見病藥品成分的企業共有4家,即輝瑞、賽諾菲、羅氏和武田,分別涉及77個、77個、76個和74個罕見病藥品成分。其次是諾華(65個)、葛蘭素(56個)、渤健(49個)、艾伯維(44個)、拜耳(43個)和阿斯利康(39個)。
我國新藥研發涉及罕見病藥品成分數最多的是北海康成,有10個,恒瑞和艾美斐生物都有7個,武漢明來科技和深圳市免疫基因治療研究院各有5個。(詳見圖三)
PART 03 資格認定
1、全國
獲得孤兒藥認定資格,是提高美國FDA審評審批速度的重要渠道。
2014-2020年,我國藥企共拿下了66個FDA孤兒藥資格認定,其中,2020年一年就拿下了37個,比以往歷年的總和還多。
近年來,隨著醫保談判、帶量采購等醫保控費政策的壓力不斷增加,創新藥企承受的壓力也越來越大,紛紛擬通過加速出海來化解,向美國FDA爭取孤兒藥資格認定等也成為熱門。(詳見圖四)

2、Top20企業
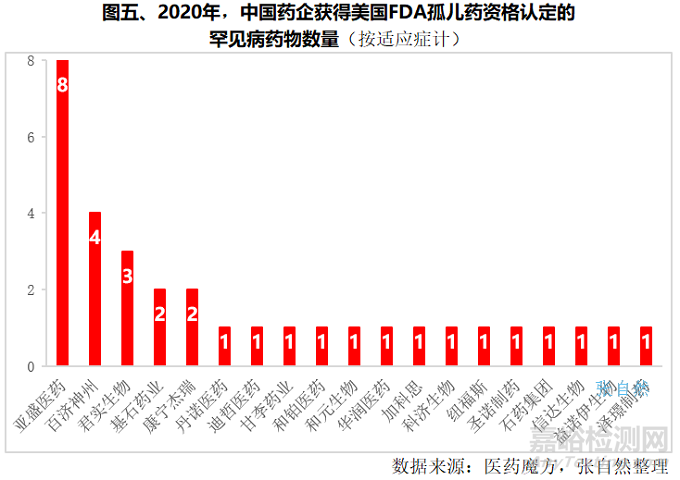
2020年,我國有20多家企業的在研藥物獲得了美國FDA孤兒藥認定資格,其中,楊大俊博士領銜的亞盛醫藥憑借4款藥物囊獲8項孤兒藥資格認定成為最大贏家,百濟神州、君實生物則分別以4項和3項認定位居其后。基石藥業和康寧杰瑞各獲得了2個認定。(詳見圖五)
PART 04 優先審評審批
2017年12月,原國家食藥監總局發布的《關于解決藥品注冊申請積壓實行優先審評審批的意見》,明確對治療罕見病的藥品注冊申請予以優先審評審批。
2018年5月,國家藥監局和衛建委發布的《關于優化藥品注冊審評審批有關事宜的公告》指出,對于境外已上市的罕見病藥品,申請人經研究認為不存在人種差異的,可以提交境外取得的臨床試驗數據直接申報上市。
2020年7月,國家市場監督管理局發布新修訂的《藥品注冊管理辦法》中規定,罕見病的創新藥品上市許可申請時,可以申請適用優先審評審批程序并給予審評時限的政策支持。
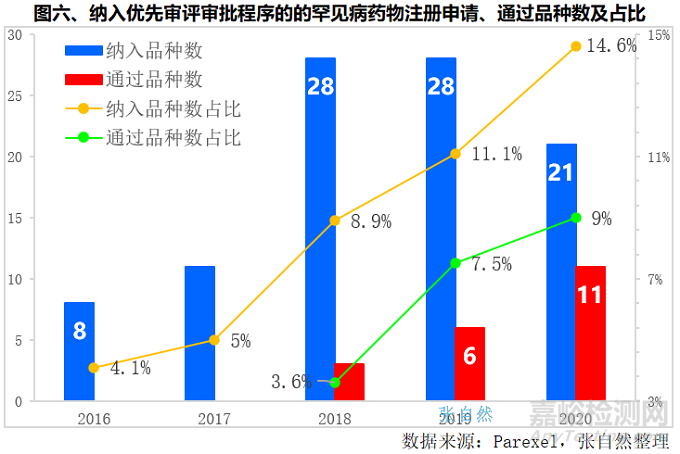
很多罕見病藥物通過納入優先審評審批程序,大幅加快了審評審批速度。納入優先審評審批程序的罕見病藥物由2016年的8個提高到了2018年和2019年的28個,增加了2.5倍,2020年略有下降,為21個,但占納入優先審評審批藥品總數的比重連年上升,由2016年的4.1%提升到了2021年的14.6%,5年提升了10個百分點。(詳見圖六)
除審評審批提速外,一年一度的國家醫保談判也對罕見病藥關愛有加,我國的罕見病藥物研發還將提速將保持高速發展。

來源:醫藥經濟報


