您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-07-21 15:10
今日頭條
索元FIC抑郁癥新藥獲批Ⅱb期臨床。索元生物宣布其抗抑郁癥(TRD)新藥DB104(liafensine)已獲得國家藥監局的臨床許可。這是一項國際Ⅱb期試驗(ENLIGHTEN研究),擬在生物標記物指導下評估DB104用于治療難治性TRD患者的安全性和有效性。liafensine是一款潛在“first-in-class”新藥。可特異性地抑制在抑郁癥中起重要作用的5-羥色胺、去甲腎上腺素和多巴胺的再攝取。此前,這項試驗已在美國啟動。
國內藥訊
1.諾華奧馬珠單抗在華報sNDA。諾華奧馬珠單抗的新適應癥上市申請獲CDE受理。奧馬珠單抗(英文商品名為Xolair)是一款特異性阻斷IgE的抗體治療藥物,通過降低游離IgE水平,下調高親和力IgE受體和限制肥大細胞的脫顆粒化,該產品可最大限度地減少過敏性炎癥級聯反應中多種介導因子的釋放。該藥此前已在中國獲批治療過敏性哮喘和慢性自發性蕁麻疹適應癥。
2.綠葉帕金森新藥II期臨床成功。綠葉制藥注射用羅替戈汀緩釋微球(LY03003)治療帕金森病的中國III期臨床達到預設終點。與安慰劑組相比,LY03003組統一帕金森病評分量表(UPDRS)Ⅱ+Ⅲ評分較基線顯著改善,兩組差異具統計學意義(P<0.001)。相關次要評價指標兩組亦均具有統計學意義(P<0.001)。研究中未發生與藥品相關的嚴重不良事件。LY03003是全球首個長期產生持續多巴胺能刺激(CDS)的藥物。
3.北海康成IBAT抑制劑國內上II期臨床。北海康成口服回腸膽汁酸轉運蛋白(IBAT)抑制劑CAN108(maralixibat)治療膽道閉鎖(BA)的II期EMBARK研究中國首例患者給藥。這是一項國際多中心臨床試驗,擬評估CAN108治療Kasai手術后BA患者的有效性和安全性,預期將在全球招募72例患者,其中包括在中國招募20例患者。maralixibat(LIVMARLI®)是FDA批準的首個用于罕見病Alagille綜合征(ALGS)患者的膽汁淤積性瘙癢癥的治療藥物。
4.齊魯新冠口服藥啟動臨床。齊魯制藥開發的首款針對新冠的治療藥物QLS1128緩釋片日前登記一項臨床試驗(ClinicalTrials.gov 登記號:NCT05458076),擬在健康受試者中評估QLS1128聯合利托那韋的安全性、耐受性及藥代動力學。QLS1128很可能是一款3CL蛋白酶抑制劑。目前國內至少有12個同靶點新冠藥物在研,進展最快的分別是先聲藥業的SIM0417和前沿生物的福布特韋。今年5月,SIM0417已啟動聯用利托那韋的II/III期臨床。
5.輝瑞CDK2抑制劑在華獲批臨床。輝瑞1類新藥PF-07104091片獲NMPA臨床試驗默示許可,擬開發用于晚期實體瘤的治療。PF-07104091是一款CDK2抑制劑。CDK2是絲氨酸/蘇氨酸蛋白激酶家族成員,主要驅動細胞進入細胞周期的S期和M期,其過表達會引起細胞周期的異常調節,這與癌細胞的過度增殖直接相關。該新藥正在海外進行Ⅰ/Ⅱ期臨床,評估單藥或聯合治療非小細胞肺癌、乳腺癌等多種腫瘤的療效和安全性。
國際藥訊
1.艾伯維偏頭痛新藥在歐盟報產。艾伯維宣布已向歐洲藥品管理局(EMA)提交口服CGRP受體拮抗劑atogepant的上市申請(MAA),用于每月頭痛發作超過4天的成人偏頭痛患者的預防性治療。在atogepant用于發作性偏頭痛和慢性偏頭痛患者治療的兩項III期(ADVANCE和PROGRESS)研究中,atogepant與安慰劑相比,顯著降低每月平均偏頭痛天數(分別減少3.69天、3.86天和4.2天,p≤0.0001),兩項試驗均達到主要研究終點。
2.Apellis雙環肽療法獲優先審評資格。Apellis公司靶向補體C3的聚乙二醇化(PEGylated)雙環肽療法pegcetacoplan獲FDA優先審評資格,用于治療由年齡相關性黃斑變性(AMD)引起的地圖樣萎縮(GA)。PDUFA日期為2022年11月26日。在臨床試驗中,每個月與每兩個月一次玻璃體內注射pegcetacoplan治療,可顯著減少患者的GA病變。去年5月,該新藥已獲FDA批準用于治療陣發性睡眠性血紅蛋白尿癥(PNH)成人患者。
3.PI3K/mTOR抑制劑獲突破性療法認定。Celcuity公司潛在“first-in-class”PI3K/mTOR抑制劑gedatolisib獲FDA授予突破性療法認定,用于治療HR+/HER2-轉移性乳腺癌經治患者。gedatolisib與palbociclib、和內分泌療法fulvestrant聯用,在接受Ⅲ期臨床試驗推薦劑量治療的患者中達到63%的客觀緩解率,無進展生存期12.9個月。去年4月,Celcuity與輝瑞達成研發協議,從輝瑞獲得gedatolisib的全球研發權益。
4.Agomab與輝瑞攜手開發克羅恩病療法。Agomab公司宣布完成輝瑞領投的4050萬美元B輪擴展融資,至使B輪融資總額達到1.14億美元。Agomab公司在研產品包括擬用于治療克羅恩病的口服ALK-5小分子抑制劑AGMB-129、治療特發性肺纖維化的吸入式ALK-5小分子抑制劑AGMB-447以及兩款MET受體激動劑(AGMB-101和GMB-102)。Agomab將與輝瑞合作完成AGMB-129的臨床開發,并保留對該產品的全部權利。
5.奧拉帕利治療結直腸癌III期臨床失敗。默沙東與阿斯利康聯合開發的PARP抑制劑奧拉帕利(Lynparza)單藥或聯合貝伐珠單抗用于一線誘導后未發生疾病進展的不可切除或轉移性結直腸癌患者的III期臨床(LYNK-003)未達到主要終點。經獨立數據監查小組評估,奧拉帕利和奧拉帕利+貝伐珠單抗2種方案均不能在貝伐珠單抗+化療基礎上顯著降低患者的腫瘤進展或死亡風險。目前兩家公司已決定終止該項研究。
6.諾華2022年度上半年業績公布。7月19日,諾華發布2022年度上半年業績報告。公司上半年凈銷售收入達到253.12億美元,與上一年基本持平;凈利潤39.14億美元,同比下降21%。上半年產品銷售額排名前五分別為:司庫奇尤單抗(24.34億美元,+9%)、沙庫巴曲纈沙坦(22.18億美元,+32%)、芬戈莫德(11.60億美元,-19%),艾曲波帕(10.25億美元,+5%)和雷珠單抗(10.21億美元,-7%)。此外,基因療法Zolgensma上半年銷售收入達到7.42億美元(+17%),位列銷售額榜單第9位。
醫藥熱點
1.上海一醫院首開重癥醫學親子陪護病房。7月16日,上海交通大學醫學院附屬上海兒童醫學中心正式啟用重癥醫學親子陪護病房,共設置10個床位,用于病情相對穩定、陪護需求突出的患兒家庭。重癥醫學科主任任宏認為,實施以家庭為中心的重癥照護,改善患者預后,是今后兒科重癥醫學發展的方向。醫院將針對這項新的人文醫學舉措進行效果評估,以期在今后不斷改進和廣泛推廣。
2.安徽省首家國有核酸檢測實驗室投入使用。經過半個多月的運營,合肥客運全資子公司合肥民福生物醫學有限公司生物醫學檢驗實驗室近日正式投入使用。該實驗室可承載日檢10萬管的檢測量、覆蓋檢測樣本數能達到200萬人,是安徽省最大的核酸檢測實驗室,也是該省首家國有企業核酸檢測實驗室正式投入使用。
3.海南推動兩個中心建設。海南省日前印發該省2022年醫改重點工作任務提出,將推動區域醫療中心和臨床醫學中心建設。海南省發改委、衛健委將按職責牽頭持續推進北京大學口腔醫院三亞醫院和上海交通大學醫學院附屬上海兒童醫學中心海南醫院2個國家區域醫療中心建設項目建設;積極推進廣東省中醫院海南醫院、上海交通大學醫學院附屬瑞金醫院海南醫院、中南大學湘雅醫院海南醫院、四川大學華西醫院三亞醫院和復旦大學附屬兒科醫院海南醫院5個“輔導類”國家區域醫療中心建設項目,帶動全省醫療水平邁上新臺階。
4.代謝病兩個中心建設標準出臺。國家衛健委印發《國家內分泌代謝病醫學中心設置標準》和《國家內分泌代謝病區域醫療中心設置標準》,明確國家分泌代謝病醫學中心和區域醫療中心均應為三級甲等綜合醫院,并獨立設置內分泌代謝病科,其門診要開展標準化的內分泌疾病管理,年專科門診量滿足相應中心的醫教研需求。此外,兩中心均要具有開展內分泌代謝病激素和基因檢測的內分泌代謝病臨床檢測的能力。
評審動態
1. CDE新藥受理情況(07月20日)
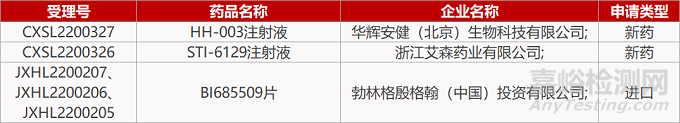
2. FDA新藥獲批情況(北美07月19日)


來源:Internet


