您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-05-28 06:32
5月20日,歐盟委員會發布了MDR法規下UDI系統使用的常見問題解答。本期小編先帶您了解歐盟MDR法規下的UDI,下期將梳理和總結歐盟委員會發布的UDI常見問題及解答。
01、什么是UDI,如何生成UDI碼?
器械唯一標識(unique device identification, UDI)是通過全球公認的設備標識和編碼標準創建的一系列數字或字母代碼。在歐盟市場上,UDI適用于除定制器械外的所有醫療器械和體外診斷器械。
UDI的使用有如下意義:
1) 可清晰識別市場上的特定器械,提高器械的可追溯性;
2) 有助于主管當局更好地監控,顯著提高器械上市后安全性相關活動的監督;
3) 有助于減少對錯誤或假冒器械的使用;
4) 有助于改善醫療機構和經濟運營商的器械采購、廢物處置政策,以及庫存管理策略。

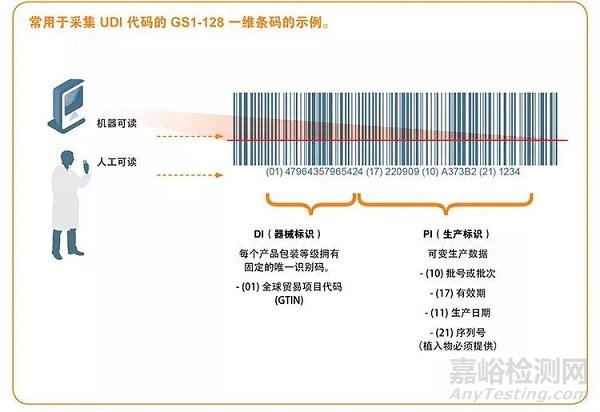
UDI由固定器械識別碼(DI,device identifier)和可變生產識別碼(PI,production identifier)組成。UDI-DI是特定于某一制造商和器械的UDI器械標識符,提供EUDAMED數據庫中MDR法規附件VI第B部分所述信息訪問途徑;UDI-PI用于標識所生產的器械單元,以及MDR法規附錄VI第C部分中包裝后的器械(若適用)。
UDI必須提供人工可讀(純文本)和機器可讀兩種格式,后者使用自動識別與數據采集(AIDC)技術。
UDI碼的生成流程大致為:
1) 向發行實體申請產品編碼(DI);
2) 編制UDI;
3) 將UDI生成一維碼或者二維碼(UDI可以采用GS1 28條碼,或者GS1 daatrix二維碼形式表示);
4) 把生成的UDI碼放置于醫療器械上。

02 什么是Basic UDI-DI,如何生成Basic UDI-DI?
Basic UDI-DI是訪問Eudamed數據庫中器械相關信息時的關鍵詞,也是CE證書、符合性聲明、技術文檔、安全和臨床性能摘要等相關文檔中的關鍵信息。Basic UDI-DI用于識別器械組,即具有相同預期用途、風險等級、基本設計和制造特征的器械。它獨立于器械的包裝/標簽,不會出現在任何貿易商品上。
Basic UDI-DI由Company Prefix、Model Reference、校驗碼組成。其中,Company Prefix為廠商識別代碼,與UDI中的一致;Model Reference,為產品識別代碼,由企業自行編制,可以是字母+數字的形式;校驗碼須經由發行實體生成。
03 Basic UDI-DI與UDI-DI有何區別?
1) 目的不同:UDI-DI是為了實現產品的可追溯,Basic UDI-DI是為了識別數據庫和文件中的產品組。
2) 代表含義不同:Basic UDI-DI代表的是一組產品,UDI-DI代表的是一組產品中的單個產品。因此,Basic UDI-DI與UDI-DI可能存在1對多的關系,1個Basic UDI-DI可能涉及多個具有不同規格的UDI-DI。
3) 編碼規則不同:Basic UDI-DI包含校驗碼,UDI-DI不含校驗碼。
4) 出現位置不同:Basic UDI-DI需在產品相關文檔(如CE證書、符合性聲明、CE技術文件等)中列明,不出現在任何貿易商品上;UDI-DI出現在器械標簽和所有更高級別的包裝上。
04 制造商對UDI應負什么責任?
除定制醫療器械、性能研究/實驗用器械除外,根據MDR法規,任何制造商在將器械投放市場前均應滿足如下UDI要求:
1) 為器械分配一個UDI和一個Basic UDI-DI;
2) 確保與器械相關的信息被正確提交并傳輸到UDI數據庫中(參見MDR附件VI的B部分);
3) 將UDI載體放置在器械標簽和所有更高級別的包裝上。
05 UDI發行實體
2018年底啟動申請征集后,歐盟委員會指定了以下四個UDI發行實體:
GSI AISBL
Health Industry Business Communications Council (HIBCC)
International Council for Commonality in Blood Banking Automation(ICCBBA)
Informationsstelle für Arzneispezialitaten(IFA)GmbH
參考資料
【1】Regulation(EU)2017/745
【2】https://ec.europa.eu/health/medical-devices-topics-interest/unique-device-identifier-udi_en

來源:蘇大衛環


