您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-03-21 18:24
雖然消滅和根除疾病是公共衛生的終極目標之一,但目前科學界也有部分觀點認為,新冠最終可能是將與人類共存。因此,如何通過“疫苗預防+藥物治療”的組合拳將新冠病毒的危害控制在可接受范圍內將成關鍵。
在2020年新冠疫情發生之初,國務院聯防聯控機制科研攻關組就將疫苗的研發作為主攻方向之一,并同時布局了滅活疫苗、核酸疫苗、重組蛋白疫苗、腺病毒載體疫苗,減毒流感病毒載體疫苗這五條技術路線。
此外,據科技部部長王志剛在今年全國兩會期間接受媒體采訪時介紹稱,各類新冠治療藥物亦在積極開發中。截至目前,已有1個中和抗體藥獲批附條件上市,另外還有3個小分子藥物進入了三期臨床試驗。
新冠疫苗研發概覽
疫苗主要用于感染前的預防。據統計,截至目前,國內有5款疫苗獲批附條件上市,還有2款疫苗獲緊急使用授權。
從技術路線看,7款疫苗中,有5款是滅活疫苗,另外還有腺病毒載體和重組蛋白疫苗各一款。

圖|國內已獲批上市/緊急使用的新冠疫苗(共7款)
與此同時,據科技部部長王志剛稱,目前國內也有已經進入三期臨床試驗階段的mRNA疫苗和DNA疫苗。
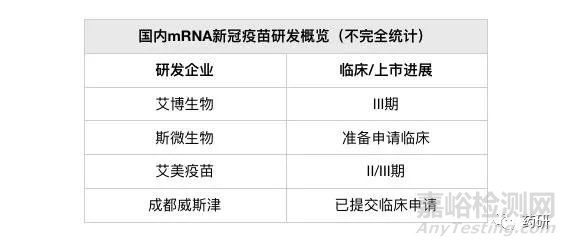
mRNA疫苗是國外獲批上市疫苗的主流技術路線。國內有做布局的企業有艾博生物/沃森生物、斯微生物、艾美疫苗、成都威斯津等,其中以艾博生物/沃森生物的ARCoV臨床進展最快。
1、艾博生物:艾博生物mRNA新冠疫苗(ARCoV)由軍事醫學科學院、艾博生物及沃森生物(300142.SZ)聯合開發。
2020年6月,ARCoV獲得國內首個mRNA疫苗的臨床批文,并從2021年5月起開展海外三期臨床試驗,計劃入組28000例。ARCoV的國內三期臨床研究則于2021年7月啟動。
據了解,目前ARCoV海外三期臨床已完成所有受試者入組,相關研發單位正在等待數據揭盲與分析。
2、斯微生物:斯微生物于2020年初就已針對原始新冠毒株設計開發了mRNA疫苗,但后來隨著新冠病毒的幾次變異,公司轉而針對新冠變異毒株開展疫苗設計與研發,目前正準備申請進入臨床試驗 。
3、艾美疫苗:艾美疫苗mRNA新冠疫苗(LVRNA009)目前已進入關鍵性II/III期臨床試驗。在I期臨床中,該疫苗顯示出了良好的安全性、有效性,公司認為數據結果“超預期” 。
4、成都威斯津:成都威斯津生物醫藥科技有限公司(簡稱“威斯津生物”),系四川大學華西院士團隊于2021年7月創立,其主要的創始人之一宋相容教授曾在哈佛醫學院從事mRNA疫苗相關的研究。
據了解,目前該團隊開發的針對奧密克戎(Omicron)以及德爾塔(Delta)等新冠變異病毒的mRNA疫苗已向國家藥監局申請新藥臨床研究審批。
重組蛋白疫苗方面,近期獲批的智飛生物(300122.SZ)的重組新型冠狀病毒蛋白疫苗(CHO細胞)是國內首個獲批上市的國產重組新冠病毒蛋白疫苗。另外,三葉草生物、中國生物、成都威斯克等其他企業亦有布局。
1、三葉草生物:三葉草生物三聚體重組蛋白COVID-19候選疫苗SCB-2019(CpG 1018加鋁佐劑)已在一項全球范圍的關鍵性II/III期臨床試驗中達到主要及次要療效終點。
據公開信息,公司計劃于2021年第四季度就SCB-2019(CpG 1018加鋁佐劑)向EMA、國家藥監局及WHO提交附條件的監管批準申請。
2、中國生物:臨床前有效性研究和初步的人體試驗顯示,由中國生物研究院科研團隊研發的第二代重組蛋白疫苗對多種變異株具有廣譜保護潛力。該疫苗在2021年12月底已獲阿聯酋衛生和預防部批準緊急使用,將作為加強針用于已接種兩劑中國生物新冠滅活疫苗的人群。
3、成都威斯克:成都威斯克生物醫藥有限公司(簡稱“成都威斯克”)成立于2020年4月,公司核心研發力量為中國科學院院士、四川大學華西醫院生物治療國家重點實驗室和腫瘤中心主任魏于全團隊。
據了解,威斯克的第一代新冠疫苗目前已經在墨西哥、肯尼亞、印度尼西亞、菲律賓等海外國家推進臨床三期,并且還在日本進入了臨床1/2期。公司針對omicron變異株的第二代新冠疫苗預計會在今年進入臨床。

DNA新冠疫苗方面,在此次新冠疫情之前,全球并無DNA疫苗產品上市。而印度制藥公司Zydus Cadila開發的DNA新冠疫苗ZyCoV-D是全球首款用于人類的DNA疫苗,于2021年9月在印度獲批上市。
國內企業中,由艾棣維欣與美國Inovio制藥聯合開發的新冠DNA疫苗pGX9501(INO-4800)在2020年7月獲得了臨床試驗批件,目前正處三期臨床階段。
其他值得關注的新冠疫苗產品還有康希諾生物(688185.SH,06185.HK)的吸入用腺病毒載體新冠疫苗。
康希諾生物吸入用新冠疫苗,也就是公司已獲批上市的新冠疫苗克威莎的吸入劑型,是克威莎在制劑配方未改變的情況下,使用專用設備將疫苗霧化成微小顆粒,通過吸入的方式進入呼吸道和肺部,從而激發黏膜免疫、體液免疫和細胞免疫三重保護。
據全國政協委員、康希諾生物首席科學官朱濤日前在接受媒體采訪時透露,公司吸入式新冠疫苗在去年完成了一、二期的臨床,并且已開啟部分三期試驗。
從已有公開信息看,相較肌注給藥的克威莎,吸入用克威莎除了可以不用打針外,另一個特點是:可以以更低的接種劑量達到相似的免疫結果。一劑霧化吸入劑量相當于常單劑肌肉注射劑量的五分之一。
因此,如果吸入用克威莎獲批用于加強免疫,有望在一定程度上“提高”康希諾的產能。
新冠治療藥物概覽
雖然全球首個獲批上市的新冠治療藥物—美國吉利德公司開發的瑞德西韋(Remdesivir)是注射劑,但在新冠治療藥物的開發上,目前業界更多還是將關注點放在口服小分子藥物上。
相對注射劑,口服是最常用也是最便利的手段,能大大提高患者的用藥依從性,并且在生產、運輸上更為方便,產能瓶頸也小。
目前,海外已獲批的用于新冠治療小分子口服藥有3款,包括輝瑞Paxlovid、默沙東Molnupiravir以及禮來的巴瑞替尼。

值得注意的是,不管是輝瑞的Paxlovid還是默沙東的Molnupiravir,這兩款藥物均是用于輕中癥的、且有發展為重癥風險的新冠感染患者(肥胖、高齡,或罹患糖尿病、心臟病等基礎疾病)。
這也意味著, 對無基礎疾病的輕中度門診普通患者以及住院中重度患者的治療,目前還沒有太多的藥物可供選擇。
此外,近日還有消息傳出,由日本制藥公司鹽野義研發的新冠病毒口服藥S-217622已正式向日本厚生勞動省申請生產銷售許可。而從公開資料看,這款藥物可用于12歲以上的所有輕中癥新冠感染患者,但不限定是否具有基礎疾病。
國內方面,已布局新冠小分子口服藥研發的企業主要有君實生物(688180.SH,01877.HK)、真實生物、開拓藥業(09939.HK)等。前沿生物(688221.SH)則布局了注射用新冠小分子治療藥物的研發,擬用于治療中、重度的新冠肺炎住院患者。

1、 真實生物:河南真實生物科技有限公司(簡稱“真實生物”)成立于2012年,主要致力于抗病毒和抗腫瘤藥物、心腦血管以及肝臟疾病等治療藥物的研發。目前,公司阿茲夫定片治療新冠肺炎的三期臨床試驗已在中國、巴西和俄羅斯展開。
2、君實生物:VV116針對輕中度COVID-19患者的國際多中心II/III期臨床試驗正在進行中。另外,2021年12月31日,烏茲別克斯坦衛生部已批準VV116的緊急使用授權。
VV116由上海藥物所、武漢病毒所、中國科學院新疆理化技術研究所、旺山旺水、中國科學院中亞藥物研發中心共同研發,由君實生物與旺山旺水共同承擔該藥物在全球范圍內(除中亞五國,即哈薩克斯坦、烏茲別克斯坦、吉爾吉斯斯坦、塔吉克斯坦、土庫曼斯坦,俄羅斯,北非,中東四個區域外)的臨床開發和產業化工作。
3、開拓藥業:開拓藥業一共發起了3項普克魯胺治療新冠的全球多中心臨床,包括2項普克魯胺用于輕中癥非住院新冠患者的III期全球多中心臨床試驗 (編號分別為NCT04870606、NCT04869228)和1項用于重癥住院新冠患者的III期全球多中心臨床試驗(編號為NCT05009732),并于巴拉圭獲得針對住院新冠患者治療的緊急使用授權(EUA)。
其中,編號為NCT04870606的三期臨床中期分析并沒有達到預期,另外兩項臨床還在推進中。
4、 前沿生物:FB2001由前沿生物引進自上海藥物研究所,公司獨家取得該項目在全球范圍內的臨床開發、生產、制造及商業化權利,并于2021年3月15日在美國啟動臨床I期試驗。2020年12月,FB2001的藥物臨床I期橋接試驗申請又獲NMPA批準。據了解,目前前沿生物正在積極準備FB2001的二/三期臨床方案。

來源:財聯社


