您當前的位置:檢測資訊 > 監管召回
嘉峪檢測網 2021-11-23 15:00
前 言
原料藥性質的多樣化以及在新藥開發過程中的漸進性,讓制劑生產工藝的選擇頗具挑戰。筆者曾為讀者介紹了生產分類系統(MCS),其期望根據不同原料藥的理化性質科學合理地選擇制劑的生產工藝。在其后續的工作中,制劑科學家們持續改善MCS,并基于MCS的相關概念對歐盟批準的上市藥物進行了總結分析和數據挖掘。對制劑工藝關鍵影響因素——粒徑和載藥量等與工藝選擇的關系進行了深入探討。筆者特選取部分內容翻譯,以饗讀者。
本文選譯自《Manufacturing classification system in the real world: factors influencing manufacturing process choices for filed commercial oral solid dosage formulations, case studies from industry and considerations for continuous processing》;
MCS介紹請參考藥事縱橫文章《基于原料藥性質的口服固體制劑生產工藝路線選擇》及其原文《A proposal for a drug product Manufacturing Classification System (MCS) for oral solid dosage forms》。
1. 數據收集方法
根據生產工藝分類系統(MCS)工作組的調查結果,影響口服固體制劑的可生產性的最重要的因素在于粒徑,其次是載藥量。為了在實踐中將這些參數與商業化制劑的處方工藝開發相聯系,作者收集整理了1996年至2017年之間發布的EPAR審評的報告(96份膠囊劑&339份片劑),試圖找出這些基本的制劑參數(粒徑及載藥量)與工藝選擇之間的聯系。
為了便于分析,采用以下規則對藥物分類:
l API被分為A類(小粒徑的可能性更大)和B類(大粒徑的可能性更大);
l BCS 1/3類藥定義為A類,BCS2/4類定義為B類;
l 如果工藝中明確API需要微粉化,則無論BCS分類如何,API均定為B類;
l 規格范圍被分為三個(載藥量影響):低規格≤10mg;10mg<中等規格≤100mg;高規格>100mg;
l 對于多規格藥物,以最大規格確定分類;
l 在審評報告中獲取對工藝的判斷
l 雙層片被當成不同的處方

圖1、工藝選擇總結:(a)片劑和膠囊處方(n=435);(b)膠囊處方(n=96);(c)片劑處方(n=339);(d)片劑和膠囊處方(A類)(n=148);(e)膠囊和片劑處方(B類)(n=178)(DC:粉末直壓;DG:干法制粒;WG:濕法制粒;OT其他;Not specified:未明確;Direct Encapsulation:粉末直接填充膠囊)
2. 結果和分析
從統計結果(圖1)中可以看出,濕法制粒是最為常見的工藝,其次是粉末直壓/粉末直接填充、干法制粒。從這些關鍵數據中可以得出如下結論:
l A類(n=148)和B類(n=178)API幾乎各占一半;
l 對于膠囊劑而言,采用濕法制粒和粉末直接填充的工藝的處方幾乎各占一半。與此同時,采用其他工藝的制劑數量也較大;
l 對于片劑而言,濕法制粒是最為流行的選擇,比其他的工藝的總和還多。粉末直壓工藝比干法制粒的工藝略多,采用其他工藝的片劑相對較少。
l 對于同一API,不同的公司通常采用同一生產工藝,但是確實存在例外,例如:
西地那非,DC(Teva),DG(Pfizer)和WG(其他一般公司)
阿立哌唑,通常采用濕法制粒,但是有一家公司采用粉末直壓處方。
l 藥物的BCS分類和最終工藝聯系(如圖1(d,e)):
對于A類化合物,更傾向于采用粉末直壓/粉末直接填充和干法制粒;
對于B類化合物,更傾向于采用濕法制粒或者其他工藝。
l 給藥劑量和最終工藝的聯系(如圖2):
對于高規格制劑(>100mg),A類化合物更傾向于選擇粉末直壓,而B類化合物更傾向于采用濕法制粒;
制劑規格越低,采用粉末直壓工藝的制劑比例越高;
干法制粒更多用于A類化合物;
濕法制粒在所有的規范范圍內均有采用,但是在高規格制劑中,采用濕法制粒的比例更高;中高規格的BCS 2/4類化合物更傾向于采用濕法制粒;若規格>100mg且為B類化合物,超過80%的制劑采用了濕法制粒。
在中高規格制劑中,B類化合物的數量大于A類化合物的數量,而在低規格制劑中,情況則相反。

圖2. 不同劑量高低的藥物采用不同生產工藝(A是易溶性藥物,B是難溶性藥物)
3. 工藝選擇的原因
在某些審評文件中,明確地提到了采用某種生產工藝的原因,總結如下:
采用粉末直接填充/粉末直壓主要有兩個原因:(1)工藝簡單;(2)避免生產過程中的降解,更多地是為了避免水分;
采用干法制粒的原因也類似:(1)相對濕法制粒更為簡單,節約時間和成本;(2)避免接觸水分造成降解和晶型改變;(3)改善原料的流動性和可壓性,進而改進含量均勻度。
選擇濕法制粒的主要原因也是改善原料的不良性質:(1)改善粉體性質(流動性、堆密度、粘附性、靜電和可壓性差);(2)改善粒子性質(粒徑、API變異性);(3)高劑量/高載藥量經常被認為是選擇濕法制粒的原因;(4)低載藥量和保證含量均勻度也被認為是選擇濕法制粒的依據。
選擇以上3種工藝以外的其他工藝的原因比較多樣化。采用液體懸浮液/溶液處方的膠囊制劑,是最為常見的采用其他生產工藝的制劑。在某些審評文件中,申請人給出了采用液體膠囊處方的原因。例如nintendanib,因為API與常規的輔料存在相容性問題,其處方采用了油性的填料混合物。Tafamidis采用液體懸浮液處方,這是因為API在常規處方中溶出時會凝膠化。在其他一些案例中,工藝的選擇同時考慮了生物藥劑學因素和生產問題。選擇微丸技術的原因是這種技術可以調控藥物在人體內的釋放。而對于linaclotide,選擇微丸的原因是API的相容性問題。dabigatran,在酸性水分中容易水解,因此工藝中應當避免水和酸性條件。對于aprepitant,選擇了類似的處方以實現API在制劑中保持納米尺寸,并在體內分散良好。擠出造粒技術可以認為是非壓的濕法制粒,而不是真正的其他工藝。對于片劑,選擇其他工藝的制劑并不常見。采用活性包衣的處方的原因可能各有不同:避免API在制劑中的降解;保證API在固體制劑中納米尺度上的分散;改變藥物的釋放速率。兩種分散片采用凍干技術。這并不是因為兩種藥物可能并非BCS 4類,其原因可能是采用這種新穎的技術可以實現期望的釋放行為、或者服用的便利性(直接在嘴里溶解而非水中)。repaglinide和telmisartan采用了噴霧干燥制粒。但在審評文件中并未指出,采用這種工藝的原因是改善生產的便利性還是形成固體分散體以提高生物利用度。
4. 公司偏好
不同的公司有不同的工藝選擇偏好。這反映出公司內部的已有的專業知識和文化。例如,
對于創新型公司,最為突出的是GlaxoSmithKline,它采用很多粉末直壓制劑;Glead和Pfizer干法制粒的制劑數量最多,AztraZeneca和Roche也有很高比例的制劑采用了這種工藝;Boehringer Ingelheim,Bristol-Myers Squibb,Janssen和MSD采用濕法制粒的比例更大,而仿制藥公司(KRKA, Teva,Actavis, Mylan)采用濕法制粒的比例也比較大。
5、公司案例分析
(1)GSK:滲濾閾值
API的粒徑和載藥量是工藝選擇的關鍵參數。利用滲濾閾值的原理,可以更為精細地考慮原輔料粒徑比的影響。直壓處方對藥物處方的載藥量最為敏感。當載藥量達到某個限度值(滲濾閾值),載藥量的微小改變可能造成片劑關鍵性質的重大改變,例如硬度、崩解時間、溶出速率等。在藥物控制釋放模型中,材料的粒徑影響得到了廣泛研究,結果表明材料的粒徑對滲濾閾值的影響最大。值得一提的是,并非是API的絕對平均粒徑,而是API與輔料的粒徑比對溶出速率的滲濾閾值影響最大。
許多制劑處方通過研究滲濾閾值確定其是否可以預測最大的載藥量,從而確定更為穩健的工藝。這種方法是從GSK公司過去大約20年的處方報告中發掘出來的。在最初時,我們僅選擇了粉末直壓處方,因為制粒過程中有其他輔料加入,改變了API的粒徑。有機的輔料和API的真實密度相似,都大約是1.5g/ml。采用體積粒徑表示平均粒徑。典型情況下,首要選擇的處方是直壓級別的微晶纖維素。處方中其他成分的占比非常小,通常小于3%,因此認為其不會對混合物的可壓性有所貢獻。通過測定壓片失敗(如頂裂或層裂)的最大載藥量確定滲濾閾值。粒徑比例的定義是API的平均粒徑除以輔料的平均粒徑。例如,API的粒徑為250微米,輔料的粒徑是100微米,那么粒徑比是2.5。
研究了八個商業化制劑。其中一個處方沒有滲濾閾值,這意味著即使載藥量達到極高(95% w/w),可壓性都沒有變化。通過研究API本身的可壓性數據可以得知API本身的可壓性極好。因此,API的和輔料的成片性沒有區別。這個特定的制劑的在研究的載藥量范圍內,壓片性能沒有變化,因此不存在滲濾閾值。
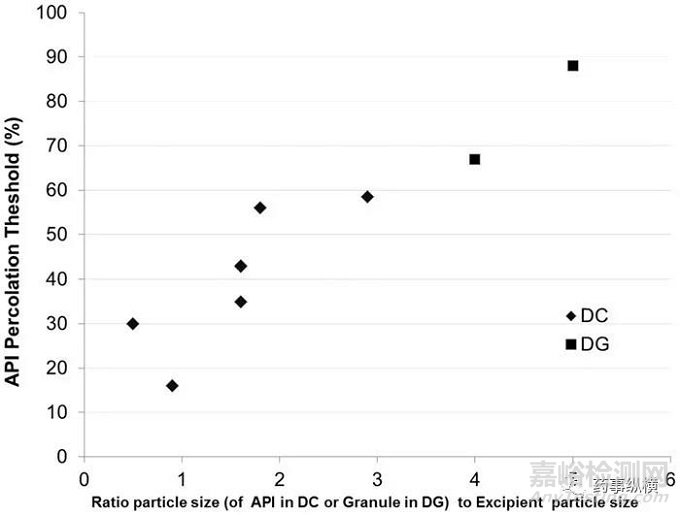
圖3. 粒徑比和載藥量滲濾閾值的關系圖
圖3顯示了在直壓處方中粒徑比與滲濾閾值的關系,滲濾閾值通過測定頂裂的方式獲得。一般情況下,穩健的制劑處方中,載藥量的限度是20%。但是圖3顯示直壓處方的載藥量限度可以高達59%。平均粒徑比和滲濾閾值之間有清晰的聯系,比例越大,載藥量越高。其可能的解釋與輔料中形成可壓性的化學結構有關,例如微晶纖維素。當輔料的粒徑一定時,API的粒徑越大,輔料越容易在API的周圍形成強的連接結構。粒徑比例小的情況卻正好相反,大量的粒徑很小,可壓性差的API粒子,可能會破壞輔料之間的連接。這個問題的關鍵點在于形成片劑估計并提供機械強度的材料。如果骨架是輔料,并且其比API有更好的機械性能,那么這種輔料形成骨架的片劑比API形成骨架的片劑機械性能更好。因此,當API的含量達到一定的水平后,輔料的量下降到不能再形成骨架,輔料粒子將被API隔開,進而由API形成骨架。如果API的可壓性較差,這種API形成的骨架本身比輔料形成的骨架脆弱,進而導致了頂裂和層裂。
注意,當API和輔料的粒徑接近時,默認的最低滲濾閾值大約是20%。因此,如果沒有任何數據的分析而進行處方設計時,應當注意20%這一限度。
滲濾閾值的方法也被用來理解干法制粒產品中輔料外加和內加的機理。外加輔料通常用來提高可壓性,例如微晶纖維素。通過數據挖掘,發現了兩個產品。讓人感興趣的是,盡管通過API的輔料的粒徑比推測最大的載藥量大概在30% w/w,但通過干法制粒將API制粒增大粒徑,最終片劑的載藥量達到了大約70~90%。利用滲濾閾值的理論,這也是可以解釋的。其關鍵在于形成片劑時干法制粒后的粒子和外加輔料的粒徑比。
圖3中展示了干法制粒的粒徑比和滲濾閾值,其斜率與直壓的產品幾乎一致。這表明當這些處方的主要變化是平均粒徑、粒徑分布和表面性質時,平均粒徑與滲濾閾值之間存在基本聯系。這些處方已經進一步優化,用于商業化生產。根據這個結果,針狀API在設計中可能存在問題。直壓和干法制粒的處方的粒子形狀應當是球形的,外加的輔料也應當是球形的,以形成連接結果。粒子的粒徑越小,形成連接所需的粒子數目越小(形成連接結構的輔料的粒徑應當越小)。這個概念的結果與對配位數和滲濾閾值的數學分析結果一致。
有人采用平臺化濕法制粒技術生產濕法制粒產品,我們采用滲濾閾值技術對其進行了研究。所謂平臺化濕法制粒技術,是指將API制粒形成粒子,再外加一定的輔料稀釋獲得特定API濃度,進一步壓制成片。濕法制粒的粒子的載藥量是40%,四個處方制劑的規格不同,但是尺寸一致,可以進一步用于臨床編盲。
四個不同的處方用于研究同樣的制粒API與不同的外加輔料的關系。外加輔料是最終混合物可壓性的主要貢獻者。經過對干法制粒的結果分析,我們已經清晰地認識到值得關注的是API制粒后所得粒子和輔料的粒徑比。在這個例子中,制粒粒子和外加輔料的粒徑比是1:1,根據圖4的結果,滲濾閾值大約是30%。表1展示了外加輔料的比例與頂裂之間的關系,結果清晰地顯示,當外加輔料的比例小于滲濾閾值時,出現了頂裂;外加輔料的比例大于滲濾閾值時,可以得到沒有缺陷的片。
表1. 外加輔料量和頂裂的頻率
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
在我們挖掘的這組數據中,不存在粒徑比低于0.5情況。但是,當我們研究一種被同時被開發為干法和濕法制粒產品的無定型API時,發現當粒徑比低于0.5時,可能存在潛在的相互作用,尤其是濕法制粒的情況。在濕法制粒處方中,API在制粒溶液中完全溶解,然后用于流化床制粒。在干法制粒的處方中,API與輔料的粒徑比是0.5。根據圖4的結果,理論推測滲濾閾值大約是20%。這兩個案例中,API的載藥量均是5%,低于預測的理論滲濾閾值之下。對兩個處方的應力速率敏感性進行了研究(片的抗張強度隨壓片速率的增加的變化率)。結果表明直壓處方對應力速率沒有敏感性,但濕法制粒處方對應力速率的敏感性非常顯著。可能是解釋是,溶解后的API在粒子表面干燥成膜,API粒徑接近于0,滲濾閾值則接近于0,因此在非常低的載藥量時,也具有應力速率敏感性。
這次數據挖掘盡管獲得化合物數量有限,但其結果顯示,滲濾閾值確實是預測工藝路線敏感性的工具。除此之外,還有其他研究者提供了相關的證據。有研究表明,干法制粒的滲濾閾值為20%的結果只適用于API的粒徑(D50)在50~165μm之間的強開。當API經過微粉化后(<10μm),滲濾閾值會小很多。以直壓為例,微粉化的API的滲濾閾值大約是5%,并且需要高速剪切混合讓API粘附在載體粒子(如微晶纖維素)的表面以實現定向混合。載藥量大于5%,API之間的粘附力讓其不太適用于干法制粒。
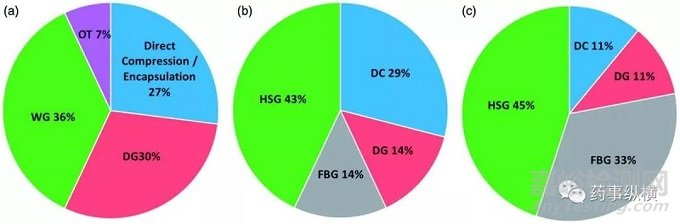
圖4. 工藝路線的選擇(a)BMS 的制劑(n=30),(b)Corden公司:早期處方開發(n=9);(c)Corden公司后期/商業化制劑開發;
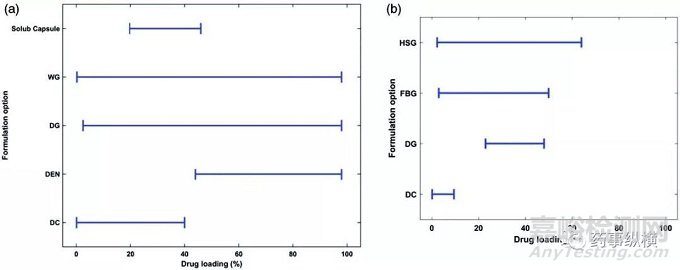
圖5. 載藥量與工藝選擇(a)BMS和(b)Corden。(DEN:直接填充膠囊;HSG:高剪切濕法制粒;FBG:流化床濕法制粒)
(2)BMS
圖4(a)中展示了BMS公司商業化的口服制劑的工藝選擇。選擇其他工藝和直壓工藝的處方的比例與制藥行業的整體水平基本相似。選擇濕法制粒的比例略低于行業平均水平(37% vs. 49%),而干法制粒處方比例相對較高(30% vs. 17%)。在載藥量方面,濕法制粒和干法制粒處方涵蓋了所有載藥量范圍(圖5(a));載藥量高于40%的處方不用直壓工藝;直接填充膠囊用于載藥量較高的處方。
(3)Corden制藥
Corden是一家CDMO。API的性質的測定以及工藝路線的選擇通常是由客戶確定的,并且通常不會分享給CDMO。另外,處理高活性化合物時,操作者的安全性、環境和病人是劑型和工藝選擇時需要考慮的額外因素。盡管所有的生產工藝都是受控的,但是生產過程中容易揚塵的工藝或者容易導致揚塵風險的劑型對于高活性化合物來說都不好的選擇。因此,薄膜包衣片相對于膠囊來說是更好的選擇,因為其可以減小處理過程中破碎的風險。Corden公司在歷史上,更喜歡采用濕法制粒,尤其是高劑量藥物。這是因為采用制粒后的粒子壓片可以減少壓片和處理過程中暴露在高活性塵埃中的風險。濕法制粒過程中,粘合劑的加入,通常可以提高片強度,減小其碎脆度。
總體上而言,濕法制粒是最為常用的工藝,超過80%的早期開發階段的化合物和超過半數的后期開發的化合物采用了這種工藝。濕法制粒的載藥量范圍可以從2%到64%。早期開發階段選擇濕法制粒工藝的原因主要是化合物的性質比較多變,這是早期開發中常見情況。而后期開發化合物選擇濕法制粒的原因在于在所需的載藥量下,API的理化性質選擇直壓工藝并不合適。當然,這里面可能還有對濕法制粒的歷史性偏好,與載藥量和API的性質無關,尤其是對于高活性化合物而言。
在濕法制粒工藝中,大部分制劑在開發的所有階段都采用HSG。而FBG在處于早期開發的過程中的藥物運用比較多,占濕法制粒的一半以上。這主要是該公司的歷史原因,該公司早期僅有HSG設備。FBG可以生產多孔的顆粒,進而促進難溶性藥物的釋放。此外,低規格的制劑采用FBG更容易生產,因為API可以溶解在粘合劑溶液中,緩慢噴灑。這促進了藥物在粒子中的均勻分布,進而提高了含量均勻度。
在藥物的所有開發階段,不采用濕法制粒的原因主要是穩定性。在這些不選擇濕法制粒的藥物中,低載藥量的藥物采用直壓工藝,而中等載藥量則采用干法制粒工藝。對于所有的直壓工藝,載藥量很低(<10%),符合上文中關于滲濾閾值的討論。這些直壓工藝通常采用幾次混合和過篩步驟以實現處方中物料的定向混合,以此避免后續喂料和壓片步驟中的離析。確定選擇直壓工藝通常是在后期開發的產品,此時API的性質一致性較好,因此生產問題的風險較小。此外,采用濕法制粒可以潤濕難溶性藥物,促進藥物從制劑中溶出。
6. 結論
在過去,生產工藝選擇的一般驅動因素是公司的傳統偏好和可用的生產設備,而今期望采用一個更為系統的、以科學為驅動的產品開發方法,即根據溶解度、劑量、載藥量以及化合物的開發階段選擇生產工藝。但是化合物的性質(粒徑分布或其他)選擇的合理性與化合物本身的需求和/或工藝的需求之間的聯系并不是確定性的。當化合物的性質可以得到改進時,選擇生產工藝在有的時候將更為復雜。目前,難溶性藥物的比例越來越多,它們的臨床劑量一般相當高,選擇濕法制粒可以提供足夠的溶解度和生物利用度。而采用一些賦能技術僅僅是針對極高劑量數(極為難溶)的藥物所采取的手段。對于CDMO而言,工藝路線的選擇是根據客戶的需求,而并非基于科學合理的判斷。但是,運用CDMO可以讓制藥公司獲得更多選擇不同生產工藝的機會,從而真正實現制造分類系統所描述的工藝多樣化選擇。

來源:Internet


