您當前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2020-02-28 11:16
作者:張文娟 , 趙萌 , 項新華 , 魏鋒 , 馬雙成
中國食品藥品檢定研究院, 北京 100050
摘要:目的: 考察相關實驗室執(zhí)行《中華人民共和國藥典》川貝母PCR-RFLP法鑒別檢驗項目的技術能力,促進分子生物學技術在中藥檢定中的廣泛應用。方法: 測試樣品為粉末,對樣品的均勻性和穩(wěn)定性進行評價,樣品種類分為陽性和陰性兩種,采用隨機單盲方式分配至參與能力驗證的實驗室。各實驗室按照作業(yè)指導書進行檢測,并以規(guī)定格式書寫原始記錄。檢測結果與樣品性質一致的實驗室為滿意。對各實驗室的反饋結果進行匯總和分析。結果: 最終報名參加的實驗室總計50家,能力驗證結果為滿意的26家,占52%,不滿意24家,占48%。其中3家試驗室未按要求返回結果,判定為不滿意。分別統(tǒng)計不同類型參加實驗室的滿意率,地市級食藥檢機構滿意率最高,為70.6%。結論: 總體滿意率偏低,川貝母PCR-RFLP法鑒別檢驗項目的整體技術水平有待提高。
關鍵詞:能力驗證 川貝母鑒別 PCR-RFLP
川貝母是我國傳統(tǒng)大宗中藥材, 具有良好的止咳化痰功效, 在中藥臨床和日常生活中應用甚廣[1]。近年來隨著其市場價格逐年攀升, 以貝母屬其他品種充當川貝母出售的現(xiàn)象亦愈加嚴重[2-3]。長期以來, 川貝母的鑒別檢驗主要依靠性狀鑒別, 但是, 有些混淆品的外觀性狀與川貝母十分相似, 很難就此作出客觀準確的判斷。DNA分子鑒定技術不會受到藥材外觀性狀變化的影響, 可從DNA水平實現(xiàn)準確鑒別, 伴隨著相關方法的不斷開發(fā)和完善, 對中藥鑒定的影響與日俱增[4-5]。自《中華人民共和國藥典》(以下簡稱《中國藥典》)2010年版第一增補本起, 川貝母項下收錄了聚合酶鏈式反應-限制性片段長度多態(tài)性(PCR-RFLP)方法, 用于川貝母鑒別。該方法較傳統(tǒng)性狀鑒別法客觀準確, 應在全國大力推廣應用[6-7]。然而, 由于分子生物學技術在中藥檢定中屬于比較新的技術, 在該藥典方法頒布之初, 很多藥檢機構在技術人員和實驗室設施等方面條件欠缺, 尚不具備該方法的檢驗能力。近年來, 中國食品藥品檢定研究院(以下簡稱中檢院)通過針對全國藥檢系統(tǒng)舉辦培訓班、培養(yǎng)地方藥檢所進修人員等方式, 為推廣和普及中藥分子鑒定方法做出大量努力。在中檢院的指導和幫助下, 一些藥檢機構建立了中藥分子生物學檢測實驗室, 并開始承接川貝母PCR-RLFP法鑒別檢驗項目, 但是, 這些實驗室在該項目的檢驗能力上還有待評估。
能力驗證即利用實驗室間比對, 按照預先制定的準則評價參加者的能力, 是實驗室質量保證體系中的一個重要組成部分。國家認可制度中對實驗室參加能力驗證并取得滿意結果提出了明確的要求[8]。2017年, 中檢院組織了川貝母PCR-RFLP法鑒別檢驗能力驗證項目(NIFDCPT-102), 旨在考察執(zhí)行《中國藥典》標準相關實驗室的技術能力和管理水平, 促進分子生物學技術在中藥檢定中的廣泛應用, 提高檢測水平, 為全面監(jiān)控中藥材的質量提供科學、可靠的技術平臺[9-10]。本文將對此次能力驗證活動的情況進行總結, 并對其中發(fā)現(xiàn)的問題進行解析, 以期為參與能力驗證的實驗室提高檢測能力和改進質量管理體系提供幫助。
1 能力驗證方法
1.1 檢測項目和要求
檢測項目為川貝母[鑒別]聚合酶鏈式反應限制性內切酶片段長度多態(tài)性(PCR-RFLP)法。本實驗方法依據(jù)《中國藥典》2015年版一部川貝母[鑒別]3要求, 并參照《作業(yè)指導書》的要求進行檢驗和報告結果。
1.2 能力驗證樣品描述
能力驗證樣品為川貝母粉末, 裝于1.5 mL離心管, 20 mg/管。每個實驗室發(fā)放1管。樣品源自留存的檢驗樣品, 分為陰性樣品和陽性樣品兩類, 依據(jù)CNAS GL03:2006《能力驗證樣品均勻性和穩(wěn)定性評價指南》對樣品進行均勻性和穩(wěn)定性評價[11]。檢驗合格后, 樣品通過EMS快遞分發(fā), 每個實驗室1份, 樣品的類型(陰性或陽性)為隨機單盲分配到各個實驗室。
1.3 結果評價原則
1.3.1 檢驗依據(jù)
按照《中國藥典》2015年版一部川貝母[鑒別]聚合酶鏈式反應-限制性內切酶片段長度多態(tài)性(PCR-RFLP)法的規(guī)定:供試品凝膠電泳圖譜中, 在與對照藥材凝膠電泳圖譜相應的位置上, 在100~250 bp位置應有兩條DNA條帶, 空白對照無條帶。
1.3.2 檢驗能力評定
根據(jù)藥典規(guī)定, 陽性(合格)樣品的檢測結果應為供試品凝膠電泳圖譜中, 在與對照藥材凝膠電泳圖譜相應的位置上, 于100~250 bp位置可見兩條DNA條帶, 空白對照無條帶。陰性(不合格)樣品的檢測結果應為供試品凝膠電泳圖譜中, 在與對照藥材凝膠電泳圖譜相應的位置上, 于100~250 bp位置未見兩條DNA條帶, 空白對照無條帶。根據(jù)以上要求, 各參加實驗室得出正確的檢驗結論即為滿意, 否則為不滿意。
2 結果
2.1 參加實驗室情況
本計劃共有50家實驗室報名參加, 發(fā)出樣品50份。3家實驗室在收到樣品后告知樣品破損, 給予及時補寄。另有3家實驗室收樣前未表示退出, 收樣后至今亦未反饋結果。最終, 本次能力驗證項目共47家實驗室按要求提交了結果報告單。
參加本次能力驗證的實驗室分布于全國20個省(自治區(qū))、直轄市, 浙江省最多(8家)。實驗室類型以各級食品藥品檢驗機構為主, 其中省級18家, 占比36%, 地市級17家, 占比34%;另有第三方檢測機構12家, 占比24%, 出入境檢驗檢疫機構3家, 占比6%。具體實驗室類型統(tǒng)計見圖 1。

圖 1 參加實驗室的類型統(tǒng)計
2.2 樣品均勻性與穩(wěn)定性測試
將所有待發(fā)放川貝母樣品混合均勻打粉, 取3份提取DNA并進行PCR-RFLP法檢測。陰性樣品和陽性樣品分別取樣檢測。3份樣品均得到一致預期結果:即陰性樣品皆有條帶擴增, 但不能被SmaⅠ酶切; 陽性樣品既有條帶擴增, 又能被SmaⅠ酶切割成兩個條帶, 大小在100~250 bp之間。以上結果表明樣品的均勻性良好。
將打粉后的樣品于室溫放置一個月后, 再次提取DNA并用PCR-RFLP法進行檢測, 發(fā)現(xiàn)得到的結果與一個月前基本一致。以上結果表明樣品的穩(wěn)定性良好。具體結果詳見圖 2、圖 3。

a.樣品打粉處理后PCR-RFLP結果;b.樣品打粉處理后室溫放置一個月PCR-RFLP結果。B.空白對照;M. DNA分子量標記DL2000;1~3.樣品。
圖 2 陰性樣品均勻性穩(wěn)定性測試
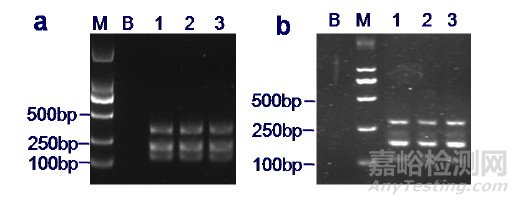
a.樣品打粉處理后PCR-RFLP結果;b.樣品打粉處理后室溫放置一個月PCR-RFLP結果。B.空白對照;M. DNA分子量標記DL2000;1~3.樣品。
圖 3 陽性樣品均勻性穩(wěn)定性測試
2.3 參加實驗室能力驗證結果統(tǒng)計
報名的50家實驗室中, 47家按要求反饋了結果。另3家實驗室因為在收到樣品前未表示退出, 收到樣品后未反饋結果, 判定為不滿意[12]。
能力驗證結果:滿意26家, 占52%;不滿意24家, 占48%, 見圖 4。對不同類型參加實驗室滿意率分別進行統(tǒng)計的結果見表 1。

圖 4 滿意率統(tǒng)計
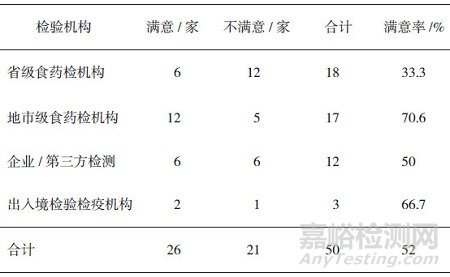
表 1 Table 1 表 1 不同類型檢驗機構滿意率統(tǒng)計
表 1 不同類型檢驗機構滿意率統(tǒng)計
3 技術分析和建議
在本次能力驗證中, 不滿意的技術原因主要歸結為以下三方面:
3.1 PCR擴增結果陰性
不論陰性還是陽性樣品, 都應有PCR擴增的條帶出現(xiàn)。PCR擴增結果陰性, 說明參加單位在DNA提取或者PCR試驗操作中存在不足, 需要通過規(guī)范化的練習提高這方面的試驗技能。大多數(shù)未通過能力驗證的實驗室都屬于這種情況, 說明該方面的問題具有普遍性。
3.2 陽性樣品有擴增條帶但酶切失敗
理論上, 陽性樣品應有擴增條帶且酶切成功, 凝膠電泳圖譜可見兩條酶切后的條帶。酶切試驗的影響因素較少, 可控性好, 試驗結果穩(wěn)定, 一般不容易在此步驟出現(xiàn)問題。而少數(shù)幾家實驗室結果顯示, 對照藥材可酶切, 樣品不能酶切, 由于對照藥材與樣品應為同時操作, 理論上不應出現(xiàn)此種情況。相關單位在今后試驗中應該特別注意將對照與樣品的平行操作貫穿始終。
3.3 結果正確, 結論錯誤
個別實驗室的原始記錄顯示得到了正確結果, 但最后結論中對結果的判斷有誤。例如結果出現(xiàn)了陽性酶切條帶, 但被描述為"隱約可見例", 最后結論判定為"不符合規(guī)定"。出現(xiàn)此種情況, 提示實驗人員對于標準規(guī)定的理解存在偏差。定性試驗中不應出現(xiàn)含糊的用詞, 實驗者應通過重復試驗確定究竟"可見"或"未見", 最終得到明確結果和正確判斷。
4 結論
本次能力驗證活動中, 總體滿意率僅為52%, 與其他能力驗證項目相比, 滿意率偏低, 說明對于這個檢測項目而言, 普遍的檢測水平有待提高。特別是省級藥檢機構的滿意率要低于市級, 這種情況在一般的能力驗證活動中并不多見, 強烈提示省級藥檢機構應在今后特別注意加強中藥分子鑒定技術相關檢驗檢測能力的訓練和儲備。一次能力驗證的結果只能證明實驗室參加本次能力驗證活動的情況, 不能全面體現(xiàn)實驗室的檢測水平。只有持續(xù)參加同一項目的能力驗證活動, 其總體結果才能反映實驗室的能力狀況[13]。此外, 未能通過此次能力驗證的實驗室, 還可以通過這個項目后續(xù)的測量審核活動重新評估檢測能力。本次能力驗證活動為各實驗室提供了一個衡量和驗證自我檢測能力的平臺, 同時也為政府管理部門和社會委托檢驗提供可靠的選擇依據(jù), 并對促進參加實驗室提高川貝母PCR-RFLP鑒別檢驗能力起到積極的推動作用。
參考文獻
[1] 中華人民共和國藥典: 一部[S]. 2015.
[2] 崔國靜, 石思佳, 宋桂英. 川貝母的來源與鑒別[J]. 首都醫(yī)藥, 2012, 19(9): 44. DOI:10.3969/j.issn.1005-8257.2012.09.024
[3] 羅焜, 馬培, 姚輝, 等. 基于ITS2序列鑒定川貝母及其混偽品基原植物[J]. 世界科學技術-中醫(yī)藥現(xiàn)代化, 2012, 14(1): 1153-1158. DOI:10.3969/j.issn.1674-3849.2012.01.003
[4] ZHANG W J, ZHANG X L, LI M H, et al. Identification of Chinese Caterpillar Medicinal Mushroom, Ophiocordyceps sinensis (Ascomycetes), from Counterfeit Species[J]. International Journal of Medicinal Mushrooms, 2017, 19(12): 1061-1070. DOI:10.1615/IntJMedMushrooms.2017024823
[5] 潘杰, 陳虹, 馮睿, 等. 雜交探針技術結合熔解曲線鑒別川貝母與伊貝母的研究[J]. 中藥新藥與臨床藥理, 2019, 30(3): 344-348.
[6] WANG C Z, LI P, DING J Y, et al. Simultaneous Identification of Bulbus Fritillariae Cirrhosae Using PCRRFLP Analysis[J]. Phytomedicine, 2007, 14(9): 628-632. DOI:10.1016/j.phymed.2006.09.008
[7] 張文娟, 劉薇, 魏鋒, 等. 聚合酶鏈式反應-限制性片段長度多態(tài)性法用于檢定川貝母摻偽情況的研究[J]. 藥物分析雜志, 2014, 34(10): 830-1835.
[8] 中國合格評定國家認可委員會. CNAS-RL01實驗室認可規(guī)則[S]. 2011.
[9] 中國合格評定國家認可委員會. CNAS-CL03能力驗證提供者認可準則[S]. 2010.
[10] 國際標準化組織/合格評定委員會. ISO/IEC 17025檢測和校準實驗室能力的通用要求[S]. 2005.
[11] 中國合格評定國家認可委員會. CNAS-GL03能力驗證樣品均勻性和穩(wěn)定性評價指南[S]. 2006.
[12] 中國合格評定國家認可委員會. CNAS-GL02能力驗證結果的統(tǒng)計處理和能力評價指南[S]. 2014.
[13] 中國合格評定國家認可委員會. CNAS-RL02能力驗證規(guī)則[S]. 2010.

來源:xml-data


