您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2025-08-14 18:55
在醫療領域,設備的安全性和有效性不僅取決于其技術性能,更與用戶體驗息息相關。一個用戶交互設計不良的醫療器械,即使功能強大,也可能因操作復雜、界面混亂而導致用戶使用錯誤,甚至危及患者和使用者的生命安全。
歐盟新實施的《醫療器械法規》(MDR, EU 2017/745)取代了原有的MDD指令,對醫療器械的可用性(Usability)提出了更嚴格的要求,并將其納入產品的全生命周期管理。
這意味著,制造商不但需要證明設備的技術合規性,還必須保證其整體的設計符合真實用戶的需求,從而最大限度地降低使用相關風險。
本文將系統解析MDR對可用性的核心要求,并提供企業應對策略,幫助醫療器械廠商順利通過合規審核。
01MDR框架下的可用性核心要求
1. 可用性工程(Usability Engineering)成為強制性過程
MDR法規中有明確要求,制造商必須建立系統的可用性工程過程(Usability Engineering Process, UEP),并符合IEC 62366-1標準。該過程涵蓋:
用戶需求分析(目標用戶、使用環境、使用場景)
用戶界面設計(硬件、軟件、標簽、說明書等)
使用風險評估(識別可能的操作錯誤及其影響)
驗證與確認(確保設計滿足用戶需求)
2. 強調“使用錯誤”(Use Error)管理
MDR特別關注“使用錯誤”(即非用戶故意導致的錯誤操作),要求制造商:
預測可能的錯誤(如按鈕誤觸、界面混淆)
評估錯誤的影響(是否會導致嚴重傷害?)
通過設計降低風險(如優化界面布局、增加防錯機制)
3. 用戶多樣性考量
MDR要求設備必須適應不同用戶群體,包括:
醫護人員(醫生、護士、技師等)
患者(老年人、兒童,殘障人士、非專業人員等)
使用環境差異(手術室,急診室、家庭護理、戶外急救等)
這意味著,同一款設備可能需要針對不同用戶群體進行定制化設計,例如:
家用血糖儀需簡化操作,避免復雜步驟
手術設備需考慮醫生在高壓環境下的操作習慣
02MDR對可用性驗證與確認的具體要求
MDR要求制造商進行可用性驗證(Verification)和可用性確認(Validation),二者區別如下:
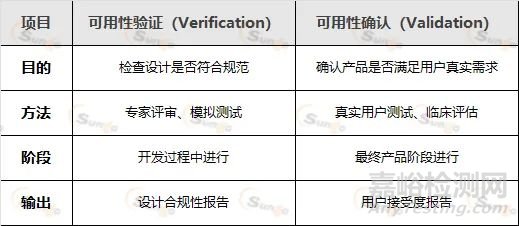
1. 可用性驗證(Verification)
專家評審:由人因工程專家評估界面設計是否符合標準
模擬測試:使用原型機進行實驗室測試,檢查潛在問題
2. 可用性確認(Validation)
用戶測試:招募真實用戶(如醫生、護士)實際操作
臨床評估:在真實醫療環境中觀察設備使用情況
03如何構建符合MDR的可用性文檔?
MDR要求制造商提供完整的可用性工程文檔,主要包括:
可用性工程計劃(UEP Plan)
描述可用性活動的目標、方法和時間表
用戶分析報告(User Analysis)
定義目標用戶(如醫生、患者)及其能力限制
使用場景分析(Use Scenarios)
描述設備在正常和緊急情況下的使用方式
使用風險評估(Use-Related Risk Analysis)
識別可能的操作錯誤及其影響
可用性測試報告(Usability Test Report)
包括測試方法、結果和改進措施
關鍵點:這些文檔必須與技術文件(Technical Documentation)和風險管理報告(RMR)中識別的可用性風險, 臨床評估報告(CER)保持一致,形成完整的證據鏈。
04企業如何應對MDR可用性要求?
1. 早期整合可用性工程
在產品概念階段引入可用性專家避免后期返工
采用迭代設計,不斷優化用戶體驗
2. 跨部門協作
設計團隊(優化界面)
工程團隊(確保技術可行性)
臨床團隊(驗證真實使用需求)
法規團隊(確保符合MDR要求)
3. 真實用戶參與測試
邀請醫生、護士、患者進行模擬操作
收集用戶的反饋并進行相應的優化設計
4. 上市后監督(Post-Market Surveillance)
持續收集真實用戶的使用反饋,監測以往可能未識別到的可用性問題,必要時發布設計更新或在說明書中補充有關的安全警示

來源:Internet


