您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-05-15 08:58
摘要
口崩片系指在口腔內不需要用水即能迅速崩解或溶解的片劑。口崩片作為片劑劑型之一,具有服用方便、在口腔內迅速崩解或溶解等優勢,有助于改善患者用藥依從性。本文結合口崩片相關指導原則、藥典標準及上市藥品情況,對口崩片處方工藝、質量研究和質量控制、穩定性和包裝等方面進行探討。希望有助于口崩片的開發,期待更多高質量口崩片上市,滿足特定患者的用藥需求。
【關鍵詞】口崩片; 處方工藝; 質量控制; 穩定性和包裝; 新藥注冊
口服給藥途徑是固體和液體制劑最普遍和推薦的給藥方式[1]。片劑以口服普通片為主,另有含片、舌下片、咀嚼片、分散片、可溶片、泡騰片、緩釋片、腸溶片與口崩片等。口崩片在特定疾病治療及特定人群使用方面具有一定優勢,與口服普通片相比,口崩片服用方便( 無需用水) 、在口腔內迅速崩解或溶解,能夠解決部分患者的吞咽困難問題,如老人和兒童,中風、臥床、食道問題、精神障礙患者等,從而改善患者用藥依從性,同時對旅行或者用水不便的人也是有益的[2-5]。目前,口崩片在全球上市品種越來越多,截至 2024 年 11 月,我國已批準具有有效批準文號的化學口崩片藥物約 43 種,主要為神經系統、消化系統、內分泌系統藥物。
口崩片的研發除遵循普通口服片劑藥學要求外,還應滿足迅速崩解或溶解、口感良好、容易吞咽,對口腔黏膜無刺激性等,在處方工藝和質量研究等方面應予以特殊關注。目前國內尚無口崩片藥學研究技術指導原則發布。本文對口崩片國內外藥典、指導原則及已上市藥品進行梳理,結合審評工作,重點對口崩片的處方及生產工藝、質量研究和質量控制、穩定性和包裝等方面進行介紹和探討,希望為口崩片藥學研究提供參考。
1.藥典中口崩片定義
《中國藥典》2020 年版( 四部) 0101 片劑通則[6]中口崩片定義為“在口腔內不需要用水即能迅速崩解或溶解的片劑”。《歐洲藥典》中口崩片定義為“一種無包衣片劑,吞咽前便在口腔中迅速分散。崩解試驗使用水作為溶劑,在 3 min 內解。”《日本藥典》中口崩片定義為“在口腔內迅速溶解或崩解進行服用的藥片”。《美國藥典》中定義口崩片為“可以放在舌頭上服用,當接觸到唾液會迅速崩解,因此不需要咀嚼、整片吞咽、用水服用”。《中國藥典》和《美國藥典》中明確了口崩片的使用方法不需要用水,《歐洲藥典》和《日本藥典》未明確說明。2020 年國家藥典委員會公布的“關于鹽酸格拉司瓊口崩片國家藥品標準草案”的公示中規定鹽酸格拉司瓊口崩片在口腔內迅速崩解,無砂礫感,口感良好[7]。
2.口崩片藥學研究關注點
口崩片的藥學研究可遵循普通口服固體制劑的相關要求,參考 ICH Q8 等指導原則,結合產品臨床目標人群的用藥需要、口崩片制劑特點和原料藥特性,科學合理設計試驗,重點關注口崩片硬度、脆碎度、崩解時限、溶出度和口感( 包括砂礫感) 等關鍵質量屬性。此外,產品開發時還需要考慮片劑的大小、片重、組成成分的溶解性以及這些因素對口崩片及其用途的影響。通過產品開發確定輔料種類及用量,穩定的生產工藝,合理的過程控制參數,確保產品質量符合預期質量要求。
需要說明的是,藥學研究工作正式開展前,應充分論證產品立題合理性及注冊分類。如按仿制藥進行開發,應先按國家局參比制劑遴選程序確認參比制劑; 如按改良新藥進行開發,需要結合藥物及臨床應用特點,充分論證口崩片劑型合理并評估臨床優勢后再開展研發工作。
2.1 處方開發
口崩片可參考 ICH Q8 等技術指導原則,通過處方開發確定合理處方。在口崩片藥物設計和開發時,首要考慮在唾液中應能迅速崩解或溶解,無需咀嚼或使用液體服用,崩解時限不能過長[8]。如果崩解時間太長或者需要液體服用,美國食品藥品監督管理局( FDA) 認為不適合開發成口崩片[8]。此外,應根據目標患者人群,設計合適的大小、片重和口感等,以提高患者用藥依從性,如對于兒童患者可設計小片徑的口崩片以便服用; 片重不宜過大,FDA 觀點建議不超過 500 mg[8]; 口感應良好,無明顯砂礫感或過多殘渣等。在人體生物等效性試驗或臨床試驗研究期間,也建議一并收集與上述患者用藥依從性相關的信息,如口腔內崩解時限、口感( 包括沙礫感) 和局部刺激性等信息,指導處方開發和優化。
2.1.1 原料藥
《中國藥典》2020 年版( 四部) 0101片劑通則中指出口崩片一般適合于小劑量原料藥物。目前口崩片規格一般在零點幾毫克到兩百毫克左右,大部分規格均在幾毫克到幾十毫克,故口崩片開發時,建議片重盡量要低。原料藥理化性質需要關注溶解度、口感、晶型、粒度及粒度分布等的研究和控制。對于小規格制劑,關注原料藥物料特性( 如粒度及粒度分布、密度) 對制劑工藝及含量均勻度的影響,制定相應控制策略。對于原料藥苦味特別大、刺激性較強的或劑量較大,通常不適宜開發成口崩片。
2.1.2 輔料
口崩片輔料應根據輔料特性及其在口崩片中的作用進行選擇,對可能影響口崩片硬度、脆碎度、崩解時限、口感( 包括砂礫感) 和溶出度等關鍵質量屬性的輔料功能性相關指標進行考察。口崩片輔料選擇時關注水不溶性輔料的使用,以免造成產品明顯砂礫感。在開發兒童口崩片時,需要關注輔料用量是否對兒童產生毒副作用,兒童患者與成人患者在口感方面可能存在差異。
填充劑是口崩片的主要組成輔料,常用填充劑包括甘露醇、微晶纖維素、木糖醇、預膠化淀粉、玉米淀粉、明膠、乳糖等。填充劑的選擇應關注填充劑號及用量的可壓性,對硬度、脆碎度、片重差異、崩解時限、口感和溶出度等影響。
崩解劑是口崩片的發揮制劑崩解特性的關鍵輔料,常用崩解劑包括交聯羧甲纖維素鈉、交聯聚維酮、低取代羥丙基纖維素、羧甲淀粉鈉、羧甲基纖維素、羧甲纖維素鈣等。崩解劑的選擇應關注崩解劑型號及用量對硬度、脆碎度、崩解時限、口感和溶出度等的影響。
口崩片應口感良好,對口腔黏膜無刺激性,根據依從性的需要,可添加矯味劑等或采用合適的掩味技術改善口感。例如,美國上市阿立哌唑口崩片采用矯味劑木糖醇、安賽蜜、阿司帕坦、香草香精進行矯味; 日本上市鹽酸美金剛口崩片采用矯味劑阿司帕坦和香料進行矯味,輔料甲基丙烯酸共聚物 LD可能為包衣材料,以掩蓋原料藥的苦味,提高順應性,專利顯示采用顆粒壓片包衣[9]。目前已上市口崩片普遍選擇采用一種或多種矯味劑進行矯味,常用矯味劑包括阿司帕坦、三氯蔗糖、安賽蜜、香精、無水枸櫞酸、木糖醇、薄荷腦等。可采用口嘗試驗、電子舌或其他科學方法對產品口感進行評價,建議關注砂礫感、苦味和刺激性等指標的口感評價,可參照《兒童用藥口感設計與評價的技術指導原則》[10]。
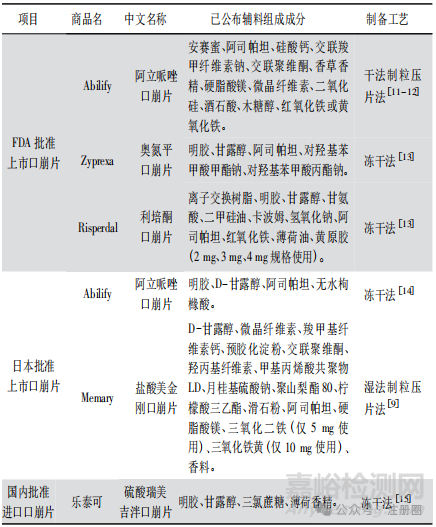
不同生產工藝( 如壓片法和冷凍干燥法) 口崩片在輔料選擇上具有一定差異,表 1 匯總了不同制備工藝的口崩片輔料組成情況,通常冷凍干燥法與壓片法相比,具有明顯的孔隙,崩解速度更快,使用輔料種類和用量相對較少。已上市凍干型口崩片常使用明膠、甘露醇作為填充劑。
▲表1-不同制備工藝的口崩片輔料組成
2.2 生產工藝開發
應根據口崩片特性,基于已有的生產經驗、文獻及參比制劑公開信息,參考 ICH Q8 等技術指導原則,選擇合適制備工藝,并選擇合理的考察指標對工藝進行全面的研究和驗證,最終得到持續穩定的生產工藝。
口崩片的性能取決于其制備中使用的技術[2]。《中國藥典》2020 年版( 四部) 0101 片劑通則介紹了口崩片可采用直接壓片和冷凍干燥法制備。基于審評情況來看,口崩片注冊工藝較多采用濕法制粒壓片和干法制粒壓片技術。壓片型口崩片的生產流程同普通片劑基本一致,一般包括配料、制粒、混合、壓片和包裝等工序,其中混合和壓片工序是口崩片生產的關鍵步驟。混合工藝應關注混合物料的流動性和可壓性,需要對混合步驟的儀器設備選擇、加料順序、混合時間、混合速度、取樣點數量與位置進行研究。對于小規格制劑等混合均勻性風險較高的產品,應根據工藝開發、工藝驗證等積累的數據確定商業化生產混合均勻度樣品的取樣方式及混合均勻度控制標準。混合均勻度研究可參考《化藥口服固體制劑混合均勻度和中控劑量單位均勻度研究技術指導原則》[16]進行研究。壓片工序工藝參數關注點與普通片劑基本一致。
凍干型口崩片是一種采用冷凍干燥工藝通過低壓升華快速除去水分,獲得疏松多孔的骨架結構,可快速崩解的速釋制劑。凍干型口崩片工藝流程一般包括藥液制備、藥液灌裝、速凍( 預凍) 、冷凍干燥和包裝等步驟。凍干型口崩片在凍干前如為混懸狀態存在,建議結合工藝研究及工藝驗證情況,制定控制措施確保各工藝階段物料混合均一及成品含量均勻度符合要求。速凍工序需要較低溫度時常采用液氮作冷卻劑,可實現快速冷凍制劑。冷凍干燥工序是凍干型口崩片生產的關鍵步驟,需要重點關注冷凍干燥階段速凍溫度和時間、凍干工藝參數等,以及凍干的裝載量和裝載方式。
2.3 質量研究與質量控制
口崩片的關鍵質量屬性通常包括但不限于性狀、崩解時限、硬度、脆碎度、含量、含量均勻度、溶出度、有關物質、水分、微生物限度等,可按照化學藥品質量控制相關指導原則開展研究。
2.3.1 崩解時限和溶出度
崩解時限和溶出度作為口崩片的關鍵質量屬性,在處方工藝開發、質量研究和穩定性研究都應該予以足夠重視。《中國藥典》2020 年版( 四部) 0101 片劑通則介紹了口崩片除冷凍干燥法制備的口崩片外,口崩片應進行崩解時限檢查[《中國藥典》2020 年版( 四部) 通則 0921]。對于難溶性原料藥物制成的口崩片,還應進行溶出度檢查[《中國藥典》2020 年版( 四部) 通則 0931],溶出度檢查儀器與方法與片劑一致。對于經腸溶材料包衣的顆粒制成的口崩片,還應進行釋放度檢查[《中國藥典》2020 年版( 四部) 通則 0931]。
表 2 和表 3 匯總了各國藥典崩解時限測定方法和崩解儀器,《美國藥典》和《英國藥典》測定方法和崩解儀器基本一致,崩解儀包含一個吊籃和 1 L 燒杯,吊籃由 6 根開放式透明管組成,升降的金屬支架上下移動距離為( 55±2) mm,往返頻率 30 ~ 32 次/min。《中國藥典》崩解儀器主要結構為一能升降的支架與下端鑲有篩網的不銹鋼管,升降的支架上下移動距離為 9~11 mm,往返頻為 30 次/min。
▲表2-國內外藥典崩解試驗分析方法及限度要求
▲表3-國內外藥典崩解試驗儀器結構

FDA 口崩片指導原則中介紹采用《美國藥典》<701>崩解時限方法或替代方法測定崩解時限,限度約為 30 s 或者更少。《歐洲藥典》規定口崩片在水中崩解時限為 3 min,《中國藥典》規定口崩片在水中的崩解時限不超過 60 s。目前《中國藥典》僅收載了阿立哌唑口崩片、利培酮口崩片,均未控制崩解時限。《美國藥典》收載部分口崩片的崩解時限匯總如表 4,基本不超過 60 s。基于國內外已批準上市產品崩解時限以及《中國藥典》規定,建議申請人制定質量標準中崩解時限不超過 60 s。
▲表4-美國批準上市口崩片崩解時限

國家藥品監督管理局藥品審評中心于 2023 年 12月在信息公開仿制藥共性問題中解答了“枸櫞酸西地那非口崩片崩解時限研究需要關注哪些問題”,內容為“對于口崩片,崩解時限是關鍵質量屬性”。現版《中國藥典》收載了專用于口崩片崩解時限檢查的裝置,該裝置為《中國藥典》所特有。枸櫞酸西地那非口崩片收載于《英國藥典》,采用普通崩解時限裝置進行崩解時限研究。在進行仿制藥崩解時限研究時,建議首選《中國藥典》口崩片崩解時限專用裝置進行仿制藥與參比制劑對比研究,應符合《中國藥典》附錄規定限度。如采用普通崩解時限裝置進行崩解時限檢查,建議同時采用兩種裝置進行仿制藥與參比制劑對比研究,詳細記錄崩解時間及現象,說明不采用《中國藥典》口崩片專用崩解時限裝置的依據,并擬訂合理限度”[18]。基于審評經驗,對于其他口崩片產品也可參照上述答復進行崩解時限研究。申報資料中應明確儀器裝置、崩解介質、溫度、體積、崩解現象、限度要求等。此外,建議產品開發時建立合適的體外試驗來模擬口崩片在口腔內給藥實際情況,參考同類產品及文獻研究方法,采用少量溶劑建立崩解時限檢查方法,擬定合理控制限度。檢查方法可為動態崩解測定法或靜態崩解測定法,少量溶劑可選擇如水、人工唾液等,根據產品特性開發出合理的崩解時限的方法,關注方法體內外相關性,如采用將口崩片放入崩解籃再放入少量溶劑中; 將口崩片直接放入少量溶劑的試管和燒杯中; 設計裝置考察口崩片在少量溶劑情況下能否通過篩網等方法。靜態方法開發過程中關注少量溶劑體積和溫度的選擇,動態方法還要關注轉速等,為了建立可行的方法,必要時可同時設計幾個試驗進行比較,仿制藥開發時建議與參比制劑進行對比研究。
對于溶出度,應基于原料藥的理化性質以及制劑特性,參考《普通口服固體制劑溶出度試驗技術指導原則》等技術要求,研究建立溶出行為考察和溶出度檢查方法,并對方法的區分力進行考察,制定合理的溶出度控制限度。
2.3.2 脆碎度
口崩片通常應進行脆碎度檢查,可采用《中國藥典》片劑脆碎度檢查法<0923>。考慮到冷凍干燥法制備的口崩片特殊性,可不進行脆碎度檢查。在脆碎度檢查時,對易吸潮的產品,操作時應注意防止吸濕( 通常控制相對濕度小于 40%) 。
2.3.3 其他
對于口崩片其他關鍵質量屬性,如含量、含量均勻度、有關物質、硬度、殘留溶劑、水分、微生物限度等,建議參照相關技術要求開展研究。
仿制藥應與參比制劑進行全面的質量對比研究,且質量不低于參比制劑。存在功能性刻痕的口崩片需參照《化學仿制藥口服片劑功能性刻痕設計和研究技術指導原則》[17]進行研究,在質量標準性狀項下需要增加刻痕描述。
除常規理化特性對比外,藥學開發及臨床期間應關注口感( 包括砂礫感) 等數據的收集。
2.4 穩定性和包裝
按照 ICH Q1、《化學藥物( 原料藥和制劑) 穩定性研究技術指導原則( 修訂) 》[19]等開展口崩片穩定性研究。穩定性考察指標應包括脆碎度、水分、溶出度、崩解時限等口崩片特性指標。對于多劑量包裝的產品,應結合臨床使用情況、參考相關指導原則進行使用中穩定性試驗。仿制藥的穩定性結果應不低于參比制劑。口崩片包裝形式和普通片劑基本一致,對易吸濕口崩片,應選擇密封性和防水性較好的包裝材料,包裝內也可添加干燥劑,如硫酸瑞美吉泮口崩片包裝采用聚氯乙烯/聚酰胺/鋁/聚酰胺/聚氯乙烯冷沖壓成型固體藥用復合硬片,并用可剝離鋁箔密封;阿立哌唑口崩片內包裝為鋁泡罩包裝。
3.結語
口崩片與傳統口服普通片劑相比,具有服用方便、在口腔內迅速崩解或溶解等優勢,有助于改善患者用藥依從性,對兒童和老年等吞咽困難患者來說是一種較為理想的選擇。本文匯總梳理國內外藥典標準及指導原則,結合審評工作,重點對口崩片處方開發、生產工藝開發、質量研究與質量控制、穩定性和包裝等方面藥學關注點進行介紹。申請人在開發口崩片時應結合劑型特點、臨床需求、參比制劑信息等綜合考慮立題合理性,研發出更多高質量口崩片產品。希望通過上述介紹,能夠有助于口崩片類產品的開發,滿足特定患者的用藥需求。
參考文獻
[1] JASSEM N A. Orodispersible tablets: a review on recenttrends in drug delivery[J]. Int J Drug Policy,2022,12( 1) : 432-436.
[2] NAGAR P,SINGH K,CHAUHAN I,et al.Orally disintegrating tablets: formulation,preparation techniques and evaluation[J].J Appl Pharm Sci,2011,1( 4) : 35-45.
[3] PAHWA R,PIPLANI M,SHARMA P C,et al.Orally disintegrating tablets - Friendly to pediatrics and geriatrics[J].Arch Appl Sci Res,2010,2( 2) : 35-48.
[4] KLANCKE J. Dissolution testing of orally disintegratingtablets[J].Dissolution Technol,2003,10( 2) : 6-9.
[5] GHOURICHAY P M,KIAIE S H,NOKHODCHI A,et al.Formulation and quality control of orally disintegrating tablets( odts) : recent advances and perspectives[J].Biomed Res Int,2021( 2021) : 6618934.
[6] 國家藥典委員會.中華人民共和國藥典 2020 年版( 四部) [S].北京: 中國醫藥科技出版社,2020.
[7] 國家藥典委員會.關于鹽酸格拉司瓊口崩片國家藥品標準草案的公示[EB/OL].( 2020-03-25) [2024-12-10].https: / /zy.yaozh.com/biaozhun/51ea92a2d09515597f476ca4d4d3b91a.pdf.
[8] USFDA.Guidance for industry orally disintegrating tablets
[EB/OL].( 2008-12) [2024-12-10].https: / /www.fda.
gov /media /70877 /download.
[9] 關口學,早川良一,原佳宏.口腔崩解片及其制造方法:106913553A[P].2017-04-04.
[10] 國家藥品監督管理局藥品審評中心.兒童用藥口感設計與評價的技術指導原則[EB/OL].( 2022- 11- 02)[2024- 12 - 10]. https: / /www. cde. org. cn /main /news/viewInfoCommon /35fa15bba5721b0c653262d14792f3b6.
[11] SANJEEV K,DIVYAKANT D.Flashmelt oral dosage for mulation: 8518421B2[P].2013-08-27.
[12] S·科塔里,D·德賽.快速熔融口服劑型: 1561200A[P].2005-01-05.
[13] ABAY F B,UGURLU T. Orally disintegrating tablets: ashort review[J].J Pharm Drug Devel,2015,3( 3) : 303.
[14] 平崗祥吾.阿立哌唑的凍干制劑: 108379231A[P].2018-08-10.
[15] FDA.212728Orig1s000 product quality review( s) [EB/OL].
( 2020-02-27) [2024-12-10].https: / /www.accessdata.fda.gov/
drugsatfda_docs/nda/2020/212728Orig1s000ChemR.pdf.
[16] 國家藥品監督管理局藥品審評中心.化藥口服固體制劑混合均勻度和中控劑量單位均勻度研究技術指導原則[EB/OL].( 2022-02-18) [2024-12-10].https: / / www.cde.org.cn/main/news/viewInfoCommon/ddc61dacf5e355d67f780f5202dde110.
[17] 國家藥品監督管理局藥品審評中心.化學仿制藥口服片劑功能性刻痕設計和研究技術指導原則[EB/OL].( 2020- 10 - 22) [2024 - 12 - 10]. https: / /www. cde. org.cn /Main /news/viewInfoCommon /a6374288f6427e1cb389c42c52eca0ad.
[18] 國家藥品監督管理局藥品審評中心.化學仿制藥共性問題[EB/OL].( 2023-12-14) [2024-12-10].https: / /www.cde.org.cn/main/xxgk/listpage /07edef25f1e7354bfd8490baa0ce056b.
[19] 國家食品藥品監督管理總局.化學藥物( 原料藥和制劑) 穩定性研究技術指導原則[EB/OL].( 2015- 02-05) [2024-12-10].https: / /www. cde. org. cn /zdyz/dom esticinfopage? zdyzIdCODE=6b9ad2450b24b5190bdc3156c341d3f3.

來源:藥學研究


