您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-04-06 17:03
導語
在可吸收生物電子設備領域,開發毫米級可降解光電系統以實現心臟電刺激具有重要意義。本研究通過構建包含鎂合金陽極、三氧化鉬陰極和硅光敏晶體管的自供能心臟起搏器,結合無線光學控制機制,深入探究了可吸收材料在心臟起搏中的應用潛力。研究發現,該設備通過近紅外光激活,能夠在多種動物模型中實現精確的心臟起搏,且無需外部電源,主要通過生物可吸收材料的電化學反應提供動力。實驗表明,該設備在植入后可維持16天以上的穩定運行,且在植入后1.2至2.5年內完全生物降解,無須二次手術取出。相關研究成果已發表在《Nature》期刊上,為未來可吸收醫療設備的設計和應用提供了新的視角。
研究背景
傳統心臟起搏器依賴外部電源和導線傳輸能量,其工作原理基于電極與心肌組織的直接接觸,通過電信號刺激心臟收縮。然而,這種技術受限于侵入性手術、感染風險以及對患者的長期生理負擔。為突破這些局限,本研究提出了一種基于生物可吸收材料的光電系統,通過自供能機制和無線光學控制實現心臟起搏。
該設備的核心原理在于利用鎂合金和三氧化鉬構建原電池,通過心肌組織和生物液體作為電解質形成電化學反應。鎂的氧化反應和三氧化鉬的還原反應共同產生電流,而硅光敏晶體管則作為光學開關,通過近紅外光信號調控電路的通斷。這種設計不僅實現了完全的生物可吸收性,還通過光控機制實現了精確的電流調節,為心臟電刺激提供了一種全新的技術路徑。
此外,設備的毫米級尺寸和無線光學控制機制使其能夠通過微創注射或血管內遞送植入,顯著降低了手術創傷和患者風險。實驗驗證了該設備在多種動物模型中的有效性,并展示了其在多點同步起搏和閉環控制方面的潛力。這一研究為心臟電刺激領域提供了原理性突破,同時為未來可吸收醫療設備的設計奠定了理論和實驗基礎。
2.研究概述
本研究聚焦于心臟電刺激技術的創新應用,通過開發一種毫米級可吸收光電系統,深入探索其在心臟起搏中的潛力。該設備基于自供能機制和無線光學控制,利用鎂合金陽極、三氧化鉬陰極和硅光敏晶體管構建電極系統,并結合生物可吸收材料實現完全降解。研究通過多種動物模型,驗證了設備在植入后能夠通過外部光強調節剛度和輸出電流,并在1.2至2.5年內完全降解。實驗采用微創注射和血管內遞送方式植入設備,結合三維光學模擬和電生理記錄,驗證了設備在不同深度組織中的穩定運行能力。研究結果表明,該設備能夠實現單點和多點同步起搏,并支持閉環控制系統,為心臟再同步治療和雙腔起搏提供了全新解決方案。此外,設備的材料設計和工程機制具有廣泛的適用性,可擴展到神經再生、骨骼修復和疼痛管理等電刺激療法中。本研究通過對可吸收材料與無線光學控制的創新結合,為心臟電刺激領域提供了突破性解決方案,同時為未來個性化醫療和精準治療提供了堅實的技術基礎。

圖1. 設備設計。尺寸:1.8毫米×3.5毫米×1毫米,與一粒米相當。
(圖片來自論文)
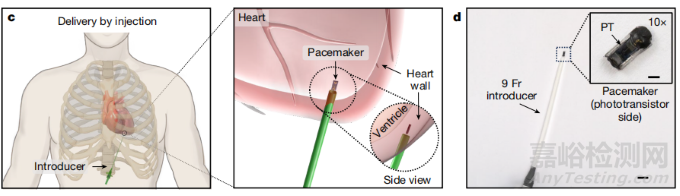
圖2. 通過微創注射植入心肌。(圖片來自論文)
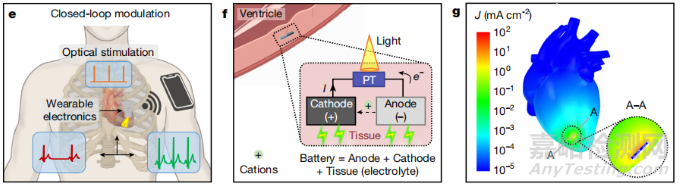
圖3. 通過外部光信號實現無線光學控制的閉環調節機制。光敏晶體管在光照下降低電阻,激活由陽極、陰極和組織電解質構成的原電池。
(圖片來自論文)

圖4. 設備的生物可吸收性及其降解過程。鎂陽極和三氧化鉬陰極分別生成氫氧化鎂和鉬酸,硅光敏晶體管和聚酸酐封裝材料最終降解為水溶性產物并被人體排出。
(圖片來自論文)



圖5. 起搏器在人體心臟模型中的應用,以及起搏時的EDG信號(包括左心室、右心室和希氏束的起搏效果)。放置后效果良好。
(圖片來自論文)

圖6. (a)在大鼠中的植入位置;(b)設備實物圖;(c)設備結構;(d)設備的硬件架構和工作流程。在(d)中,設備通過透皮電極采集ECG信號,經過模擬前端(AFE)放大和濾波后,由Cortex M4 CPU進行數據處理。CPU通過藍牙模塊將數據傳輸到外部設備,并根據心率檢測結果自動控制LED的光刺激,實現閉環調節。
(圖片來自論文)
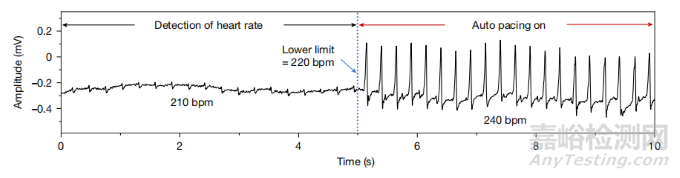
圖7. 在大鼠模型中的實驗效果。ECG記錄顯示了設備在檢測到心率低于設定閾值(220 bpm)時自動啟動起搏,將心率提升到240 bpm。
(圖片來自論文)
3.研究意義
本研究通過開發毫米級可吸收光電心臟起搏器,提出了一種基于自供能機制和無線光學控制的全新技術路徑,揭示了生物可吸收材料在心臟電刺激領域的應用潛力。設備通過鎂合金陽極、三氧化鉬陰極和硅光敏晶體管的協同作用,實現了完全的生物可吸收性,并通過外部光信號精確調控心臟起搏。這一技術不僅克服了傳統起搏器的侵入性、感染風險和術后護理負擔,還為心臟再同步治療和雙腔起搏提供了全新解決方案。設備的微創植入方式和廣泛適用性使其在神經再生、骨骼修復和疼痛管理等領域具有重要應用前景。此外,該技術為經導管主動脈瓣置換術(TAVR)術后傳導障礙的管理提供了創新解決方案,簡化了手術流程并降低了術后并發癥風險,顯著改善了患者的術后生活質量。這一研究為心臟電刺激技術及相關領域的理論完善和臨床應用提供了重要推動作用。
文章來源:Yamin Zhang, Eric Rytkin, Liangsong Zeng, et al. Millimetre-scale bioresorbable optoelectronic systems for electrotherapy. Nature, 2025; 640: 77-86 DOI: 10.1038/s41586-025-08726-4

來源:Internet


