您當前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2025-03-29 10:35
|
NDA序號 |
214373 |
|
申請人 |
Theracos Sub LLC |
|
藥物名 |
Brenzavvy (bexagliflozin) 片 |
|
劑型 |
片劑 |
|
規(guī)格 |
20mg |
|
給藥途徑 |
口服 |
|
Rx/OTC分類 |
Rx |
|
適應癥 |
成人2型糖尿病控制 |
|
制劑性狀 |
藍色、膠囊形、雙凸、斜邊、薄膜包衣片,一側印有有“2”和倒置的“2”,另一側沒有印字。片劑包裝在30ct或90ct高密度聚乙烯(HDPE)瓶中,帶有(b)(4)封口(b)(4)。 |
|
存儲條件 |
在20°C至25 °C下儲存,允許在15°C至30°C之間短暫儲存。 |
生物藥劑學
Theracos Sub, LLC申請擬定的Bexagliflozin片,20毫克。為藍色薄膜涂層速釋片,在擬定的溶出方法中具有延長的體外藥物釋放特征。FDA重點審評了擬定的質量控制溶出方法和標準的可接受性。
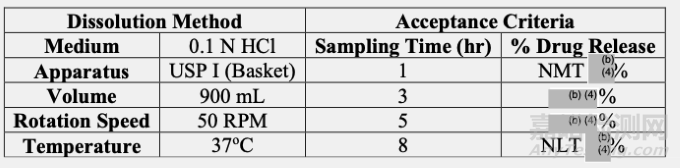
溶解方法和驗收標準:
根據(jù)所提供的信息,擬定溶出方法和溶解驗收標準是可以接受。
BCS定義
溶解度
申請人確定了原料藥Bexagliflozin在KCl/HCl緩沖液(pH 1.0)、NaOAc/HOAc緩沖液(pH 4.5)和NaOH/KH2PO4緩沖液(pH 7.6)中的飽和濃度。沒有觀察到溶解度隨pH變化而顯著變化。溶解度的平均值在37°C下16小時后為0.44、0.46和0.46mg/ml,在37°C條件下,24小時后為0.45、0.51和0.43mg/ml,pH值分別為1.0、4.5和7.6。
擬定的商業(yè)化規(guī)格為20毫克,在上述任何緩沖液中很容易溶解在250ml中,因此申請人認為,根據(jù)BCS標準,Bexagliflozin原料藥是一種高溶解性化合物。
FDA同意申請人對原料藥的溶解度定性,其滲透性為低至中。
制劑溶出方法
區(qū)分力
申請人使用擬定的溶出方法評估了Bexagliflozin片的溶出速率:20毫克規(guī)格含不同比例和等級的輔料。
增加片劑重量
申請人進行了一系列實驗,以確定增加片劑總重量對溶出曲線的影響。片劑總重量的變化涉及添加影響片劑釋放的輔料。具體見下表:

申請人觀察到,片劑重量增加,溶出會變慢,如下圖。

SUPAC級別的輔料變化
申請人進行了一系列研究,以確定SUPAC I級和II級變化對處方的影響(表4)。

申請人觀察到了輔料的比例變化,會影響到Bexagliflozin片的溶出速率,如下圖。

申請人對擬定商業(yè)化處方中的輔料數(shù)量變化進行了額外的確認性研究。處方中心點(表5中3、4和11代表商業(yè)化處方。其他(1、2、5、6、7、8、9和10)使用表5第一行所示的可變輔料用量。
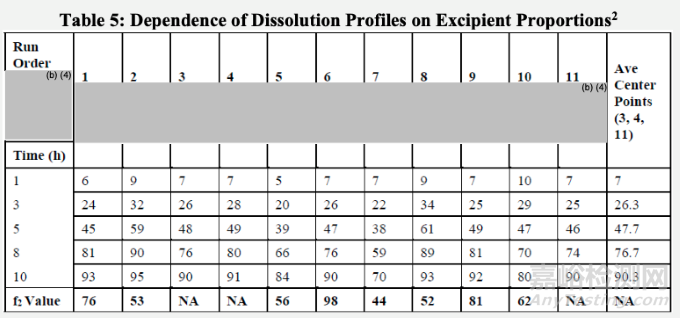

如表5和圖5所示:
申請人觀察到XX輔料數(shù)量變化,與中心點處方對比,沒有顯著影響溶出曲線。同樣,XX輔料數(shù)量的一致增加或減少(6和9),對中心點處方對比,沒有顯著影響溶出曲線。然而,XX輔料量的變化顯著影響溶出速率(2、5、7和8)。溶出方法可以用于區(qū)分這些輔料比例變化得到的制劑。
輔料PSD變化
申請人使用不同PSD大小的輔料制備得到的制劑溶出如下,發(fā)現(xiàn)使用大PSD的輔料得到的制劑溶出速率更快。

申請人同時使用不同級別輔料生產(chǎn)的制劑,溶出曲線結果表明,不同級別輔料得到的制劑溶出沒有明顯區(qū)別。
原料藥粒度大小變化
申請人使用不同PSD原料藥批次制備得到的制劑,發(fā)現(xiàn)溶出速率的系統(tǒng)性變化很小。

FDA評估:申請人充分證明了擬定溶出方法對商業(yè)化Bexagliflozin片的批次釋放和穩(wěn)定性測試的適用性。擬定溶出方法顯示了對制劑中輔料比例和不同粒度輔料變化的區(qū)分能力。
擬定溶出方法(900毫升0.1 N HCl,USP方法I,50轉/分)可以滿足用于商業(yè)化制劑的質量控制。
解讀:
雖原料藥在不同pH值溶液中的溶解度不高,但基于商業(yè)化規(guī)格20mg,在250ml的緩沖液中很易溶解,因此原料藥被定義為高溶化合物。
Bexagliflozin制劑溶出方法開發(fā),考察了不同輔料比例的制劑,不同粒度輔料的制劑,擬定溶出方法具有一定區(qū)分能力。對于不同級別輔料,不同粒度原料藥的制劑,擬定溶出方法不具有區(qū)分力。FDA認可了申請人擬定的溶出方法。

來源:Internet


