您當(dāng)前的位置:檢測(cè)資訊 > 科研開(kāi)發(fā)
嘉峪檢測(cè)網(wǎng) 2025-02-17 08:57
導(dǎo)言
醫(yī)療器械設(shè)計(jì)輸入必須全面且符合現(xiàn)實(shí)需求,要以明確、可驗(yàn)證(能通過(guò)客觀分析、檢查或測(cè)試方法)以及可量化的術(shù)語(yǔ)來(lái)定義。為保證設(shè)計(jì)輸入的充分性,需依據(jù)具體產(chǎn)品類型(如體外診斷設(shè)備[IVD]、植入式醫(yī)療器械、有源醫(yī)療設(shè)備、無(wú)源耗材等)進(jìn)一步細(xì)化輸入清單,確保涵蓋產(chǎn)品全生命周期管理要求。
此外,由于不同國(guó)家和地區(qū)的法規(guī)要求存在差異,設(shè)計(jì)輸入應(yīng)按照目標(biāo)市場(chǎng)的具體法規(guī)進(jìn)行調(diào)整,以保證在各個(gè)國(guó)家和地區(qū)的合規(guī)性。
一、醫(yī)療器械設(shè)計(jì)輸入
1.1設(shè)計(jì)輸入的基本來(lái)源
在醫(yī)療器械完成設(shè)計(jì)立項(xiàng)和設(shè)計(jì)策劃后,產(chǎn)品進(jìn)入設(shè)計(jì)輸入階段。設(shè)計(jì)開(kāi)發(fā)立項(xiàng)文件和設(shè)計(jì)策劃文件是產(chǎn)品設(shè)計(jì)輸入的基礎(chǔ)內(nèi)容。具體輸入涵蓋以下方面:
①用戶需求:明確目標(biāo)用戶的期望與使用場(chǎng)景,確保產(chǎn)品具備功能性、易用性和安全性。
②監(jiān)管需求:滿足相關(guān)法規(guī)標(biāo)準(zhǔn)(如ISO 13485、FDA 21 CFR Part 820、歐盟MDR等)的要求,確保合規(guī)性。
③產(chǎn)品需求:定義產(chǎn)品的性能指標(biāo)、技術(shù)規(guī)格、材料選擇以及制造工藝要求。
④市場(chǎng)需求:結(jié)合市場(chǎng)調(diào)研結(jié)果,確保產(chǎn)品符合目標(biāo)市場(chǎng)的實(shí)際需求和競(jìng)爭(zhēng)環(huán)境。
⑤初始風(fēng)險(xiǎn)管理分析:基于風(fēng)險(xiǎn)評(píng)估工具,識(shí)別潛在風(fēng)險(xiǎn)并制定相應(yīng)的緩解措施。
1.2.醫(yī)療器械設(shè)計(jì)輸入的規(guī)范化要求
①文檔化管理:所有設(shè)計(jì)輸入內(nèi)容均需形成書面記錄,并經(jīng)過(guò)評(píng)審和批準(zhǔn),確保其完整性和可追溯性。
②多方參與:邀請(qǐng)跨職能團(tuán)隊(duì)(如研發(fā)、質(zhì)量、法規(guī)、市場(chǎng)、生產(chǎn)等)共同參與設(shè)計(jì)輸入的制定,確保各方面的需求得到充分考慮。
二、醫(yī)療器械設(shè)計(jì)輸入法規(guī)解讀
2.1產(chǎn)品要求的可追溯性
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》對(duì)醫(yī)療器械的采購(gòu)、生產(chǎn)、檢驗(yàn)、銷售、售后服務(wù)有明確的可追溯性要求,雖然在設(shè)計(jì)開(kāi)發(fā)要求中未明文規(guī)定,但也隱含了可追溯要求。GBT 42061-2022設(shè)計(jì)開(kāi)發(fā)策劃部分規(guī)定應(yīng)將“確保設(shè)計(jì)和開(kāi)發(fā)輸出到設(shè)計(jì)和開(kāi)發(fā)輸入的可追溯的方法”形成文件。
2.2明確設(shè)計(jì)開(kāi)發(fā)輸入要求
設(shè)計(jì)開(kāi)發(fā)輸入考慮不全面可能會(huì)遺漏部分法規(guī)要求。為此,建議充分利用《醫(yī)療器械安全和性能的基本原則》,逐條核對(duì)其中內(nèi)容是否適用,若適用,需要考慮的法規(guī)標(biāo)準(zhǔn)是什么,需要制定何種指標(biāo)來(lái)滿足要求等。對(duì)照產(chǎn)品適用的法規(guī)標(biāo)準(zhǔn),檢查是否有相關(guān)風(fēng)險(xiǎn)遺漏。
2.3充分利用設(shè)計(jì)開(kāi)發(fā)評(píng)審
GBT 42061-2022明確要求設(shè)計(jì)開(kāi)發(fā)輸入應(yīng)完整、明確,可被驗(yàn)證或確認(rèn),且不能自相矛盾。FDA QSR 820也要求,設(shè)計(jì)開(kāi)發(fā)程序應(yīng)包括處理不完整、不清楚或相互矛盾要求的方法。GBT 42061-2022和《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》均要求在設(shè)計(jì)開(kāi)發(fā)策劃階段明確各階段應(yīng)進(jìn)行的評(píng)審。如評(píng)審認(rèn)為需修改或更新設(shè)計(jì)開(kāi)發(fā)輸入,可將評(píng)審結(jié)果合并到設(shè)計(jì)開(kāi)發(fā)輸入中。
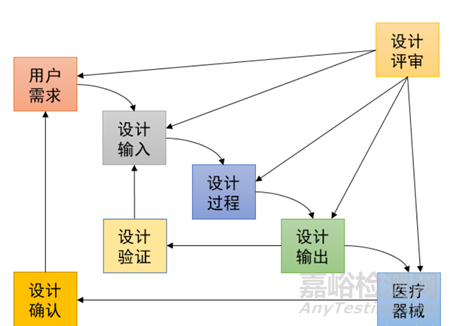
醫(yī)療器械瀑布式設(shè)計(jì)控制過(guò)程
2.4持續(xù)跟蹤法規(guī)要求
設(shè)計(jì)開(kāi)發(fā)輸入是一個(gè)動(dòng)態(tài)變化的過(guò)程,法規(guī)標(biāo)準(zhǔn)及規(guī)范性文件作為輸入的重要組成部分,其要求也會(huì)更新。持續(xù)跟蹤法規(guī)要求并分析法規(guī)變化對(duì)產(chǎn)品符合性的影響,對(duì)設(shè)計(jì)出符合要求的產(chǎn)品至關(guān)重要。產(chǎn)品研制過(guò)程中有新的標(biāo)準(zhǔn)發(fā)布實(shí)施時(shí),需評(píng)估是否要更新設(shè)計(jì)開(kāi)發(fā)輸入。
三、醫(yī)療器械設(shè)計(jì)輸入列表示例
作者是有源醫(yī)療器械方面的研發(fā)專家,因此對(duì)有源醫(yī)療器械方面舉例。不同醫(yī)療器械、不同國(guó)家和地區(qū)都有不同要求,設(shè)計(jì)輸入都有差異,需根據(jù)實(shí)際情況調(diào)整。

四、醫(yī)療器械設(shè)計(jì)輸入輸出設(shè)計(jì)追溯矩陣舉例
醫(yī)療器械設(shè)計(jì)輸入需設(shè)計(jì)輸入輸出設(shè)計(jì)追溯矩陣,在企業(yè)內(nèi)部正式應(yīng)用 ,需根據(jù)GB/T42061體系中4.2.4文件控制要求編制各項(xiàng)信息,本文由于字?jǐn)?shù)限制,只保留最核心部分。
|
|
|
|
|
|
|
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
|
|
|||||
五、結(jié)語(yǔ)
綜上,設(shè)計(jì)開(kāi)發(fā)輸入要求是一個(gè)不斷迭代、逐步優(yōu)化的過(guò)程。很少能一步到位。充分利用設(shè)計(jì)開(kāi)發(fā)輸入評(píng)審,形成發(fā)現(xiàn)問(wèn)題、解決問(wèn)題的良性循環(huán),對(duì)解決設(shè)計(jì)開(kāi)發(fā)輸入問(wèn)題具有重要意義。
本文引用以下兩篇文獻(xiàn):
1. 設(shè)計(jì)開(kāi)發(fā)輸入與醫(yī)療器械注冊(cè)申報(bào)資料關(guān)系探討 孫克英 陳敏 曹越《中國(guó)醫(yī)療器械信息》雜志2021年第27卷第23期;
2.醫(yī)療器械設(shè)計(jì)開(kāi)發(fā)控制手冊(cè)/(美)瑪麗·B.特謝拉著;衛(wèi)根學(xué),潘孔榮,張進(jìn)進(jìn)譯.-上海:上海世界圖書出版公司,ISBN978-7-5192-9150-1;

來(lái)源:醫(yī)械研發(fā)筆記


