您當(dāng)前的位置:檢測(cè)資訊 > 科研開發(fā)
嘉峪檢測(cè)網(wǎng) 2025-02-06 13:01
2025年1月29日,專注于創(chuàng)新骨科植入解決方案的OrthoPreserve公司宣布,其Defender半月板替代植入物獲得了美國(guó)食品和藥物管理局(FDA)的突破性設(shè)備認(rèn)定和全生命周期咨詢計(jì)劃(Total Product Life Cycle Advisory Program,簡(jiǎn)稱TAP)的入選資格。
Defender植入物旨在治療那些在半月板手術(shù)后仍然持續(xù)經(jīng)歷膝蓋疼痛或功能障礙的患者;旨在解決當(dāng)前半月板治療選擇的局限性。這種情況每年影響約25萬(wàn)美國(guó)人。
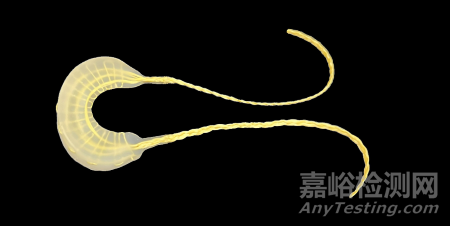
傳統(tǒng)的半月板修復(fù)顯示出相對(duì)較高的并發(fā)癥和再次手術(shù)率,10年平均高達(dá)22%。半月板切除術(shù)在90%以上的半月板撕裂病例中不可避免,導(dǎo)致半月板組織的丟失并可能加速關(guān)節(jié)退化。隨著OrthoPreserve繼續(xù)推進(jìn)Defender植入物的開發(fā)和臨床測(cè)試,它有潛力顯著影響半月板損傷的治療,并改善患有膝蓋疼痛和活動(dòng)障礙患者的長(zhǎng)期預(yù)后。
Defender植入物的主要特點(diǎn):
植入物設(shè)計(jì):Defender由生物相容性水凝膠材料制成,并用高強(qiáng)度纖維加固,模仿天然半月板的形狀、結(jié)構(gòu)和生物力學(xué)特性。
治療方法:與傳統(tǒng)的半月板手術(shù)(通常涉及部分切除)不同,Defender旨在替換整個(gè)半月板,可能提供更持久的解決方案。
手術(shù)技術(shù):OrthoPreserve開發(fā)了一種微創(chuàng)手術(shù)技術(shù)來(lái)植入Defender,只需4-5個(gè)小切口。
臨床時(shí)間線:OrthoPreserve計(jì)劃在2026年啟動(dòng)試點(diǎn)臨床試驗(yàn),目標(biāo)是在2029年獲得FDA批準(zhǔn)。
公司背景:OrthoPreserve于2021年由一群骨科臨床醫(yī)生和生物醫(yī)學(xué)工程師創(chuàng)立。Defender植入物由Jonathan Schwartz在2016年就讀于佐治亞理工學(xué)院期間發(fā)明。

FDA突破性設(shè)備認(rèn)定和TAP入選,有如下好處:
與FDA和非FDA利益相關(guān)者進(jìn)行早期和頻繁的溝通。
未來(lái)監(jiān)管提交的優(yōu)先審查。
關(guān)于市場(chǎng)采用和保險(xiǎn)覆蓋的增強(qiáng)指導(dǎo)。
值得注意的是,在2025年1月之前,骨科設(shè)備并不包括在TAP計(jì)劃中,這使得OrthoPreserve的設(shè)備可能成為第一個(gè)獲得TAP入選資格的骨科設(shè)備。
附:關(guān)于TAP
全生命周期咨詢計(jì)劃(Total Product Life Cycle Advisory Program,簡(jiǎn)稱TAP)是由美國(guó)食品和藥物管理局(FDA)的設(shè)備和放射健康中心(CDRH)于2023年10月啟動(dòng)的一項(xiàng)自愿性試點(diǎn)計(jì)劃。以下是TAP計(jì)劃的主要特點(diǎn):
目的和目標(biāo)
旨在讓患者更快地獲得安全、有效和創(chuàng)新的醫(yī)療設(shè)備
通過(guò)FDA的早期和頻繁反饋,努力減少設(shè)備開發(fā)時(shí)間和成本
專注于通過(guò)解決產(chǎn)品生命周期中的挑戰(zhàn)來(lái)改善醫(yī)療設(shè)備領(lǐng)域
計(jì)劃結(jié)構(gòu)
向有限數(shù)量的獲得突破性認(rèn)定的醫(yī)療設(shè)備開放
最初包括15種心血管設(shè)備,截至2024年2月已擴(kuò)展到31種入選設(shè)備
計(jì)劃到2024年底納入多達(dá)60種設(shè)備
參與和資格
對(duì)醫(yī)療產(chǎn)品開發(fā)者來(lái)說(shuō)是自愿的
向2023-2025財(cái)年獲得突破性認(rèn)定的產(chǎn)品開放
將在2026和2027財(cái)年擴(kuò)展到包括FDA更安全技術(shù)計(jì)劃(STeP)中的產(chǎn)品
產(chǎn)品必須處于開發(fā)早期階段,尚未啟動(dòng)關(guān)鍵性試驗(yàn)
主要特點(diǎn)
提供FDA審查團(tuán)隊(duì)、參與者和利益相關(guān)者之間定期的、以解決方案為導(dǎo)向的互動(dòng)
為具有公共衛(wèi)生重要性的創(chuàng)新設(shè)備提供戰(zhàn)略性參與
促進(jìn)設(shè)備開發(fā)過(guò)程中的戰(zhàn)略決策改進(jìn)
績(jī)效指標(biāo)
FDA目標(biāo)是在14天內(nèi)安排電話會(huì)議,40天內(nèi)提供書面反饋,成功率達(dá)90%
將于2026年1月30日前發(fā)布獨(dú)立第三方評(píng)估報(bào)告
參與者調(diào)查將衡量對(duì)FDA互動(dòng)和反饋的滿意度
參考來(lái)源:https://www.fda.gov/medical-devices/how-study-and-market-your-device/total-product-life-cycle-advisory-program-tap

來(lái)源:骨未來(lái)


