您當前的位置:檢測資訊 > 生產品管
嘉峪檢測網 2024-10-22 11:40
內毒素是導致污染藥品、制劑成分和醫療器械引起的發熱反應的主要原因。重組生物制藥產品是使用生物體制造的,包括革蘭氏陰性細菌。革蘭氏陰性細菌死亡時,其外細胞膜中的內毒素(也稱為脂多糖)會釋放到裂解液中,它們可以與生物分子相互作用并形成鍵,包括目標治療化合物。生物制品的內毒素污染也可能通過水、原料(如輔料)、培養基、添加劑、血清、設備、容器封閉系統以及生產中使用的表達系統發生。因此,生產過程迫切需要通過監測關鍵步驟的原料和中間體,以及最終藥品產品釋放測試,來減少和去除內毒素的方法。這篇綜述論文重點討論了三個主要主題:內毒素檢測技術、生產治療分子的上游工藝,以及在產品純化過程中消除內毒素的下游工藝。最后,我們從高純度和低成本的角度評估了內毒素去除工藝的有效性。
內毒素的"身份證"
內毒素存在于革蘭氏陰性細菌的外細胞壁中,膜的完整性和穩定性得到增強,且在細胞破裂時釋放其成分到外部環境。因此,使用革蘭氏陰性菌生產生物制品時,可能會帶來內毒素的污染。此外,生物制品的內毒素污染還可能通過水源、原料、設備、容器封閉系統以及生產過程中使用的表達系統等途徑發生。
結構:內毒素由三個部分構成,長鏈多糖 (O-抗原),核心多糖和脂質A (圖 1a從上到下)。長鏈多糖是一種由重復寡糖亞基組成的菌株特異性表面抗原,核心多糖具有外部己糖區和內部庚糖區,脂質A是一種非極性脂質結構。
物理性質:核心多糖和O-抗原都是親水的,而脂質A是疏水的。內毒素非常穩定,不易被加熱條件和pH破壞。內毒素還可能與目標蛋白形成穩定的相互作用,這會使分離變得復雜。
毒性和劑量:內毒素的毒性與脂質A相關,脂質A會觸發促炎細胞因子的產生和凝血級聯反應的激活,從而導致敗血癥和敗血性休克。每小時每公斤體重僅1 ng的內毒素就可引起熱原反應。內毒素測量的標準單位是內毒素單位 (EU),相當于0.1 ng大腸桿菌內毒素的活性。對于靜脈注射,每小時最多可以給患者每公斤體重注射5 EU的內毒素,可接受的濃度取決于所需劑量。

圖 1. (a) 來自大腸桿菌內毒素的化學結構示意圖,內毒素是由長鏈多糖 (O-抗原),核心多糖和非極性脂質A尾部構成的脂多糖結構 (b) 內毒素以膠束,立方體,層狀或囊泡形式聚集,在藥物溶液中呈現凈負電荷。帶負電荷的“膠束”內毒素可以吸附在多聚陽離子配體上,或者可以通過疏水脂質尾部與疏水表面的相互作用去除單個內毒素單體
內毒素的檢測方法
內毒素的檢測技術多種多樣,但在此,我們將重點介紹一種目前被廣泛采用的檢測手段——鱟變形細胞裂解物檢測法,也就是我們常說的鱟試劑(LAL)。
與早期需要活體兔子進行的兔熱原檢測(RPT)相比,LAL方法避免了使用動物實驗,轉而利用鱟的血液提取物來進行檢測。這種提取物主要通過以下三種形式被應用:
凝膠法:此法將鱟血液提取物與待測樣品等量混合,若形成凝膠并穩固于試管底部,即判定為陽性。陽性反應需一定量的內毒素觸發,檢測限在0.03-0.06EU/mL之間(見圖2a)。
顯色法:此法將凝膠法中的天然底物替換為可顯色底物,該底物在內毒素激活的凝固酶作用下裂解,釋放顯色分子至溶液中,通過分光光度法測量,吸光度變化與內毒素濃度成正比。
濁度法:與顯色法相似,濁度法通過測量溶液的濁度來評估鱟試劑與內毒素反應后的凝固效果,濁度變化率與內毒素濃度成正比。
以上三種LAL方法都依賴于鱟血液中的同一種蛋白質,即圖2c所示的C因子。內毒素激活鱟試劑中的C因子后會發生凝血級聯反應,隨之激活因子B,然后進一步形成凝固酶。
顯色法和濁度法都可以通過終點法或動力學法的形式測量。終點法:在樣品反應終止時進行一次性測量,根據最終的吸光度或濁度與內毒素濃度的關聯來確定結果。動力學法:與終點法相比,動力學法通過在整個反應過程中連續監測吸光度或濁度的變化,來動態評估內毒素濃度的動態關系。

圖 2. (a) 內毒素誘導的鱟循環血淋巴防御機制。鱟變形細胞裂解物 (LAL) 檢測是根據鱟血液中產生的免疫原性反應設計的。暴露于內毒素后,電子致密的大顆粒 (L 顆粒) 和電子密度較低的小顆粒 (S 顆粒) 變形細胞會被酶原C因子激活; (b) 鱟血凝血級聯反應。內毒素激活質膜結合C因子,C因子是一種單鏈糖蛋白 (分子量123 kDa),由重鏈 (分子量80 kDa) 和輕鏈 (分子量43 kDa) 組成,在免疫系統中起著關鍵激活劑的作用。因子與內毒素結合后,自催化活性觸發 Phe-Ile 鍵的裂解,從而產生活化的C因子,該因子與B因子相互作用,將其轉化為凝固酶。凝固酶在肽C的兩個末端 (Arg-Lys和Arg-Gly) 處裂解凝固蛋白原,形成不溶性凝固蛋白凝膠;(c) 鱟血中活性凝固酶的蛋白水解活性特征可用于合成顯色劑,即 Gly-Arg-p-硝基苯胺底物 (而不是凝固素原) 通過分離對硝基苯胺 (pNA) 來檢測內毒素。添加顯色底物后,活性蛋白酶凝固酶 Ac-Ile-Glu-Ala-Arg-pNA 會催化 pNA 的釋放,產生黃色,可通過測量405 nm處的吸光度 (或 340 nm 處的吸光度) 與標準曲線關聯獲得內毒素濃度
上述所有LAL方法都被目前生物制藥機構廣泛接受,并推出了諸多具有不同檢測精度的試劑盒 (表 1)。需要注意的是,LAL檢測方法仍然存在一些缺陷:
假陰性:內毒素會被樣品中一些特殊緩沖液成分 (如檸檬酸和磷酸),細胞培養基組分,表面活性劑 (如PS20和PS80) 或產品聚集掩蓋。干擾試劑會在內毒素分子周圍形成一層掩蔽層,使其無法與LAL試劑發生反應,這種現象通常伴隨著檢測中的低內毒素回收率。理論上,待測樣品中能與內毒素活性位點結合的游離金屬離子,肽,聚合物和蛋白質都可能中和其生物活性,造成LAL檢測所依賴的級聯反應被破壞。
假陽性:(1→3)-β-D-葡聚糖 (一種主要的細胞膜致熱原成分) 會觸發蛋白酶G因子通路,并形成與LAL反應中相同的凝固蛋白終產物,因此待測樣品中含有該葡聚糖會造成假陽性。
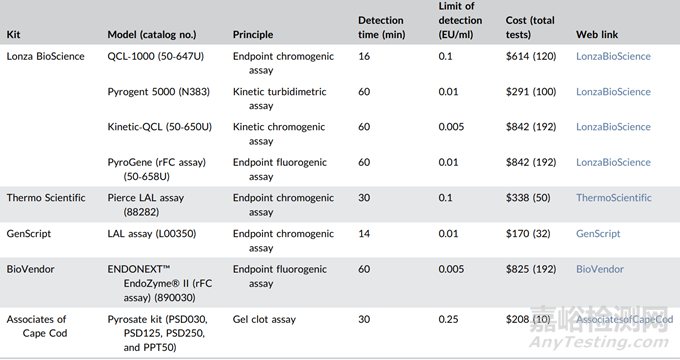
表 1. 目前三種LAL檢測方法 (顯色法、凝膠法和濁度法) 的商品化試劑盒,以及基于rFC檢測法的商品化試劑盒
文中提到的其他內毒素檢測方法在此只對基本原理做簡單介紹,感興趣建議下載文末原文閱讀:
兔熱原檢測 (RPT):這是一種傳統的內毒素檢測方法,通過注射生物樣品至活兔體內,觀察180分鐘內體溫是否升高0.5℃來判斷。該方法因依賴活體、樣品消耗大且精度和靈敏度有限,使用已逐漸減少。
牛全血檢測 (bWBA):通過將牛全血與待測樣品混合,利用白細胞對內毒素的反應產生PGE2,其量與內毒素濃度成正比。但此方法存在缺陷,如內毒素的非特異性結合可能掩蓋單體,且牛全血不易收集。
重組C因子檢測:基于LAL原理,通過DNA克隆得到的重組C因子,不含G因子,避免了LAL中的非特異性糖結合導致的假陽性,檢測成本與LAL相當。
單核細胞活化試驗 (MAT):內毒素激活單核細胞產生細胞因子,通過一系列反應,最終通過分光光度計測量吸光度來定量內毒素,與LAL顯色法類似。
新興方法之電化學技術:多數基于電化學阻抗譜 (EIS),通過電極與待測溶液接觸,測量內毒素與電極-蛋白質復合物接觸后電阻的變化來檢測。
新興方法之熒光和發光技術:利用生物發光法,將LAL測試中的終點物質pNA作為熒光素酶的底物,通過生物發光反應快速檢測內毒素。
新興方法之表面等離子體共振和基于質量的技術:等離子體生物傳感器使用光纖探頭技術,通過測量折射率變化監測內毒素結合。電磁壓電聲傳感器 (EMPAS) 則基于PMB功能化的石英表面,利用PMB對內毒素的高親和力進行檢測。
內毒素的下游去除方法
在生物制品的整個制造過程中,下游工藝的內毒素去除是控制內毒素水平的關鍵環節。內毒素自身或與目標蛋白形成的穩定相互作用,對下游去除工藝構成重大挑戰。本文主要探討了超濾、萃取、離子交換層析、親和層析和膜吸附等去除技術。

圖 3. 生物制藥生產,分離和純化步驟的簡要流程圖,主要分為上游發酵 (細胞培養) 和下游純化兩個部分
1. 超濾
單個內毒素分子的分子量通常在10-30 kDa之間,它們的核心多糖和寡糖鏈能聚集形成高達1000 kDa分子量、直徑約0.1 µm的膠束和囊泡(見圖2b)。
超濾膜技術,具備固定孔徑,能有效從小分子目的蛋白溶液中分離出大分子膠束和囊泡。內毒素從單體到膠束的形態轉換,對超濾去除效率有顯著影響。
蛋白濃度:例如,使用100 kDa截留量的超濾膜時,大于100 kDa的蛋白和內毒素膠束會被截留,而小于100 kDa的內毒素單體則能通過膜。研究表明,稀釋蛋白溶液可提高內毒素的去除率,因為在較低濃度下,一些大分子的內毒素聚體可能解離成能透過膜的單體。
去垢劑濃度:例如,PS20能夠促使大分子內毒素聚體解離為單體,同時削弱內毒素與目的蛋白的結合,便于超濾膜的去除。隨著PS20濃度的增加,內毒素的去除效率也隨之提高。
應用范圍:超濾技術適用于從小分子量目的蛋白、水或鹽溶液中去除內毒素。在這一過程中,超濾回流端會截留大分子內毒素,而小分子目的蛋白則透過膜。需要注意的是,膜孔徑的選擇對收率有顯著影響,如使用10kDa膜的收率可達95%,而3kDa膜的收率可能降低約55%。
2. 萃取
溶劑萃取根據內毒素在兩種不混溶液體中的相對溶解度差異將內毒素與目標治療藥物分離。內毒素通常在有機相中形成分布,而親水性目標分子則留在水相中。該方法對于高度污染樣品可以提供高內毒素去除效率,但是目標產品的收率損失可能會比較大。
案例一:1-辛醇作為有機相在去除T4、HAP1和F8噬菌體的內毒素方面表現出64%至99.9%的高效率,但需注意其收率較低,僅為30-60%。此外,1-辛醇在水相中的殘留可能在LAL檢測中引起背景噪音。
案例二:利用去垢劑Triton X-114結合溫度變化可有效去除綠色熒光蛋白中的內毒素。Triton X-114在0°C時與水完全混溶,而在23°C以上則發生相分離。在低溫時,Triton X-114、內毒素和熒光蛋白共存于水相;溫度升高后,內毒素隨Triton X-114轉入有機相,目標蛋白則保留在水相中。
3. 陰離子交換層析
陰離子交換層析的配基帶正電,內毒素的等電點約為2,在絕大多數層析條件下 (pH>2) 內毒素都帶負電,而堿性目的蛋白則為正電荷。陰離子交換介質在此條件下能夠有效地結合內毒素,允許目的蛋白通過,實現兩者的有效分離。然而,對于帶有負電荷的酸性蛋白和質粒DNA(pDNA),在確保產品收率的同時,陰離子交換層析在去除內毒素上的效果可能會受限。
缺陷或限制:如果內毒素和目的蛋白有強相互作用,其可能會隨目的蛋白一起流出層析柱,這時可以通過調高樣品pH來減弱內毒素和目的蛋白之間的相互作用。如有案例在pH 7.9, 8.4, 8.9和9.2時檢測到的流穿液中內毒素濃度分別為1400, 1800, 600和500 EU/mL,并且對目的蛋白的收率沒有顯著影響。
去除效果:一般陰離子層析可使濃縮的溶液 (>1,000 EU/mL) 中內毒素減少5個數量級,或使稀釋的溶液 (<100 EU/mL) 中內毒素減少3-4個數量級。
4. 親和層析
親和層析技術利用與內毒素具有高度特異性結合能力的配體,有效地從目標蛋白質中分離出內毒素。這些配體通常針對內毒素中最保守的脂質A結構進行設計,其作用力包括疏水作用和靜電作用。
最常用的親和配體包括脫氧膽酸、二甲胺配體、組氨酸、多粘菌素B (PMB) 和聚陽離子配體等。
PMB:PMB是最常用的配體之一,一種對內毒素具有高親和力的環狀脂肽。PMB可以誘導內毒素聚集體的解離,并通過疏水相互作用與內毒素的脂質 A部分結合。PMB層析柱的缺陷是可能會出現高于平均水平的產品損失,這是因為PMB上的氨基酸基團帶正電荷,可能會吸引帶負電荷的目標分子。此外,PMB既有神經毒性又有腎毒性,如果配體從填料中脫落可能會引起安全問題。
含氮堿基腺嘌呤、胞嘧啶、組氨酸和組胺都對內毒素具有親和力。其中,組胺和組氨酸與PMB一樣有效,已成功將內毒素與白蛋白、胰島素、溶菌酶、肌紅蛋白和其他物質分離。許多重組蛋白都攜帶組氨酸標簽,內毒素和組氨酸的相互作用可能導致樣品污染,替代方法是使用其他如GST標簽等。
商品化填料 (表2):成本效益高的配體及其結合能力是純化過程中去除內毒素的關鍵因素。聚-ε-賴氨酸和PMB是常用的兩種配體。表2匯總了這些配體相關商品化產品的內毒素結合能力、蛋白質回收率、可再生性和成本。
缺陷和新產品:上述樹脂的使用涉及重組蛋白回收率低,腎毒性和神經毒性導致的靜脈應用困難,填充床形式的多孔樹脂存在的高壓降和傳質效率低等缺陷。已經有研究開發出約800 nm的聚ε-己內酯 (PCL) 納米粒子去除PBS緩沖液,蛋白質溶液和水中的內毒素。具有生物相容性好,剛性,無孔 (吸附發生在表面),高內毒素去除率 (99%) 和高回收率 (>95%) 等優勢。
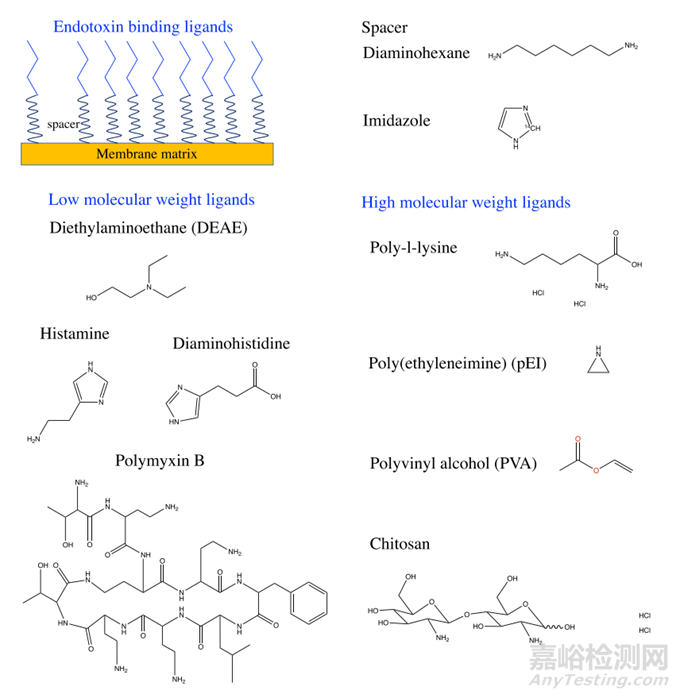
圖 4. 去除內毒素的不同配基化學結構

表 2. 層析法去除內毒素的配體比較
5. 膜吸附
與傳統的柱層析技術相比,膜層析技術在提高生產流程速度和減少擴散限制方面具有顯著優勢。膜層析的膜材料可以選用多種不同的材料,包括纖維素、醋酸纖維素、尼龍、聚乙烯醋酸乙烯酯、聚乙烯醇和聚偏氟乙烯等。
案例分析一:已有研究報道使用固定化組氨酸標簽的尼龍膜來清除內毒素,但隨著初始內毒素濃度的增加,其清除效率會逐漸降低。例如,在初始內毒素濃度為387 EU/mL的最低水平時,清除效率也僅為65%。
案例分析二:一些研究人員已經開發出一種新型的膜吸附劑,它不僅具有高效的內毒素清除能力,還具有良好的結合性能。這種以聚偏氟乙烯(PVDF)為基材的吸附劑,通過添加兩親性碳質顆粒,成功地從牛血清白蛋白溶液中清除了內毒素,清除效率超過99.8%,同時蛋白質的回收率也超過了90%。

表 3. 膜吸附用于內毒素去除的比較
結論
對于能夠以較低成本生產高質量產品技術的需求正在增加。對于使用革蘭氏陰性細菌生產的生物制藥來說,這一點尤其正確,因為內毒素污染是一個問題。基于動物的內毒素檢測技術將變得過時,取而代之的是電子生物傳感器和基于熒光的技術。需要實時在線監測工藝流程中內毒素濃度,以便對產品污染采取反饋措施,并保持生產生物制品和藥物的安全標準。開發同時檢測和去除內毒素的方法,既要有效又要成本效率高,由于所需的高純度和內毒素與目標分子之間的潛在相互作用,這是一個持續的挑戰。親和層析是最有前途且應用廣泛的內毒素去除方法,因為內毒素和所選配體之間具有高度選擇性的相互作用。仍需進行額外研究,以進一步開發高效的內毒素去除方法和具有高親和力、低成本和低毒性的靶向配體。這些創新將使產品質量和產量提高,同時降低制造成本。

來源:Internet


