您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-07-08 12:53
給藥周期是毒理試驗設計的核心指標之一。關于給藥周期的要求,ICH多個指導原則都有相關描述。
先看下ICH M3重復給藥毒性研究部分對于給藥周期的要求。首先是支持臨床試驗的要求。如下表所示,重復給藥毒性試驗給藥周期有上限和下限。下限是,對于臨床持續周期≤2周,重復給藥毒性試驗則至少要持續2周。上限是,對于臨床持續周期>6個月,重復給藥毒性試驗倒不必一定與臨床一致,嚙齒類動物滿足6個月,非嚙齒類給夠9個月即可。對于2周-6個月之間的情況,與臨床周期一致即可。
也有些特殊情況特別說明一下。比如在美國,臨床僅單次用藥,非臨床研究可以采用拓展的單次給藥毒理研究設計。對于臨床研究持續<14天的情況,非臨床給藥周期可以與臨床保持一致。又如在歐洲,通常6個月非嚙齒類毒理研究可以支持臨床>6個月。在日本和美國,如果出現以下情況,6個月也可以作為最長非嚙齒類給藥周期,比如免疫原性或動物不耐受影響更長周期毒理試驗的正常開展,或間歇性治療偏頭痛、勃起功能障礙或單純皰疹這種短期重復暴露的情況,或慢性用藥為降低腫瘤復發風險,或用于預期壽命比較短的適應癥。

對于支持藥物上市的重復給藥研究周期,則參考下表要求。

生物制品臨床前安全性評價可參考ICH S6。給藥途徑和方案(如每天給藥vs間隔給藥)應該反映臨床擬定使用或者暴露情況。關于重復給藥毒性試驗的期限,應根據預期臨床暴露的期限和適應癥確定。大多數生物制品的動物給藥期限為1-3個月。對于計劃短期使用(如≤7天)或者治療急性危及生命疾病的生物制品,2周的重復給藥試驗可以支持其臨床試驗以及上市許可。對于擬用于慢性適應癥的生物制品,試驗期限一般為6個月。
抗腫瘤藥物非臨床評價參考ICH S9。抗腫瘤藥物通常采用的非臨床試驗給藥方案的實例,可應用于小分子藥物或生物藥物。下表展示了支持早期臨床試驗的非臨床給藥方案設計。按照這個表格,如果臨床每3-4周給藥1次,非臨床開展單次給藥毒理試驗即可支持IND,但也不絕對。以ADC為例,臨床多是Q3W給藥頻率,ICH S9問答中對于這類產品,建議至少給藥2次。
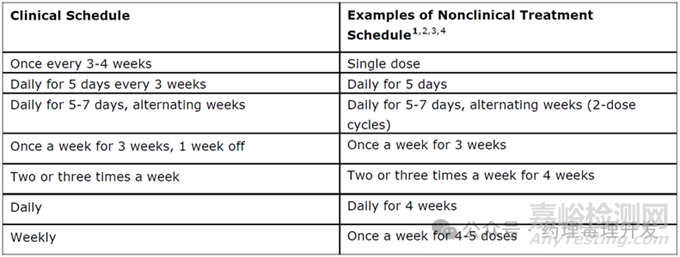
另外,關于支持后續臨床試驗和上市的毒理學研究期限。支持Ⅰ期臨床試驗的非臨床資料和Ⅰ期臨床資料通常足以支持進行Ⅱ期臨床試驗,和支持進入晚期腫瘤患者的二線或一線治療。為了支持用于晚期腫瘤患者抗腫瘤藥物的后續開發,在Ⅲ期試驗開始之前應提供符合臨床擬定方案的為期3個月的重復給藥毒性試驗結果。對于擬用于晚期腫瘤患者的大多數藥物來說,為期3個月的非臨床毒性試驗足以支持上市。
案例
先看下ADC類產品。
Kadcyla是由ImmunoGen/Roche公司開發的靶向HER2的ADC產品,通用名Trastuzumab emtansine,出現的比較多的名字是T-DM1。2013年2月22日獲批上市,用于HER2陽性乳腺癌的治療。T-DM1支持首次臨床試驗的IND采用的猴Q3W*4。當然,按照ICH S9的要求,Q3W*2即可。但考慮到猴重復給藥毒理試驗是2005年開展的,早于ICH S9,不一致也正常,至少是覆蓋ICH要求。支持BLA的動物試驗周期也是長于3個月,原因類似,猴Q3W*8重復給藥毒理試驗是2007年開展的,早于ICH S9頒布時間。不過,這個產品比較有意思的一點是,臨床一期選擇部分劑量探索了QW給藥周期,這個給藥頻率并沒有非臨床研究的支持。可能是基于前期臨床數據如PK、非臨床毒理試驗暴露量數據做的決策。
Besponsa是由Pfizer/Celltech公司開發的靶向CD22的ADC產品,通用名Inotuzumab ozogamicin。2017年8月17日獲批上市,用于急性淋巴細胞白血病的治療。支持Besponsa首次臨床試驗的大鼠和猴毒理研究均是QW*4,比較中規中矩。但支持BLA的毒理試驗選擇的QW*26,遠超過指導原則要求的3個月。
PADCEV是由Agensys/Seattle Genetics公司開發的靶向Nectin-4的ADC產品,通用名Enfortumab vedotin,毒素為MMAE。2019年12月18日獲批上市。這個產品給藥頻率和周期設計看著就比較舒服,無論給藥頻率還是持續周期都剛剛好,既沒有過度試驗,也沒有“缺斤少兩”。
Trodelvy是一款TROP2靶點的ADC,由吉利德開發,2020年3月獲批上市,用于三陰乳腺癌的治療。這個產品的臨床治療方案是QW*2,每3周1個療程,如此往復。按照ICH S9,每周1次,連續給藥3周,休息1周,QW*3的非臨床研究周期的設計即可。Trodelvy臨床每周1次,連續2周,休息1周,理論上QW*2或3即可。但該產品設計的動物試驗是Q3D*2,即過度暴露毒性。Q3D*2其實沒有達到臨床的給藥周期,感覺不如QW*2設計更穩妥。對于支持BLA的周期,滿足指導原則3個月的要求。
Enhertu是由一三共/阿斯利康公司開發的靶向HER2的ADC產品,通用名Trastuzumab deruxtecan,毒素為Dxd。2019年12月20日獲批上市。Enhertu的IND和BLA毒理試驗給藥次數較指南要求貌似多了1次,給藥持續周期偏長一點,整體算是與指南要求基本一致。

再看下抗腫瘤抗體。
先以2023年新晉藥王PD-1抗體Keytruda為例,非臨床重復給藥毒理研究開展了食蟹猴QW*5 doses(IND)、食蟹猴Q2W*6個月(BLA)。臨床期間探索的給藥方案為Q2W或Q3W,最終上市的方案為200mg, Q3W或400mg, Q6W。毒性不大的單抗QW給藥頻率比較常見,為臨床留下充分研究空間。尤其在IND階段,臨床擬用頻率還不確定。最終支持BLA的試驗,采用的Q2W*6個月設計,是比常規3個月的要求要長的。另一款PD-1抗體Opdivo,支持IND食蟹猴重復給藥毒理試驗的給藥頻率和周期與Keytruda類似,也是QW*5。但支持BLA的非臨床研究采用的BIW*3個月的設計,給藥周期較Keytruda短,給藥次數卻比Keytruda多一倍。其實,按照QW或Q2W,給藥3個月的設計,理論上就足以支持這類產品BLA。
舉兩個非抗腫瘤抗體的例子。
Aducanumab是一款治療阿爾茨海默病的單克隆抗體,靶向Aβ蛋白,商品名Aduhelm,2021年獲批上市。臨床每4周給藥1次,每次靜脈輸注1小時,給藥劑量10mg/kg。非臨床重復給藥毒理試驗的相關種屬為食蟹猴,關鍵研究內容包括:食蟹猴 QW*4靜脈給藥、轉基因小鼠QW*13靜脈給藥、轉基因小鼠QW*6個月靜脈給藥。前兩個試驗的啟動時間差不多,應該是支持IND的研究,最后選擇轉基因小鼠這一單一種屬的6個月毒理試驗支持BLA。
Lecanemab也是一款治療阿爾茨海默病的單克隆抗體,同樣靶向Aβ蛋白,商品名Leqembi,2023年獲批上市。臨床每2周給藥1次,每次靜脈輸注1小時,給藥劑量10mg/kg。關鍵的重復給藥毒理試驗內容有兩個,食蟹猴QW*5次靜脈給藥毒理研究和食蟹猴QW*40次靜脈給藥毒理研究,前者支持IND,后者支持BLA。
Aducanumab和Lecanemab兩個產品目標適應癥相似,Aducanumab的首次臨床試驗設計的單次給藥,21天觀察期。Lecanemab的首次臨床試驗包括單次給藥和多次給藥,多次給藥方案是Q4W*4(最高劑量10mg/kg設計的Q2W*7)。因此,Aducanumab非臨床QW*4的給藥頻率和持續周期理論上可以支持FIH設計。當然,小鼠試驗給藥周期是3個月,策略更為保險。Lecanemab的非臨床QW*5可以支持首次臨床試驗的Q4W*4,甚至Q2W*7的設計嗎?怎么感覺從給藥次數和周期都不甚符合呢。支持BLA的試驗,前者選擇了6個月嚙齒類研究,后者則選擇了9個月非嚙齒類研究,均滿足甚至超過非抗腫瘤生物藥物的給藥上限要求。可能會有人好奇,2期和3期臨床周期也很長,似乎沒有非臨床毒理數據支持。實際上,這兩個藥物的1個月重復毒理和6個月或9個月更長周期毒理試驗啟動時間前后就差一年,3期臨床之前試驗應該已經完成了。
再看兩款眼科類藥物的例子。
Aflibercept的中文名是阿柏西普,商品名Eylea,2011年獲批上市,用于濕性年齡相關黃斑變性、視網膜靜脈閉塞后黃斑水腫等疾病治療。臨床擬用方案為Q4W或Q8W,長期用藥,玻璃體內注射給藥。關鍵非臨床研究包括:食蟹猴13周玻璃體注射給藥(Q4W)、食蟹猴8個月玻璃體注射給藥(Q4W)、大鼠3個月皮下注射給藥、食蟹猴6個月靜脈注射給藥(QW)、食蟹猴4周皮下注射給藥(TIW)、食蟹猴3個月皮下注射給藥(BIW)、食蟹猴4周靜脈注射給藥(QW)、食蟹猴3個月靜脈注射給藥(QW)。Eylea的臨床1期試驗既包括健康人靜脈給藥,又包括年齡相關黃斑變性患者的玻璃體內注射給藥。給藥周期既有單次給藥,也有長期用藥。非臨床研究中,不太確定為什么開展了兩種系統給藥方式(SC和IV),理論上一種應該就滿足基本要求。從給藥周期看,3個月支持IND,8個月支持的BLA。
眼科藥物中還有一款明顯產品Ranibizumab,即雷珠單抗(Lucentis),上市時間是2006年,比Eylea更早。適應癥類似,給藥頻率Q4W。關鍵重復給藥毒理試驗內容包括:食蟹猴3個月玻璃體內注射(Q2W)、食蟹猴9周玻璃體內注射(Q2W*3+Q4W*1)、食蟹猴26周玻璃體內注射(Q2W),分別在1999、2000、2002年啟動的試驗。與Aflibercept類似,也是3個月支持IND。不過,支持BLA的毒理研究并未開展9個月那么久,僅6個月。當然,也是符合ICH S6對治療慢性病生物制品的上限要求,且給藥頻率比臨床擬用頻率更高。
最后看一個間歇性給藥的案例。
Rimegepant是一款CGRP小分子抑制劑,2020年2月獲批上市,用于急性偏頭痛的治療或預防,按需用藥。非臨床關鍵毒理研究包括六項,分別是大鼠1個月、3個月和6個月,食蟹猴1個月、3個月和9個月重復給藥毒理研究,給藥頻率均是QD。Rimegepant臨床1期方案是每天給藥1次,連續給藥14天。所以,大鼠和食蟹猴1個月毒理試驗是比臨床1期擬用周期和指導原則要求要長的,足以支持FIH試驗。3個月用于支持2期臨床。按照美國和日本監管機構要求,間歇性治療偏頭痛,非嚙齒類給藥6個月即可支持上市,但rimegepant依然開展了9個月的研究。可能與產品后續慢性偏頭痛預防等適應癥的開發有關,也可能是為了一次性滿足更多監管機構的要求。

來源:藥理毒理開發


