您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-06-04 11:32
霧化面罩是按第二類醫療器械管理的一次性使用霧化面罩產品,產品的分類編碼為08-06-12(呼吸、麻醉和急救器械-呼吸、麻醉用管路、面罩-霧化面罩)和08-05-07(呼吸、麻醉和急救器械-呼吸、麻醉、急救設備輔助裝置-霧化設備/霧化裝置)項下面罩式氣流霧化器產品。
一、霧化面罩的結構組成
霧化面罩通常由接口、罩體組成。
典型面罩式氣流霧化器通常由接口、罩體(面罩),霧化杯、連接管組成,可配有固定帶等。
罩體可采用聚氯乙烯、聚丙烯、聚碳酸酯、硅橡膠、熱塑性彈性體(如TPE、TPU)等適宜的高分子材料制成;霧化杯可由聚乙烯、聚丙烯、聚碳酸酯等材質制成;連接管可由PVC等高分子材質制成;固定帶可采用彈性材料制成。
典型面罩式氣流霧化器產品通常由罩體(面罩)、霧化杯、連接管和接口組成,其結構示意圖及實物照片(圖1)如下所示。
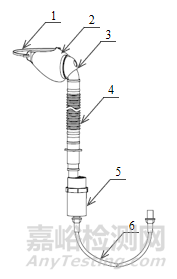
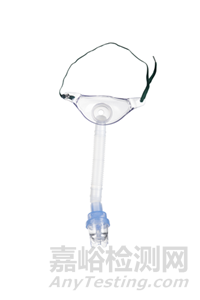
1-罩體2-接口3-霧化杯4-連接管
圖1 典型面罩式氣流霧化器結構示意圖和實物照片
除典型產品外,其他類型產品如氣切式、可躺手持式,產品圖示如下所示。
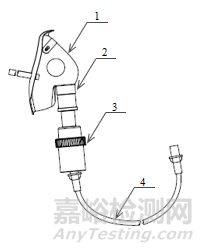

1、固定帶2、氣切面罩3、接口4、波紋管5、霧化杯6、連接管
圖2氣切式霧化面罩結構示意圖和實物照片


1、面罩殼2、面罩接頭3、旋轉接頭4、霧化杯5、連接管
圖3可躺手持式霧化面罩結構示意圖和實物照片
二、霧化面罩的主要風險
霧化面罩的產品主要危險見表
表 產品主要危險
|
危險的分類 |
危險的形成因素 |
可能的后果 |
|---|---|---|
|
生物學危險 |
生產環境控制不好;滅菌操作不嚴格;包裝破損;使用時操作不規范。 |
產品帶菌,引起患者感染。 |
|
產品清潔度不好;未按照工藝要求配料;添加劑或助劑使用比例不正確。 |
小分子物質殘留量過大,造成毒性危害。 |
|
|
原材料控制不嚴;生產工藝控制不嚴;后處理未達到要求。 |
引入有害物質,造成毒性危害;生物相容性不符合要求。 |
|
|
使用不當、標識不清。 |
引起感染、交叉感染。 |
|
|
環境危險 |
儲運條件(如溫度、濕度)不符合要求。 |
產品老化;無菌有效期縮短。 |
|
儲運、使用過程中發生意外的機械性破壞。 |
產品使用性能無法得到保證。 |
|
|
使用后的產品沒有按照要求集中銷毀。 |
造成環境污染或交叉感染。 |
|
|
與醫療器械使用有關的危險 |
標記不清晰、錯誤;沒有按照要求進行標記。 |
錯誤使用;儲存錯誤;產品辨別錯誤。 |
|
包裝破損無法識別;操作要點不突出;不適當的操作說明。 |
無法保證使用安全性;導致操作失誤。 |
|
|
由不熟練/未經培訓的人員使用。 |
操作不規范、不熟練、操作失誤。 |
|
|
與醫療器械使用有關的危險 |
規格型號選擇不合理。 |
面罩與接頭不匹配,無法連接使用;與患者面部不吻合,達不到霧化效果。 |
|
產品設計不合理,如面罩罩體缺少孔。 |
窒息危險。 |
|
|
對一次性使用醫療器械很可能再次使用的危害警告不適當。 |
一次性使用產品的重復使用造成交叉感染。 |
|
|
功能性失效和老化引起的危險 |
產品標識不清或沒有標識。 |
超出有效期的產品被使用,造成細菌感染或因材料老化而導致產品性能不符合要求。 |
|
沒有進行包裝確認。 |
不能保證產品無菌,造成產品污染,從而導致出現細菌感染。 |
三、霧化面罩性能研究實驗要求
1、產品性能研究
應當開展產品性能研究以及產品技術要求的研究,明確包括有效性、安全性指標以及與質量控制相關的其他指標的確定依據、所采用的標準或方法、采用的原因及理論基礎等。明確霧化粒徑的確定依據。對于僅含有面罩和接頭的產品,應明確配套使用的霧化杯、連接管的要求,并開展相應性能研究。
明確產品生產過程中由起始材料至終產品所需全部材料(包括添加劑、助劑等)的基本信息,如部件、化學名稱、商品名/材料代號、供應商、生產商、符合的標準等。原材料應具有穩定的供貨渠道以保證產品質量,應明確所用原材料的質量控制標準和檢驗報告。
開展典型藥物霧粒空氣動力學研究。對于可霧化的藥物,建議參考相關標準如YY/T 1743《麻醉和呼吸設備霧化系統和組件》開展藥物霧粒空氣動力學特性(空氣動力學直徑(MMAD)、氣霧顆粒輸出、噴霧速率等)的研究。
對于首次應用于醫療器械的新材料,應開展該材料適用性相關研究。有特殊設計、性能和結構的,應開展相應研究和驗證。
2、生物相容性的評價研究
生物相容性評價研究應當明確生物相容性評價的依據和方法;產品所用材料及與人體接觸的性質;實施或豁免生物學試驗的理由和論證;對于現有數據或試驗結果的評價。
應根據產品所用材料及與人體的接觸性質、接觸時間,參照GB/T 16886.1《醫療器械生物學評價第1部分:風險管理過程中的評價與試驗》進行生物學評價,開發人應參考YY/T1778.1《醫療應用中呼吸氣體通路生物相容性評價第1部分:風險管理過程中的評價與試驗》評價氣體通路生物相容性。
若開展申報產品與市售產品的等同性比較的方式進行生物相容性評價,應按照《關于印發醫療器械生物學評價和審查指南的通知》要求進行評價,應能夠證明申報產品與已上市產品具有等同性。
3、滅菌工藝研究
申報產品為無菌提供,應明確滅菌工藝(方法和參數)和無菌保證水平(SAL),開展滅菌確認,并對殘留毒性開展研究。主要原材料不同、滅菌方式不同的產品,應分別開展相關研究。
應參考GB 18279系列標準、GB 18280系列標準和GB/T 16886.7《醫療器械生物學評價第7部分:環氧乙烷滅菌殘留量》明確產品包裝及滅菌方法選擇的依據,經過確認并進行常規控制。
4、穩定性研究
4.1貨架有效期
應開展產品貨架的驗證,證明在貨架有效期內,產品可保持性能功能滿足使用要求。不同滅菌方式、不同包裝材料的產品,應分別進行有效期驗證和包裝研究。
產品有效期的驗證可采用實時老化或加速老化的研究。在穩定性研究中應監測整個有效期內確保產品安全性和有效性的關鍵參數。加速老化研究試驗的具體要求可參照YY/T 0681系列標準。
在進行加速老化試驗研究時應注意:產品選擇的環境條件的老化機制應與宣稱的運輸儲存條件真實下發生產品老化的機制相匹配。實時老化的研究是唯一能夠反映產品在規定儲存條件下實際穩定性要求的方法,當加速穩定性試驗與實時穩定性試驗結果不一致時,應以實時穩定性試驗結果為準。
4.2運輸穩定性
應當開展運輸穩定性和包裝研究,證明在生產企業規定的運輸條件下,運輸過程中的環境條件(例如:震動、振動、溫度和濕度的波動)不會對醫療器械的特性和性能,包括完整性和清潔度,造成不利影響。可參考GB/T 4857系列標準開展研究。
包裝驗證:應包括封口試驗以及包裝材料對滅菌的適應性研究。可參考GB/T 19633系列標準、YY/T 0698系列標準、YY/T0681系列標準開展研究。
5、證明產品安全性、有效性的其他研究
開展申報產品與預期接觸的藥物相容性研究。如申報產品原材料工藝等與已上市產品相同的,可通過已有的文獻、數據和信息資料進行說明;采用新材料、新工藝的產品,應開展相應的試驗數據和分析評價。
6、其他
非無菌供應的霧化面罩管理類別為一類,無菌供應的霧化面罩管理類別為二類,08-06-12項下霧化面罩依據《免于臨床評價醫療器械目錄》(以下簡稱《目錄》)第一項“一類醫療器械目錄中滅菌后升二類的醫療器械產品”免于臨床評價。開發人可按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》要求將申報產品相關信息與《目錄》所述內容進行對比及申報產品與已獲準境內注冊的《目錄》中醫療器械進行對比。
08-05-07項下面罩式氣流霧化器已列入《目錄》,開發人可按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》要求將申報產品相關信息與《目錄》所述內容進行對比及申報產品與已獲準境內注冊的《目錄》中醫療器械進行對比。

來源:嘉峪檢測網


