目的:對(duì)制藥用水中主要微生物類(lèi)型及控制措施進(jìn)行分析,為制藥用水系統(tǒng)的有效控制提供指導(dǎo)。方法:分析飲用水、純化水、注射用水中主要微生物種類(lèi)、豐度及其危害性,并探討制藥用水中微生物的控制措施。結(jié)果制藥用水中主要微生物類(lèi)型存在差異,洋蔥伯克霍爾德菌復(fù)合體和皮氏羅爾斯頓菌是潛在的條件致病菌,可造成生物安全隱患。結(jié)論:制藥企業(yè)可通過(guò)建立各級(jí)水系統(tǒng)微生物數(shù)據(jù)庫(kù)及常見(jiàn)微生物菌種庫(kù),應(yīng)基于警戒限和行動(dòng)限進(jìn)行趨勢(shì)分析,從而加強(qiáng)對(duì)水系統(tǒng)中微生物的控制。
制藥用水系統(tǒng)是制藥行業(yè)所需的潔凈公用工程系統(tǒng)。制藥用水可以作為清潔劑,用于淋洗和清潔儲(chǔ)罐、設(shè)備等,或作為原輔料,用于藥品調(diào)配、合成與制劑生產(chǎn),也可作為高壓滅菌器的蒸汽供應(yīng)等。制藥用水的化學(xué)純度和微生物負(fù)荷會(huì)直接影響最終產(chǎn)品的質(zhì)量,每家制藥企業(yè)都會(huì)投入大量的資源建設(shè)和維護(hù)制藥用水系統(tǒng)[1]。根據(jù)生產(chǎn)工藝和應(yīng)用場(chǎng)景的不同,藥品生產(chǎn)工藝中使用的水,主要分為飲用水、純化水、注射用水和滅菌注射用水[2]。雖然每一級(jí)水都有嚴(yán)格的質(zhì)量控制體系,但是每一級(jí)水也都是微生物污染的潛在來(lái)源,因此,制藥用水系統(tǒng)微生物負(fù)荷的控制尤為關(guān)鍵。在實(shí)際生產(chǎn)實(shí)踐中,為了更好地控制制藥用水系統(tǒng)中的微生物水平,除了通過(guò)生物負(fù)載測(cè)定微生物數(shù)量外,微生物學(xué)家還需要了解水系統(tǒng)中存在的微生物類(lèi)型,不僅有助于明確水系統(tǒng)中微生物污染趨勢(shì)的變化,也便于預(yù)測(cè)它們是否會(huì)導(dǎo)致更嚴(yán)重的問(wèn)題,比如水系統(tǒng)中是否有形成生物被膜的風(fēng)險(xiǎn),或者它們是否對(duì)產(chǎn)品(從而對(duì)患者)造成特殊風(fēng)險(xiǎn)[3]。
本文對(duì)制藥用水系統(tǒng)中主要的微生物類(lèi)型及其風(fēng)險(xiǎn)因素進(jìn)行綜述,以期為制藥企業(yè)水系統(tǒng)的微生物控制提供幫助。
1、各級(jí)制藥用水中主要的微生物種類(lèi)和豐度
眾所周知,淡水中的微生物多來(lái)自于土壤、空氣及動(dòng)植物等,但由于水體屬于特殊的生境,水體中微生物的多樣性往往要比陸地小很多[4]。微生物在淡水中的分布受許多環(huán)境因子的影響。簡(jiǎn)單來(lái)說(shuō),在遠(yuǎn)離人們居住地區(qū)的水體中,微生物的種類(lèi)主要有自養(yǎng)型的硫細(xì)菌、鐵細(xì)菌、球衣細(xì)菌、藍(lán)細(xì)菌、綠硫細(xì)菌和紫細(xì)菌等菌屬;而處于城鎮(zhèn)等人口密集區(qū)的水體中,微生物主要是以腐生型細(xì)菌和原生動(dòng)物為主,包括數(shù)量較多的無(wú)芽孢革蘭氏陰性細(xì)菌。由于制藥用水來(lái)源于外界淡水系統(tǒng),因此微生物污染的背景一直存在,每個(gè)等級(jí)的制藥用水都存在一定水平的微生物種類(lèi)污染,尤其是在沒(méi)有得到充分控制的情況下[5]。
1.1 飲用水微生物群落結(jié)構(gòu)
飲用水為天然水經(jīng)過(guò)氯化處理凈化處理所得的水,其質(zhì)量符合現(xiàn)行中華人民共和國(guó)國(guó)家標(biāo)準(zhǔn)《生活飲用水衛(wèi)生標(biāo)準(zhǔn)》。飲用水可作為藥材凈制時(shí)的漂洗、制藥用具的粗洗用水。除另有規(guī)定外,也可作為飲片的提取溶劑。
Sandle[3]從201個(gè)超過(guò)警戒線的飲用水樣本中,分離鑒定出504個(gè)菌株。504個(gè)菌株中,主要屬為革蘭氏陰性菌,也有部分革蘭氏陽(yáng)性菌發(fā)現(xiàn)。排名前五的菌屬信息見(jiàn)表1。從表1可見(jiàn)飲用水微生物中主要的3個(gè)屬為Pseudomonas ,Brevundimonas 和Sphingomonas,而Pseudomonas fluorescens,Brevundimonas vesicularis 和Ralstonia pickettii 為主要的種。
表1 飲用水中排名前五的主要菌屬
1.2 純化水微生物群落結(jié)構(gòu)
純化水為飲用水經(jīng)蒸餾法、離子交換法、反滲透法或其他適宜的方法制備的制藥用水,不含任何附加劑。純化水可作為配制普通藥物制劑用的溶劑或試驗(yàn)用水,也可作為中藥注射劑、滴眼劑等滅菌制劑所用飲片的提取溶劑等[2]。Sandle[3]從6300個(gè)純水樣本篩選到315個(gè)超警戒線的樣本(歐盟藥典規(guī)定菌落數(shù)不得多于100 CFU·mL−1),并回收了347個(gè)分離株。主要屬、種如表2所示。從表2可見(jiàn)純化水微生物中主要的屬為Ralstonia和Burkholderia,而Ralstonia pickettii和Burkholderia cepacia為純化水中最主要的菌種。
此外,筆者在先前對(duì)核電廠的主泵軸封水系統(tǒng)的水體(純化水)微生物研究發(fā)現(xiàn),該純化水中占優(yōu)勢(shì)的細(xì)菌為鐵細(xì)菌,包括不動(dòng)桿菌、假單胞菌、羅爾斯通氏菌等,以及一些其他難培養(yǎng)的細(xì)菌[6]。
1.3 注射用水微生物群落結(jié)構(gòu)
注射用水為純化水經(jīng)蒸餾所得的水,需符合細(xì)菌內(nèi)毒素試驗(yàn)要求。制藥企業(yè)應(yīng)定期清洗與消毒注射用水系統(tǒng)。注射用水的儲(chǔ)存方式和靜態(tài)存儲(chǔ)期限應(yīng)經(jīng)過(guò)驗(yàn)證確保水質(zhì)符合質(zhì)量要求。注射用水可作為配制注射劑、滴眼劑等溶劑或稀釋劑及容器的精洗[2]。
由于注射用水嚴(yán)格的質(zhì)量控制,通常從注射用水系統(tǒng)中分離的微生物很少。如果水系統(tǒng)的管道設(shè)計(jì)可有效避免所謂的“死角”(水流中斷的區(qū)域)并且水流保持連續(xù)運(yùn)動(dòng)狀態(tài),則污染風(fēng)險(xiǎn)會(huì)進(jìn)一步降低。
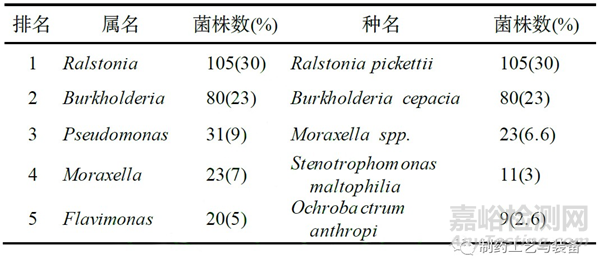
Sandle[3]在15年間收集了46800個(gè)注射用水樣本。研究發(fā)現(xiàn),很少有注射用水樣品不滿(mǎn)足水系統(tǒng)的質(zhì)量要求[歐盟藥典規(guī)定菌落數(shù)不得多于10 CFU·(100 mL)−1]。46800個(gè)樣本中只有300個(gè)樣本檢測(cè)到革蘭氏陰性桿菌(比率為0.6%),最終回收了439個(gè)革蘭氏陰性桿菌(每個(gè)樣本少于2種不同的生物體)。主要的屬、種信息見(jiàn)表3。數(shù)量上最常見(jiàn)的微生物種名還是Ralstonia pickettii,Burkholderia cepacia 和Flavimonas oryzihabitans。鄭小玲等[7]分析了浙江省內(nèi)制藥企業(yè)注射用水的微生物結(jié)構(gòu),發(fā)現(xiàn)污染的微生物主要為革蘭氏陽(yáng)性菌,占污染微生物總數(shù)的60.3%,革蘭氏陽(yáng)性菌主要是由于外部環(huán)境控制不當(dāng)特別是人員操作污染引入,因此企業(yè)注射用水系統(tǒng)的微生物控制不僅要關(guān)注革蘭氏陰性菌風(fēng)險(xiǎn),同時(shí)也不能忽視環(huán)境人員污染風(fēng)險(xiǎn)。
表3 注射用水中排名前五的主要菌屬
2、制藥用水中主要的微生物及其危害性分析
洋蔥伯克霍爾德菌復(fù)合體(Burkholderia cepacia complex,BCC)和皮氏羅爾斯頓菌是制藥用水中主要的污染菌。筆者將進(jìn)一步對(duì)它們能在純水系統(tǒng)中生存的主要原因和危害性進(jìn)行綜述。
2.1 BCC
BCC因引起洋蔥患病而得名,實(shí)際上它可以感染植物界及人類(lèi),具有較強(qiáng)跨界感染能力,可以使患有囊性纖維化和慢性肉芽腫性疾病的患者引起嚴(yán)重的“洋蔥伯克氏菌綜合癥”致死。免疫功能低下患者(虛弱的老年人、HIV 陽(yáng)性者、接受化療的癌癥患者等)中也有該菌感染的報(bào)道[8]。2007年發(fā)表的一份調(diào)查報(bào)告顯示,在1998年—2006年FDA非無(wú)菌藥品微生物污染召回事件中,占22%的污染微生物為洋蔥伯克霍爾德菌,污染藥品類(lèi)型包括:痤瘡膏、糖漿、吸入液、非酒精身體噴霧劑、嬰兒油、洗發(fā)水和漱口水[9]。2004年—2011年,有34%的產(chǎn)品召回與該菌的污染有關(guān)[10]。2012年—2019年的FDA召回事件表明,洋蔥伯克霍爾德菌是非無(wú)菌藥物微生物污染召回的頭號(hào)原因(占45.3%,共發(fā)生102次召回)[11]。這些召回事件引起了美國(guó)藥典委員會(huì)的重視, 并特別發(fā)布USP<60>非無(wú)菌產(chǎn)品的微生物學(xué)檢查:伯克霍爾德菌復(fù)合物,以檢測(cè)非無(wú)菌產(chǎn)品中是否存在BCC物種。
BCC之所以是制藥行業(yè)主要的不可接受微生物,主要原因是由于它具備以下能力:①能在寡營(yíng)養(yǎng)和低滲透壓的純水環(huán)境生存的能力。保持完整外膜結(jié)構(gòu)的能力與該菌在水環(huán)境中長(zhǎng)期存活有關(guān)[12]。在營(yíng)養(yǎng)缺乏時(shí),形態(tài)從典型的革蘭氏陰性桿菌轉(zhuǎn)變?yōu)榍蚓⒖蛇M(jìn)入休眠狀態(tài)活著但不可培養(yǎng)。該階段細(xì)胞代謝活性降低,膜脂成分改變,導(dǎo)致外膜通透性降低,從而增加對(duì)多黏菌素B的耐受性。此外,大多數(shù)基因表達(dá)水平降低,而氨基酸、脂肪酸和磷脂代謝基因表達(dá)水平增加,這表明這些化合物可以在營(yíng)養(yǎng)缺乏的情況下替代碳源和能源[13]。②BCC具備可以在多種藥物中生長(zhǎng)和增殖能力。BCC 細(xì)菌能夠使用多種有機(jī)化合物作為碳源和能源,其中一些是很難分解代謝的外源性物質(zhì)[14]。例如,它們能夠通過(guò)對(duì)芳香結(jié)構(gòu)氧化并對(duì)鹵化化合物進(jìn)行分解,從而在硝基芳香族和芳香族化合物中生存,可導(dǎo)致藥品活性成分的降解,從而影響藥物的穩(wěn)定性和純度,以及它們的效力和有效性[15]。藥物降解還可能導(dǎo)致有毒物質(zhì)的形成[16]。最終對(duì)這類(lèi)產(chǎn)品的消費(fèi)者構(gòu)成了嚴(yán)重的風(fēng)險(xiǎn)。③對(duì)細(xì)菌抑制劑、抗生素有強(qiáng)大的耐受機(jī)制的能力。它們可以通過(guò)形成生物被膜、耐藥基因等方式抗逆。
2.2 皮氏羅爾斯頓菌
通過(guò)分析2012年—2019年的FDA召回報(bào)告發(fā)現(xiàn),羅氏菌(占總召回?cái)?shù)的20%,共發(fā)生45次召回)排在洋蔥伯克霍爾德菌之后,是非無(wú)菌藥物微生物污染召回的第二大原因[11]。
羅爾斯頓菌屬最初的分類(lèi)學(xué)分支在假單胞菌家族,然后轉(zhuǎn)到伯克霍爾德菌屬, 2004年Vaneechoutte等[17]將Ralstonia spp單獨(dú)列為一個(gè)屬。
皮氏羅爾斯頓菌是該屬的代表菌,可在水管中形成生物膜。研究也已證明它能產(chǎn)生高絲氨酸內(nèi)酯,這是生物膜發(fā)育過(guò)程中的細(xì)胞間信號(hào)分子[18]。該菌也在發(fā)現(xiàn)號(hào)航天飛機(jī)水系統(tǒng)、火星奧德賽探測(cè)器封裝設(shè)施系統(tǒng)中檢測(cè)到[19]。
皮氏羅爾斯頓菌不被認(rèn)為是主要病原體,它的毒力也較低,但它引起的感染報(bào)導(dǎo)屢見(jiàn)不鮮,包括血流感染[20]、腦膜炎[21]和瘧原蟲(chóng)體外培養(yǎng)污染[22]等。許多皮氏羅爾斯頓菌感染病例是由于受污染的溶液引起的,包括注射用水、用純化水制成的鹽水溶液和無(wú)菌藥物溶液。這些藥物可以靜脈注射和作為滴注液,用于清潔傷口或用于氣管內(nèi)吸痰,從而導(dǎo)致血液(菌血癥)和呼吸道感染[23]。而這些溶液產(chǎn)品的污染最大可能是發(fā)生在制造階段。過(guò)濾器往往用于一些藥物的終端滅菌,但皮氏羅爾斯頓菌能夠通過(guò)0.45μm和0.22μm的濾膜,從而使得終產(chǎn)品染菌[24]。在1983年,5名嬰兒因?yàn)槭褂昧耸芷な狭_爾斯頓菌污染的呼吸治療溶液而被感染,而這正是由于蒸餾水的生產(chǎn)過(guò)程中繞過(guò)了一個(gè)82℃的儲(chǔ)槽,使得該菌活著進(jìn)入了溶液[25]。此外,該菌也能在醫(yī)院消毒劑中存活,包括洗必泰和乳酸依沙吖啶[26]。
盡管皮氏羅爾斯頓菌毒力很低,但正如上文所提及的該菌已被確定為會(huì)導(dǎo)致許多潛在的有害感染和死亡。因此,制藥用水中尤其要控制此菌的污染。
3、制藥用水系統(tǒng)的微生物控制措施
即使藥企對(duì)制藥用水系統(tǒng)進(jìn)行嚴(yán)格的控制,還是有很小數(shù)量微生物存在于各個(gè)級(jí)別的用水系統(tǒng)中。此外,制藥企業(yè)對(duì)于水系統(tǒng)的微生物檢測(cè)也有不足之處,主要有:①水中的微生物分布遵循泊松分布而非均勻分布,這使得水體微生物的回收率往往重復(fù)性不佳;②培養(yǎng)條件的限制。培養(yǎng)基的選擇性和培養(yǎng)時(shí)長(zhǎng)的受限,都會(huì)影響水體中微生物的回收率。如受培養(yǎng)基的選擇性,Prosthecate bacteria( 柄桿菌) , Mycobacterium species(分枝桿菌), Spirochaetes( 螺旋體) ,Thiobacillus species(硫桿菌屬)等種類(lèi)很難被培養(yǎng);③采樣方式的局限性。目前的采樣大多針對(duì)自由漂浮狀態(tài)的微生物,而不是對(duì)附著在底層的微生物或生物膜群落的部分進(jìn)行檢測(cè);④制藥用水是一個(gè)營(yíng)養(yǎng)及其缺乏的極端環(huán)境,絕大多數(shù)的微生物以“活著但不可被培養(yǎng)”或者生物被膜的狀態(tài)存在,因此目前藥企的培養(yǎng)結(jié)果也僅占水系統(tǒng)微生物的小部分。
正是由于微生物在制藥用水系統(tǒng)中的不確定性,制藥企業(yè)的微生物專(zhuān)家需要考慮和了解水系統(tǒng)中的微生物的不斷變化的模式,開(kāi)展一系列的工作,包括:①建立各級(jí)水系統(tǒng)的微生物數(shù)據(jù)庫(kù)。對(duì)構(gòu)成不同水系統(tǒng)微生物常見(jiàn)分離株進(jìn)行鑒定,并了解不同水質(zhì)之間是否存在關(guān)系。②建立趨勢(shì)分析的方法。可以連續(xù)幾年對(duì)水系統(tǒng)中的微生物數(shù)據(jù)進(jìn)行比較和趨勢(shì)分析,檢查微生物的種類(lèi)是否與預(yù)期在水系統(tǒng)中發(fā)現(xiàn)的微生物相似,同時(shí)能夠?qū)厔?shì)的任何變化作出及時(shí)的響應(yīng)。③收集并建立水系統(tǒng)常見(jiàn)的微生物菌種庫(kù),用于培養(yǎng)基驗(yàn)證、消殺驗(yàn)證等。
4、結(jié)束與展望
本文綜述了3個(gè)級(jí)別的制藥用水中的主要微生物種類(lèi),不同級(jí)別的制藥用水的微生物污染種類(lèi)存在差異。從國(guó)內(nèi)外研究情況來(lái)看,飲用水微生物中主要的3個(gè)屬為Pseudomonas ,Brevundimonas 和Sphingomonas,純化水微生物中主要的屬為Ralstonia 和Burkholderia,注射用水微生物數(shù)量很少超過(guò)藥典規(guī)定和企業(yè)內(nèi)部質(zhì)控要求,但在日常注射用水微生物控制時(shí)不僅要關(guān)注革蘭氏陰性菌風(fēng)險(xiǎn),同時(shí)也不能忽視環(huán)境人員污染風(fēng)險(xiǎn)。這些研究可以為各家藥企對(duì)自身水系統(tǒng)的微生物監(jiān)測(cè)提供一個(gè)參考數(shù)據(jù)。BCC 和皮氏羅爾斯頓菌是制藥用水中主要的污染菌,未來(lái)對(duì)于污染菌的溯源問(wèn)題,可采用全基因組測(cè)序的方式實(shí)現(xiàn)。此外,水系統(tǒng)中還有一些常見(jiàn)革蘭氏陰性細(xì)菌如Sphingomonas paucimobilis 和Stenotrophomonas maltophilia 等也存在一定的生物安全隱患。對(duì)6株S. paucimobilis進(jìn)行全基因組測(cè)序分析發(fā)現(xiàn)它們均含有氟喹諾酮類(lèi)抗生素和四環(huán)素抗性,3個(gè)毒力因子為所有菌共含有。對(duì)鑒定結(jié)果為S. maltophilia的7株菌進(jìn)行全基因組分析,發(fā)現(xiàn)大部分耐氟喹諾酮類(lèi)、大環(huán)內(nèi)脂類(lèi)抗生素、利膽醇和四環(huán)素,有17個(gè)毒力因子為所有菌共有(未發(fā)表數(shù)據(jù))。因此,為控制水系統(tǒng)微生物污染的風(fēng)險(xiǎn),除了水系統(tǒng)的科學(xué)設(shè)計(jì)外,對(duì)于每家藥企來(lái)說(shuō),應(yīng)基于警戒限和行動(dòng)限進(jìn)行趨勢(shì)分析[27],并根據(jù)各自水系統(tǒng)的使用情況建立微生物規(guī)范。作為一般指導(dǎo),水系統(tǒng)應(yīng)至少每年進(jìn)行1次回顧,關(guān)注代表性和潛在微生物的檢出情況。
參考文獻(xiàn)
[1] WANG L J. Discussion of quality standard for pharmaceutical water and preparation in the system technology[J]. Chin J Pharm(中國(guó)醫(yī)藥工業(yè)雜志), 2018, 49(9): 1230-1238.
[2] 中國(guó)藥典. 四部[S]. 2020: 〈0261〉制藥用水.
[3] SANDLE T. Characterizing the microbiota of a pharmaceutical water system-A metadata study[J]. SOJ Microbiol Infect Dis, 2015, 3(2): 1-8.
[4] HU Y, HU D, YU X, et al. Evaluation for source water biosafety in Qiandao Lake, China[J]. Acta Sci Circumstantiae(環(huán)境科學(xué)學(xué)報(bào)), 2021, 41(2): 634-640.
[5] SHUKSHITH K S, GUPTA N V. Water for Pharmaceutical Use[J]. Int J Pharm Sci Rev Res, 2016, 36(1): 199-204.
[6] ZHANG W, BIAN C H, CHEN H, et al. Effect of microbiology ecology in main seal water system of power plants[J]. Nucl Power Eng(核動(dòng)力工程), 2016, 37(S1): 64-67.
[7] ZHENG X L, WANG Y H, CAO W, et al. Establishment and analysis of microbial library in pharmaceutical water system of high-risk injection manufacturer[J]. Chin J Mod Appl Pharm(中國(guó)現(xiàn)代應(yīng)用藥學(xué)), 2021, 38(9): 1065-1068.
[8] LI M, ZHANG M, ZHONG Y W, et al. Spidemiological survey of an outbreak of nosocomial infection caused by Burkholderia cepacian[J]. Chin J Nosocomiol(中華醫(yī)院感染學(xué)雜志), 2020, 30(15): 2326-2329.
[9] JIMENEZ L. Microbial diversity in pharmaceutical product recalls and environments[J]. PDA J Pharm Sci Technol, 2007,61(5): 383-399.
[10] SUTTON S, JIMENEZ L. A review of reported recalls involving microbiological control 2004-2011 with emphasis on FDA considerations of “Objectionable Organisms”[J]. Am Pharm Review, 2012, 15(1): 42-57.
[11] JIMENEZ L. Analysis of FDA enforcement reports(2012-2019) to determine the microbial diversity in contaminated non-sterile and sterile drugs[J]. Am Pharm Review, 2019, 22(6): 1-21.
[12] MOORE R A, TUANYOK A, WOODS D E. Survival of Burkholderia pseudomallei in water[J]. BMC Res Notes,2008(1): 11.
[13] LEWENZA S, ABBOUD J, POON K, et al. Pseudomonas aeruginosa displays a dormancy phenotype during long-term survival in water[J]. PLoS One, 2018, 13(9): e0198384.
[14] ZURITA J, MEJIA L, ZAPATA S, et al. Healthcare-associated respiratory tract infection and colonization in an intensive care unit caused by Burkholderia cepacia isolated in mouthwash[J].Int J Infect Dis, 2014(29): 96-99.
[15] JIMENEZ L, KULKO E, BARRON E, et al. Burkholderia cepacia: a problem that does not go away![J]. EC Microbiology, 2015, 2(1): 205-210
[16] RATAJCZAK M, KUBICKA M M, KAMI?SKA D, et al.Microbiological quality of non-sterile pharmaceutical products[J]. Saudi Pharm J, 2015, 23(3): 303-307.
[17] VANEECHOUTTE M, KÄMPFER P, DE BAERE T, et al.Wautersia gen. nov., a novel genus accommodating the phylogenetic lineage including Ralstonia eutropha and related species, and proposal of Ralstonia[Pseudomonas] Syzygii(Roberts et al. 1990) comb. nov[J]. Int J Syst Evol Microbiol,2004, 54(Pt 2): 317-327.
[18] ADLEY C, SAIEB F. Microbials: Biofilm formation in high-purity water: Ralstonia pickettii a special case for analysis[J]. Ultrapure Water, 2005, 22(1): 14-19.
[19] MCBAIN A, ALLISON D, PLATTEN J, et al. Biofilms:Persistence and Ubiquity[M]. Cardiff: Biofilm Club, 2005.
[20] WANG X X, SONG Y Q, CAO Y D, et al. Pharmaceutical care for a patient with hemophilic lymphocytosis secondary to ralstonia bloodstream infection during pregnancy[J]. Central South Pharm(中南藥學(xué)), 2021, 19(1): 130-133.
[21] WANG P L, WU Z P. Metagenomic next-generation sequencing for the diagnosis of Ralstonia pickettii meningitis:A case report and literature review[J]. J New Med(新醫(yī)學(xué)),2020, 51(6): 478-481.
[22] YIN Y, LU F, XU J H, et al. Detection of blood contamination caused by Ralstonia pickettii during in vitro culture of Plasmodium falciparum[J]. J Pathog Biol(中國(guó)病原生物學(xué)雜志), 2018, 13(12): 1324-1326, 1334.
[23] RYAN M P, PEMBROKE J T, ADLEY C C. Ralstonia pickettii: A persistent gram-negative nosocomial infectious organism[J]. J Hosp Infect, 2006, 62(3): 278-284.
[24] ANDERSON R L, BLAND L A, FAVERO M S, et al. Factors associated with Pseudomonas pickettii intrinsic contamination of commercial respiratory therapy solutions marketed as sterile[J]. Appl Environ Microbiol, 1985, 50(6): 1343-1348.
[25] MCNEIL M M, SOLOMON S L, ANDERSON R L, et al.Nosocomial Pseudomonas pickettii colonization associated with a contaminated respiratory therapy solution in a special care nursery[J]. J Clin Microbiol, 1985, 22(6): 903-907.
[26] OIE S, KAMIYA A. Bacterial contamination of commercially available ethacridine lactate (acrinol) products[J]. J Hosp Infect, 1996, 34(1): 51-58.
[27] WANG S J, YU M, WANG G G, et al. Environment monitoring and environmental microbial library establishment in clean area of pharmaceutical industries[J]. Chin J Pharm(中國(guó)醫(yī)藥工業(yè)雜志), 2020, 51(10): 1334-1340.
本文作者李櫻紅、張林爽、李玨、鄭小玲、王征南、王銀環(huán)、陳君豪、洪亮、陶巧鳳、陳歡,浙江省食
品藥品檢驗(yàn)研究院、NMPA微生物檢測(cè)與預(yù)警重點(diǎn)實(shí)驗(yàn)室、浙江省藥品接觸材料質(zhì)量控制研究重點(diǎn)實(shí)驗(yàn)室、臺(tái)州市藥品檢驗(yàn)研究院、杭州微數(shù)生物科技有限公司,僅供交流學(xué)習(xí)。