1���、 為什么要重視質量標準
IND申請是創新藥研發的重要時間節點之一,是所研發新藥第一次接受專業審評,決定其是否能如期開展臨床試驗的關鍵。
IND申請階段重點關注新藥的安全性�,安全性是建立在質量可控基礎之上的���,質量標準是確保產品質量可控性的重要的技術標準。
2�、 IND階段質量標準特點
新藥研發具有明顯的階段性和漸進性�,相應的質量標準的要求也具有明顯的階段性和漸進性��。因此���,IND階段質量標準要求與后期臨床研究階段及商業化生產階段并不完全相同����。IND階段由于工藝還未完全確定����,且對藥物的認識及可供研究數據有限,質量標準的設置通常會相對寬松一些�����,隨著研究深入�,無論是進一步增加質量控制項目,還是收緊控制限度都相對方便�,反之則容易造成質量標準的重大變更�,因此���,在確保安全性的前提下�����,在IND階段盡量不要把控制限度定的過緊�。
3�����、 IND階段質量標準建立一般流程
在IND申請階段,質量標準設立流程如下:
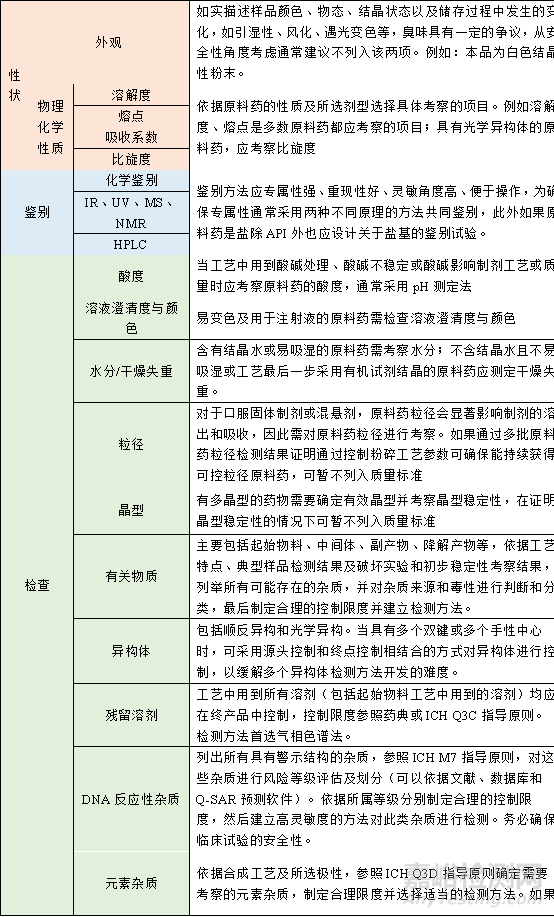
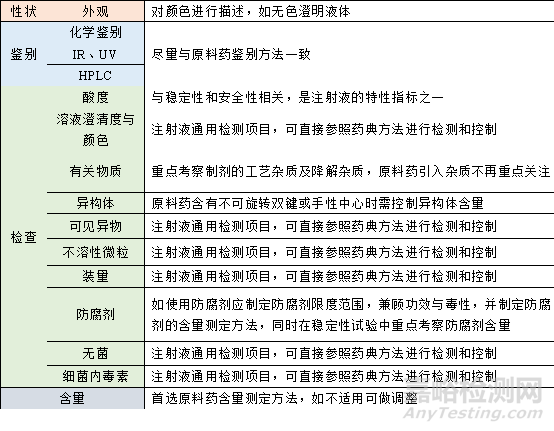
1)依據原料藥的特性及設定的劑型����,全面分析與安全性�、有效性相關的項目����。
2)建立可靠的分析方法。
3)根據早期工藝特點、典型批次數據(包括申報批次、臨床批次和毒理批樣品)及初期穩定性研究結果確定合理的限度����。
4)經過充分考察和數據積累��,確定哪些項目列入質量標準哪些項目可以暫不列入質量標準。
5)隨研發的進程推進、分析技術發展�����、生產工藝的放大和成熟以及產品質量數據積累��,對質量標準進行修訂��。
4、 IND階段質量標準一般通用格式
下表分別列舉了原料藥和片劑、溶液注射液的質量標準控制項目的考慮和設置。
表1 IND階段原料藥質量標準關注項目
表2 IND階段片劑質量標準關注項目
表3 IND階段注射液質量標準關注項目
5 結論
在IND階段,尤其是研究早期���,由于工藝還未完全確定,產品質量存在較大變數,質量標準一味追求嚴格可能會面臨后期的重大變更�,太過松懈又無法確保安全性���,因此在這一階段質量控制既要符合階段性研究特點���,重點關注安全性�,同時也要注意與后期質量控制的銜接,盡量尋找兩者的平衡點����。
參考文獻:
[1]ICH Q系列及M系列指導原則
[2]中國藥典2020年版四部通則
[3]化學藥物質量標準建立的規范化過程技術指導原則