在自然界中,相同的碳元素構成了性質截然不同的金剛石與石墨。在晶體研究領域中,乙基硫酸鉀從溶劑中重結晶,高溫呈長羽毛狀(α型),而低溫下又以葉片狀示人(β型),兩者具有迥異的溶解度。已經獲得上市批準的利托那韋僅僅在一年之后發生“優勢晶型”的變更,導致藥物溶出度降低,退市后以新的晶型進行制劑工藝的研究又重新上市。同一化合物由于藥物分子在結晶時受各種因素的影響,使分子骨架與取代基以及分子中碳原子手性等發生變化,同時藥物分子之間,藥物分子與溶劑分子之間相互作用力或結合方式發生改變,導致構成晶體的分子或者原子在晶格中的空間排列的不同,從而形成了不同的晶體,同時也造就了藥物多晶型的現象。
在廣泛的化合物種類中,進行化合物晶型篩選,發現89%的化合物存在多晶型現象。
一個原料藥的不同多晶型可以有不同的化學和物理特性,包括熔點、化學反應性、表觀溶解度、溶解速率、光學和機械性質、蒸氣壓和密度。這些特性可以直接影響原料藥和制劑的處理和/或生產,并且會影響制劑的穩定性、溶解度和生物利用度。所以,多形態可以影響藥物制劑的質量、安全性和有效性。
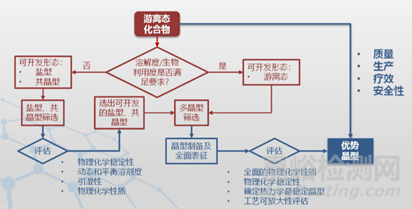
那么,在藥物研發中,面對多晶型藥物的存在,我們又該如何去決斷使用哪個具體晶型去做研究呢?即優勢晶型的選擇問題。其實,優勢晶型可能是單一的晶型藥物,也可以按照一定比例選擇兩種或者多種晶型物質的混和物作為藥用晶型。比如,鹽酸文拉法辛存在六種晶型,其上市品種原料為晶型1、晶型2或它們與晶型6的混合物。對于難溶性藥物,甚至使用亞穩定性晶型或者無定型,同時需要通過一些輔料或者制劑手段保證藥物晶型所存在的狀態。為了確定藥物研發過程中的優勢晶型。不僅僅需要考慮與關注藥物的理化性質,還要兼顧其有效性,穩定性,安全性以及可生產性。下面我們簡單介紹一下各國藥監部門以及ICH關于藥物研發過程中,對于藥物晶型的控制政策與法規條文。
FDA發布的《仿制藥晶型研究指導原則》:
a.仿制制劑不要求與原研采用相同的晶型,但是需要證明藥物制劑足夠穩定,且生物等效;
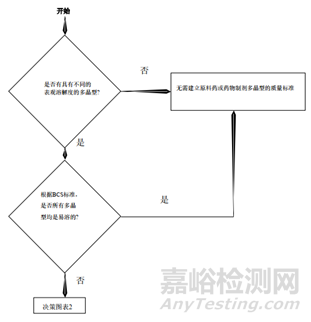
b.對于對多晶型原料藥,需要進行溶解度、熔點、穩定性等考察,根據多晶型的表觀溶解性和BCS分類決定原料藥是否制訂晶型控制標準。
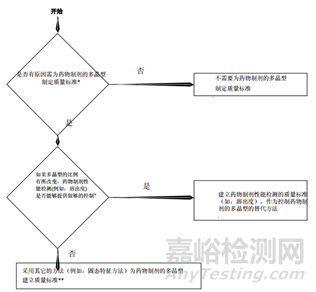
c.對于多晶型藥物制劑,需要評估晶型在制粒過程中的穩定性,一般不需要制訂晶型控制標準,但是當晶型發生改變、且溶出度測試不能提供足夠的控制時,需要建立晶型控制標準。
ICH Q6a中描述多晶型藥物:
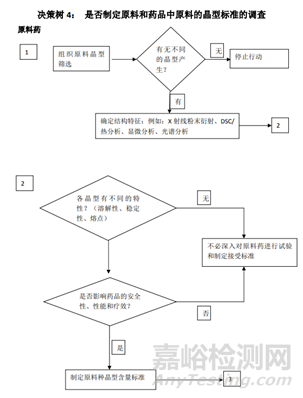
有些新原料藥以不同晶型存在,不同晶型物理性質不同。多晶型也可能包括溶劑化物和水合物(亦稱假多晶型和無定型物),在某些情況下,形態不同可能影響新藥制劑的質量或功效。如果不同晶型會影響功效、生物利用度或穩定性,就應規定適當的固體晶型。
同時也給出了多晶型檢測的方法:物理化學測試和技術常用于測定多種形態是否存在,這些方法舉例如下:熔點(包括熱層顯微鏡)、固體形態的紅外光譜、粉末X線衍射、熱分析法[差熱掃描(DSC)、熱重分析(TGA)和差熱分析(DTA)]、雷曼光譜、電子掃描顯微鏡、固態 NMR(磁共振光譜)。
測定制劑中多晶型的變化,在技術上通常很困難,一般可用替代方法(如溶出度)來監測生產工藝。多晶含量在無其他替代辦法的情況下才作為一個試驗項目并列出認可標準。
2020版中國藥典:《藥品晶型研究及晶型質量控制指導原則》
當固體藥物存在多晶型現象,且不同晶型狀態對藥品的有效性、安全性或質量可產生影響時,應對原料藥物、固體制劑、半固體制劑、混懸劑等中的藥用晶型物質狀態進行定性或定量控制。藥品的藥用晶型應選擇優勢晶型,并保持制劑中晶型狀態為優勢晶型,以保證藥品的有效性、安全性與質量可控。
自然界中的固體物質可處于穩定態、亞穩定態、不穩定態三種狀態,晶型物質亦如此。化合物晶型物質狀態會隨著環境條件變化(如溫度、濕度、光照、壓力等)而從某種晶型物質狀態轉變為另外一種晶型物質狀態,稱為轉晶現象。共晶物的轉晶可以是由兩種化學物質中的任意一種或兩種發生固體物質狀態的晶型轉變。由于藥用晶型物質的穩定性會影響到藥品的臨床有效性與安全性,故需要對多晶型藥物晶型物質狀態的穩定性進行研究。研究內容包括:原料藥成分的晶型物質狀態的穩定性,原料藥晶型物質與制劑處方中各種輔料的相容性,制劑的制粒、成型、干燥等工藝對原料藥晶型物質狀態的影響等。
通過晶型物質狀態的穩定性研究,可為優勢藥物晶型物質狀態選擇、藥物制劑處方、制備工藝過程控制、藥品貯存條件等提供科學依據。
不同藥物的不同晶型物質狀態對定性鑒別方法或成分含量定量分析方法的特異性可以相同或不同。中國藥典詳細介紹了晶型種類鑒別一定性方法以及晶型含量分析——定量方法。
晶型藥物的溶解性或溶出度評價:本法為體外晶型物質評價的輔助方法。當原料晶型物質狀態不同時,晶型原料或固體制劑的溶解或溶出性質可能存在較大差異,所以需要進行晶型物質與溶解或溶出性質的關系研究。以溶解度或溶出度、溶解速率或溶出速率作為評價指標。原料藥采用溶解曲線法,固體制劑采用溶出曲線法。
總結:從上面的指導原則,我們可以看到晶型研究的重要性,而且各指導原則雖然有差異但又互相補充,同時也給了我們一個晶型藥物的的一個研究思路。首先通過技術手段判定這個藥物有無多晶型現象,如果沒有,自然不用研究;反之,存在多晶型現象,我們需要進一步研究其理化性質(穩定性,溶解度等)的差異,若差異無或者風險評估后,影響極小,也不用指定標準;反之,各晶型間理化性質差較大,那么,存在的不同是否會影響藥物安全性與有效性,無影響需要研究,反之,需要對化合物進行晶型的質量控制。對于制劑的多晶型研究,首先需要研究制劑過程中晶型的穩定性,如粉碎,過篩,制粒,壓片,包衣過程中藥物晶型的穩定性,不變化無需指定質量標準,反之,需要研究晶型變化會不會對藥物理化性質,穩定性等進行影響,沒有影響無需研究,反之,就需要制定標準。
藥物晶型是連接藥物分子與藥物制劑的橋梁,在藥物基本理化性質研究的基礎上,進行晶型研究與控制,并在制劑開發中持續進行晶型研究。明確其重要性與可控性,助力藥物開發。當然,我僅僅是整理和羅列了這些指導原則一些比較共性的內容,具體細節還需要大家結合自己的項目進行研究。
如有不妥之處,還請指出。
參考文獻
1 2020版中國藥典:《藥品晶型研究及晶型質量控制指導原則》
2 ICHQ6a
3《仿制藥晶型研究指導原則》
4 晶型藥物研發的理論與應用
5Diversity in Single- and Multiple-Component Crystals. The Search
for andPrevalence of Polymorphs and Cocrystals
6 新藥研發中的關鍵晶型問題-陳敏華