摘 要 早期抗體藥物是鼠源單克隆抗體����,存在免疫原性強、半衰期短等問題。歷經數十年的發展,抗體藥物從最初的鼠源單抗�,逐步發展為人鼠嵌合抗體����、人源化抗體及全人源化抗體��。通過片段重組���、位點修飾��、藥物偶聯等方法,科研人員研發了包括抗體融合蛋白、抗體偶聯藥物�、雙特異性抗體��、小分子抗體片段等形式多樣的抗體藥物。抗體藥物在惡性腫瘤����、自身免疫病����、感染性疾病的治療上發揮重要作用�����。通過對抗體藥物人源化歷程���,不同類型的抗體結構和特點�,以及抗體藥物在新型冠狀病毒肺炎治療中的應用進行綜述����,并對抗體藥物的發展前景進行展望,以期為我國抗體藥物的研發提供參考。
關鍵詞 抗體藥物�����;人源化����;抗體融合蛋白���;抗體偶聯藥物�;雙特異性抗體;小分子抗體片段�����;新型冠狀病毒肺炎
抗體藥國內及全球研發概況
國內抗體藥物雖然起步較晚,但近些年國內對抗體藥物的需求放量增長,市場迎來飛速發展���。據統計,中國2014年抗體藥物市場規模為108億元,2019年增至375億元(圖1)���。鑒于抗體藥物應用廣泛,適用腫瘤、自身免疫性疾病、神經病學及骨質疏松癥等不同的治療領域�����,預計2022年市場規模將擴大至890億元��。
圖1.中國抗體市場規模(億元)參考來源:中商情報網
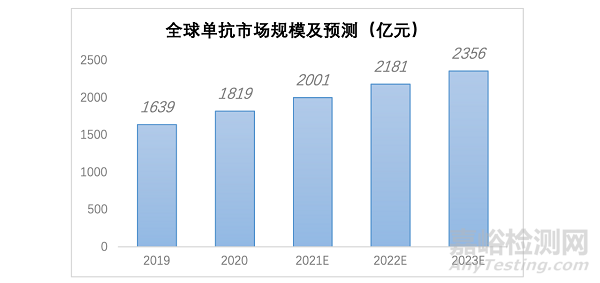
目前抗體藥物主要包括單克隆抗體(亦稱為裸單克隆抗體)�、雙特異性抗體及抗體藥物偶聯物(ADC�����,亦稱為偶聯的單克隆抗體)����。其中���,單克隆抗體是研發最早�、研究最為深入的抗體藥�����,具有較高的安全性與有效性����。根據弗若斯特沙利文報告���,2018年全球單克隆抗體規模占全球生物藥和整體醫藥市場規模分別為 55.3%��、11.4%���。相較于全球單克隆抗體市場�,中國單克隆抗體市場尚處于起步階段�����,2018年中國單克隆抗體市場在中國整體醫藥市場的比重僅約1.0%��,遠低于全球11.4%的水平(圖2)。
圖2.全球單抗市場規模及預測(億元)參考來源:中商情報網
從2017年開始,國家醫療保險制度在單抗藥物覆蓋面顯著擴大�,這有利于提高國內未來單抗處方的滲透率����。同時,免疫治療產品如Opdivo���、Keytruda等PD-1抑制劑在中國相繼獲批����,也將進一步促進中國單抗市場的擴容����。數據顯示,預計到2024年,單抗市場將增長到1,580億元人民幣,2019年到2024年的年復合增長率為40.6%。
抗體藥物熱門靶點
目前抗體藥物研發熱點是免疫檢查點�����,這也是近年來廣為熟知的靶點���。腫瘤細胞的免疫逃逸機制主要可歸結為三個方面:一是通過改變腫瘤相關抗原的表達水平或者降低MHC I類分子的表達來規避免疫細胞的識別���;二是通過釋放TGF-β�����、IL-10等免疫抑制因子形成抑制性的腫瘤微環境�����;三是通過調節腫瘤細胞表面的共刺激分子水平降低腫瘤致免疫能力�,從而有效避免對T細胞的激活���。腫瘤免疫治療(Cancer Immunotherapy)的目的是克服腫瘤細胞的免疫逃逸機制���,重建免疫系統對腫瘤細胞的識別和清除����。所謂免疫檢查點(Immune Checkpoint),即是控制T細胞免疫響應的分子開關��,2011年全球首個免疫檢查點抗體伊匹單抗(Ipilimumab�����,anti-CTLA-4)獲批上市,正式開啟了腫瘤免疫治療的全新時代����。
從作用機制來看��,腫瘤免疫治療涉及四大策略(圖3):(a)消除免疫抑制,代表性的靶點有CTLA-4、PD-1、LAG-3�、TIM-3�����、TIGIT、CD96等免疫檢查點以及VEGF、CSF1����、TGF-β��、IL-10、IL-34、IL-35、CCL2����、FGF等免疫抑制因子及受體����,靶向這類分子的抗體均為拮抗型��。(b)誘導免疫原性腫瘤細胞死亡(Immunogenic Cancer-Cell Death)����,一些常規靶向治療制劑可劃歸此類���。(c)是促進T細胞�、巨噬細胞和NK細胞等效應細胞的活化�����,代表靶點有OX40�、GITR���、CD28��、CD47����、CD137�、CD200、B7-H3��、B7-H4�、B7-H5、B7-H6��、IL-15R����、SIRPα/CD47和KIR等��。(d)增強APC細胞的抗原呈遞和輔助性,進而激活效應細胞的功能��,代表靶點有SIRPα���、CD40�����、STING、TLR等����。后兩類靶點因功能和作用機制不同�,可區分為拮抗劑或激動劑��。
圖3. 腫瘤免疫治療的四大策略
參考來源:www.biobusiness.com.cn 生物產業技術
雖然腫瘤免疫治療在腫瘤治療中已發展成獨立分支��,取得巨大成就,但仍有部分技術問題亟待解決�。比如需要提高用藥標志物的有效率��、克服腫瘤微環境的免疫抑制問題。針對該問題的策略是聯合應用不同作用機制的免疫治療靶點抗體或聯用其他療法���,通過合理選擇靶點能達到協同治療的效果。另外��,能抑制免疫抑制性細胞進入腫瘤內部的創新靶點�����,CD25����、Gr-1����、CXCL12/CXCR4、CSF1/CSF1R�����、TGF-β��、IL-10���、IL-35 和 EphA3等也是當前研發熱點。
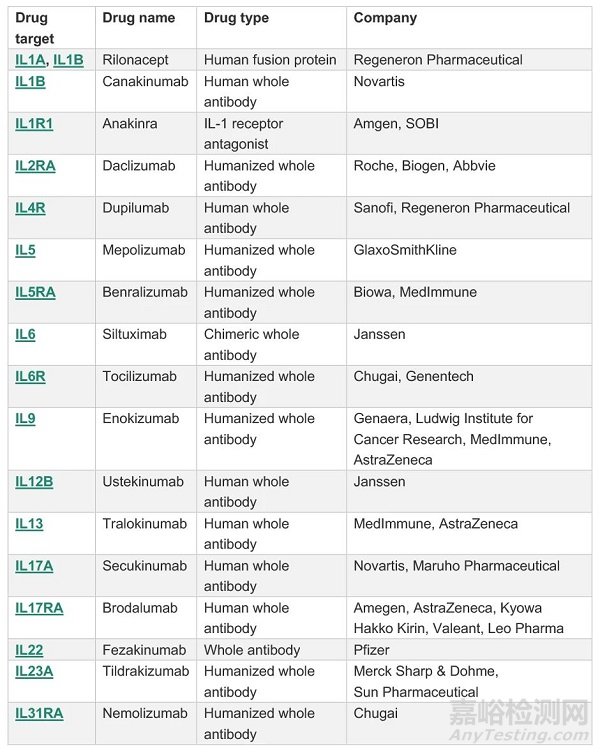
白介素類細胞因子是抗體藥另外的重要研發靶點�����。白介素與多種疾病呈現廣泛的復雜關系�,表現出“一種疾病與多種白介素分子相關,一種白介素分子與多種疾病相關”的特點,這為以白介素及受體為靶點的藥物研發帶來巨大挑戰���。以銀屑病為例,已報道的相關白介素成員就有IL-1、IL-8、IL-17��、IL-18��、IL-19����、IL-20���、IL-22����、IL-23、IL-24等。在白介素抗體研發領域�,目前呈現兩種趨勢�,一是進一步加深相關基礎領域的研究�����,開發更多有效靶點�,二是研究聯合用藥及雙特異抗體聯用的治療方法���,為臨床用藥提供更多選擇。下表為目前已上市或處于研發后期階段的主要白介素抗體藥(表1)���。
表1.全球已上市或處于研發后期的白介素抗體藥
參考來源:www.sinobiological.com
除了上述熱門靶點外���,近年來針對PCSK9�����、CGRP/CGRP受體�����、β淀粉樣蛋白等靶點開展的抗體藥研究也如火如荼,多個趨化因子受體(如CCR2、CCR5���、CXCR4)的相關抗體初露端倪。同時,針對如TNF-α、VEGF/VEGFR���、Her2、CD20等明星靶點的藥物研發持續升溫,針對病原微生物及其毒素的抗體藥物研發也取得巨大進步�����。
抗體藥物熱門技術
在熱門技術領域����,近年來雙特異性抗體藥物的研發備受矚目。此外,兩種或兩種以上單克隆抗體的聯合療法�、基于單抗治療與小分子靶向藥物和化療及ADC組合的療法也表現亮眼��。
雙特異性抗體(bispecific antibodies,bsAbs)是采用抗體工程和基因工程技術(或體外偶聯)構建的能夠特異性結合兩種抗原或兩個表位的重組抗體/抗體片段。目前應用雙特異性抗體技術,能為蛋白復合物連接、分子阻斷協同�、免疫細胞募集�、分子遞送工作提供有力的技術支持����。雙抗藥涉及的治療領域也在不斷拓展,包括腫瘤學、自身免疫/炎癥性疾病、傳染病和心血管疾病等�����。
從廣義來講����,bsAbs可分為三個主要的結構類別:(1)缺乏Fc域的抗體片段(例如雙抗體和串聯單鏈可變片段)�����;(2)抗體片段或替代支架蛋白融合到一個抗體����、抗體Fc區或人血清白蛋白���,以增強其藥代動力學(PK)特性和/或效價���;(3)完全的IgG雙抗結構��,有助于避免非天然抗體產生的免疫原性問題(圖4)���。
圖4.雙特異性抗體結構示意
參考來源:Bispecific antibodies in IBD Review
雙特異性抗體可設計為能同時作用于兩種細胞類型的膜受體�,能選擇性修改致病性免疫細胞的信號傳導路徑�。以炎癥性腸病(IBD)疾病為例,針對IL-23R + /IL-1R + T細胞和與IBD相關的先天淋巴細胞��,通過優先結合能表達兩種靶蛋白的細胞��,能實現目標細胞或活性的高效選擇���,這種方法也被用于開發MGF010���,一種抑制B細胞的雙親和重定向bsAb,能激活自身免疫細胞活性,治療炎癥性疾病�。
雙特異性抗體的技術瓶頸在于結構調整成藥性��,包括免疫原性�����、藥代動力學以及分子穩定性,未來技術發展也會從兼顧雙抗可制備性�����、成藥性和通用性等三方面入手�����,解決上述問題的抗體藥將具有巨大市場價值和應用價值��。
抗體偶聯藥物(ADC)是當下抗體藥研發的又一熱點領域。ADC由三部分——抗體���、細胞毒性有效載荷和連接的接頭組成。其中有效載荷部分必須有皮摩爾范圍濃度的細胞毒性效力�,以便能殺死腫瘤細胞及組織���。目前臨床開發中大多數ADC會使用的細胞毒性化合物有耳他汀類或美登素的衍生物����,它們是抗有絲分裂微管破壞劑��,其他高細胞毒性的化合物有加利車霉素���、雙霉素�����、PBD 二聚體�����、吲哚并苯二氮卓假二聚體等�。ADC藥物化學結構和作用機制如圖5所示���。
圖5.ADC化學結構(a)及作用機制(b)示意
(說明:a圖中IgG1分子與三個細胞毒性載荷(橙色球體)結合����,重鏈和輕鏈分別為深藍色和淺藍色球體。互補決定區域顯示黃色為重鏈,綠色為輕鏈)
參考來源: Antibody–Drug Conjugates for Cancer Treatment
近年來,ADC藥物相關技術的研發工作取得了長足的進步,如非天然氨基酸介導和酶切介導的定點偶聯技術、親水性高且細胞穿透能力低的偶聯物��、以及多種新形式的可裂解連接物�����。不僅如此�����,基于bsAbs抗體以及 PD-L1 抗體的ADC藥物也在開發中。
抗體藥物發展至今,已成為生物藥領域最火熱的研究分支之一����。相信隨著人類對疾病機制研究的不斷深入�����,新的靶點將會不斷涌現,也將擴展更多適應癥,為更多患者帶來福音。
1�、單克隆抗體藥物的人源化歷程
傳統的單克隆抗體藥物具有完整的抗體結構���,包括決定抗體特異性和親和力的抗原結合片段(fragment of antigen binding, Fab)和誘導抗體依賴的細胞介導的細胞毒性作用(antibody-dependent cell-mediated cytotoxicity���,ADCC)、補體依賴的細胞毒性作用(complement dependent cytotoxicity��,CDC)的可結晶片段(fragment crystallizable��, Fc)����。
早期單克隆抗體藥物是以莫羅莫那單抗為代表的全鼠源單抗,用于治療器官移植后的急性排異反應�����,但由于具有較短的半衰期和較強的免疫原性����,易誘發人抗鼠抗體(human anti-mouse antibody, HAMA)反應而被迫退出市場。為了使抗體藥物更好地應用于臨床���,抗體人源化改造的步伐從未停止,經歷了鼠源性、人鼠嵌合性�����、人源化和全人源化4個階段��。
人鼠嵌合抗體通過基因重組技術�����,保留了鼠源的可變區以保證抗體特異性和親和力,而恒定區為人源成分以減低免疫原性�����。目前市場份額較大的人鼠嵌合抗體藥物是1997年上市的利妥昔單抗(rituximab-CD20)��,該抗體藥物通過ADCC和CDC殺死腫瘤細胞,適用于非霍奇金淋巴瘤和慢性淋巴細胞白血病����。
基于CDR移植技術�,人源化抗體將人源化部分提高到95%�����,僅保留動物來源的部分可變區(即骨架區)����,進一步降低了免疫原性��。代表性藥物是1998年批準上市的曲妥珠單抗(trastuzumab-HER2)��,用于治療乳腺癌,通過阻斷HER2信號通路���,抑制腫瘤生長。2008年�����,我國首個自主研發的人源化抗體藥物尼妥珠單抗(nimotuzumab-EGFR)上市�����,用于鼻咽癌的治療��,打破了國外對抗體藥物壟斷的局面。
全人源化抗體完全由人類基因編碼���,顯著減低了免疫原性����,主要依賴于抗體展示技術和轉基因小鼠技術。2002年,經噬菌體展示文庫篩選得到的阿達木單抗(adalimumab-TNFα)成為首個經FDA獲批上市的全人源化抗體����,因其廣泛的適應證和連續多年排名第一的銷量而有“藥王”之稱����,至今仍具有巨大的發展潛力��。
2����、 新型抗體藥物的類型及特點
隨著現代生物技術的發展及對抗體結構和功能認識的不斷深入,研究人員通過不同抗體片段的組合���、對抗體表面的位點進行修飾、偶聯小分子藥物或其他化學物質等策略��,發展了數量龐大的抗體結構形式����,并各有優勢。包括抗體融合蛋白(antibody fusion protein)�����、抗體偶聯藥物(antibody-drug conjugate����, ADC)、雙特異性抗體(bispecific antibody����, BsAb)、小分子抗體片段等。
2.1 抗體融合蛋白
抗體融合蛋白是指通過DNA重組技術�,將目的蛋白基因與抗體片段基因相連并表達的重組蛋白����,具有抗體的特性及融合功能蛋白的活性�����。由于直接由基因編碼表達為完整的融合蛋白�,其優勢在于蛋白與抗體連接穩定���,結合均一�。根據抗體結構的不同,可以將抗體融合蛋白分為完整抗體融合蛋白和抗體片段融合蛋白,且以Fc融合蛋白最多見�����。
Fc融合蛋白的抗體Fc段可以通過增大融合蛋白的分子量及FcRn介導的再循環機制延長藥物半衰期�����,提高融合蛋白的穩定性�����,還可以發揮Fc段特有的細胞毒性作用殺傷腫瘤細胞。另外�,Fc段也有助于融合蛋白生產過程中的表達和檢測����。
研究發現����,細胞因子及其受體有治療疾病的潛能���,但受限于治療窗口較窄���,而細胞因子受體與抗體融合組成的重組抗體細胞因子受體融合蛋白能有效解決該問題���,目前相關研究多處在臨床前或早期臨床研究階段?����,F已上市且應用廣泛的重組抗體細胞因子受體融合蛋白是重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白——依那西普(etanercept-TNF)�����,屬于Fc融合蛋白,適應證為類風濕性關節炎����、銀屑病��、強直性脊柱炎��。另外,各種來源于細菌���、病毒的毒素也可以與抗體融合組成抗體融合蛋白,通過干擾細胞的蛋白合成發揮功能��。重組免疫毒素也是一類重要的抗體融合蛋白��,它是全抗體或抗體片段與蓖麻毒素等生物毒素蛋白的融合蛋白��。目前已獲批上市的重組免疫毒素有remitoro、lumoxiti、vicineum����,主要用于血液系統腫瘤。
2.2 抗體偶聯藥物
抗體偶聯藥物是一類由高特異性和親和力的單克隆抗體��、穩定的連接頭(linker)��、高效的細胞毒性化學藥物(cytotoxic chemical agent)三部分組成的靶向生物藥劑����。通過單克隆抗體的靶向作用特異結合腫瘤細胞����,釋放細胞毒性藥物,殺死腫瘤細胞��,從而實現藥物的高速靶向運輸�、精準殺傷腫瘤細胞、減少全身不良反應的目的����。
人源IgG1型抗體憑借其較弱的免疫原性����、較好的親和力和特異性����、較長的半衰期,能誘發ADCC和CDC的特點而常被應用于ADC�。連接頭的選擇對ADC的效能和安全性有重要影響���,需要保證其在循環中的穩定性和到達靶點后有效釋放藥物����,以腙鍵�����、肽鍵或二硫鍵較常見。常見的細胞毒性藥物類型主要有微管蛋白抑制劑和DNA損傷試劑。
但ADC仍存在一些問題有待改進�����,包括化學偶聯的方法導致細胞毒性藥物與抗體偶聯比例(drug-to-antibody ratio��, DAR)不穩定���,連接頭不穩定導致的脫靶毒性�����,以及藥物釋放后擴散殺傷周圍正常細胞的旁觀者效應。
在臨床應用上,FDA已批準的ADC共10個�����,主要針對血液系統腫瘤和實體瘤�,包括白血病、淋巴瘤、乳腺癌、泌尿系統腫瘤等。目前我國已經獲批進口的ADC有恩美曲妥珠單抗(trastuzumab emtansine-HER2)和維布妥昔單抗(brentuximab vedotin-CD30)����,分別針對乳腺癌和淋巴瘤發揮功能����。2021年,我國首個自主研發ADC維迪西妥單抗(disitamab vedotin-HER2)上市��,用于局部晚期或轉移性胃癌����。
2.3 雙特異性抗體
雙特異性抗體是一類可以同時識別和結合兩種不同抗原的新型抗體。相比于傳統單克隆抗體�����,雙特異性抗體通過誘導細胞相互靠近�����,增強殺傷作用,還可以結合同一細胞表面不同抗原,減少脫靶效應�����。
已經上市或在研發的雙特異性抗體種類繁多����,形式多樣(圖1)。根據是否含Fc段將雙特異性抗體分為兩類��。一類是含Fc段的雙特異性抗體�����,其與傳統抗體結構類似�,但兩個Fab區可以結合不同抗原���,穩定性好��、親和力強����、半衰期較長�����,包括Triomabs、KIHIgG��、DVD-IgG��、2 in 1-IgG�����、CrossMAb、DuoBody和ART-IG等����。另一類是不含Fc段的雙特異性抗體���,由Fab或更小的片段構成��,具有分子量小、穿透力強��、半衰期短等特點�����,如TandAbs����、DART����、BiTE、Bi-Nanobody等��。
圖1 不同形式的雙特異性抗體
Fig.1 Different types of bispecific antibodies
注:CL—輕鏈恒定區(constant light chain)����,VH—重鏈可變區(variable heavy chain),VL—輕鏈可變區(variable light chain)��,顏色深淺代表抗體來源不同�����。已經有成功上市產品的雙特異性抗體形式用*標注�����。
已經獲批上市的雙特異性抗體藥物主要通過介導免疫細胞殺傷,促進蛋白形成功能性復合體��,干擾信號通路發揮作用���。通過雙特異性的結合位點使靶細胞(如腫瘤細胞)和免疫細胞(如T細胞)結合�,準確定位,激活免疫細胞發揮殺傷作用��。2009年上市的卡妥索單抗(catumaxomab-EpCam*CD3)和2014年上市的博納吐單抗(blinatumomab-CD3*CD19)均通過該機制發揮功能���,分別適用于惡性腹水和急性淋巴細胞白血病��。2017年上市的艾美賽珠單抗(emicizumab-FIXa*FX)通過促進蛋白形成功能性復合體發揮功能��。該抗體可以橋接凝血因子IXa和凝血因子X,促進凝血酶生成�����,用于A型血友病的常規預防���。2021年獲批上市的埃萬妥單抗(amivantamab-EGFR*c-MET)則通過阻斷信號通路和介導免疫細胞殺傷雙重抗癌����,適用于EGFR突變的非小細胞肺癌����。
2.4 小分子抗體片段
小分子抗體片段包括以下幾種:抗原結合片段、單鏈可變區(single-chain fragment variable,scFv)和單域抗體,具有體積小��、穿透能力強����、特異性強、免疫原性弱、易于基因工程改造和表達生產等特點。其半衰期短�、易清除的缺點可以通過結合不同的小分子和肽段適當增加分子大小來彌補���,在延長其半衰期的同時��,也能夠拓寬其功能,增強效能。抗體片段的制備方法包括體外酶消化法、多種表達系統表達以及噬菌體展示技術。其中����,大腸桿菌表達系統具有生產成本低���、產量高�����、生產效率高的特點。
1994年,第2個獲批上市的抗體藥物阿昔單抗(abciximab-GPⅡb/Ⅲa)是由哺乳動物細胞表達重組人鼠嵌合IgG抗體�,經木瓜蛋白酶消化獲得顯著降低其免疫原性的Fab片段�����,用于治療克羅恩病及類風濕性關節炎的培塞利珠單抗(certolizumab pegol-TNFα)是來源于大腸桿菌表達系統的人源化F(ab′)2。我國自主研發的美妥昔單抗(metuximab-HAb18G)是鼠源F(ab′)2,偶聯碘[131I]用于治療晚期肝癌��。
scFv抗體片段是由抗體重鏈的可變區(VH)與輕鏈的可變區(VL)在一段肽鏈的連接下構成的小分子抗體��。如雙特異性T細胞銜接器(bispecific T cell engager)類型的雙特異性抗體——博納吐單抗也屬于小分子抗體范疇���。
單域抗體(single-domain antibody,SdAb)是只包含單一可變區(VH/VL)的抗體����。第一個單域抗體是從駱駝科動物體內發現的��,又稱納米抗體(nanobody)�����。單域抗體體積小、穿透能力強、能夠結合傳統抗體所不能觸及的位點���,如結合酶的活性中心,進入實體腫瘤內部,穿過血腦屏障,為免疫治療提供了新的思路。單域抗體穩定性強��,可以耐受極端pH����、高離子強度、蛋白酶存在、高溫等極端情況�����。2019年�,首個單域抗體藥物卡拉西單抗(caplacizumab-vWF)獲批上市,用于獲得性血栓性血小板減少性紫癜的治療。
3���、 抗體藥物在新型冠狀病毒肺炎治療中的應用
抗體藥物在腫瘤殺傷、自身免疫病治療�、移植后免疫抑制均發揮重要作用����,其在感染性疾病�,尤其是病毒感染相關疾病的預防和治療中,也有不可替代的作用���。
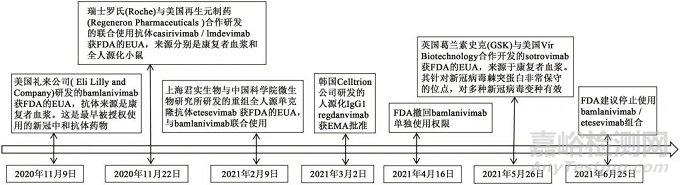
新型冠狀病毒肺炎(coronavirus disease 2019���, COVID-19�,以下簡稱新冠肺炎)疫情蔓延全球,嚴重威脅人們的身體健康和生命安全����。而新型冠狀病毒(SARS-CoV-2�����,以下簡稱新冠病毒)中和抗體是人類對抗病毒的有力武器,在疾病的預防和治療中都發揮了重要作用����。目前已經獲批使用的新冠病毒中和抗體藥物(以下簡稱新冠抗體藥物)共6個(圖2)����,適應證為具有進展至重度或住院高風險的輕��、中度COVID-19成年患者����。
圖2 新冠抗體藥物發展時間軸
Fig. 2 Timeline of antibody drug development of COVID-19
注:FDA為美國食品與藥品監督管理局(US Food and Drug Administration)�����;EUA為緊急使用授權(emergency use authorization)�;EMA為歐洲藥品管理局(European Medicines Agency)��。
新冠抗體藥物來源包括:恢復期患者血漿���、基因工程重組抗體以及轉基因人源化小鼠����。由于恢復期患者來源的中和抗體有活性及濃度的差異��,難以標準化,來源珍貴����,推廣困難�。利用基因工程技術及轉基因人源化小鼠生產抗體則是更好的選擇����。如利用噬菌體展示技術可以高效����、低成本��、大批量地生產抗體藥物�����。
不同機構研發的新冠抗體藥物靶點為新冠病毒表面刺突蛋白的不同位點。使用單一的抗體藥物容易誘導病毒變異和進化�,從而對現有的中和抗體產生逃逸[38]�����。如bamlanivimab單獨使用導致的新冠逃逸突變率達10%。為此���,科學家們提出了兩種解決方案。一是研發針對病毒刺突保守位點的抗體藥物����,如sotrovimab��,其針對的保守位點若突變會影響病毒的功能�����,但通常保守位點難以接觸及開發���。另一解決方案為“雞尾酒療法”�����,通過聯用針對不同位點的多種抗體來避免逃逸。如抗體藥物組合bamlanivimab/etesevimab和casirivimab/imdevimab。但由于病毒變異性較強,bamlanivimab/etesevimab組合在獲批近5個月后被FDA建議停止使用��。