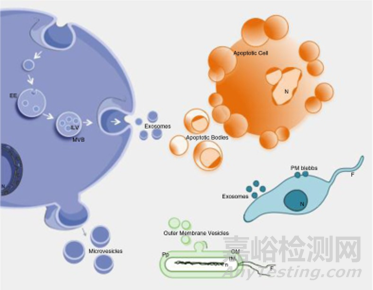
生物活性物質被安全有效的遞送到其相關靶位點是藥物開發中的關鍵一環���,納米顆粒是目前在基因和藥物傳遞領域的前沿技術之一��。迄今為止���,眾多載體中(脂質體���、脂質納米顆粒��、聚合物膠束、無機納米顆粒)最成功的遞送載體是脂質體,在市場上獲得臨床批準的數量最多。其中外泌體是細胞外囊泡(包括外泌體、微囊泡體和凋亡小體)的一種����,粒徑分布在30-200納米之間的脂質包裹體結構�,富含脂質��、核酸和蛋白等成分�����。
圖1:細胞外囊泡的生物發生和釋放
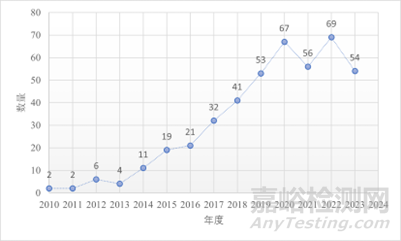
外泌體于1981被發現并命名,2013年諾貝爾生理與醫學獎頒發給了包括詹姆斯·羅思曼在內的3位科學家�����,以表彰他們發現細胞囊泡(外泌體等)運輸和調控機制�,近年外泌體相關研究進入爆發期����,完成了從細胞“塵埃”到現在的“新貴”的轉變。
圖2:PUBMED上搜索“細胞外囊泡或外泌體”關鍵詞出現的文章數量
1995年FDA批準Johnson的包載有鹽酸阿霉素脂質體抗腫瘤藥物Doxil上市,脂質體包載藥物后相比于游離藥物具有較長的半衰期和一定的被動靶向性����,顯示出巨大的臨床價值�。Doxil的上市開啟了脂質體治療疾病的先河����,迄今為止,FDA批準了10多款脂質體藥物上市���。
表1:FDA批準上市脂質體藥物
截至至今,尚未有細胞外囊泡/外泌體相關的上市藥物����,在臨床試驗數據庫(https://clinicaltrials.gov/)以細胞外囊泡或外泌體(Extracellular vesicles OR Exosome)為關鍵詞粗略進行搜索���,發現有447項研究�����,其中大部分與生物標志物識別和各種類型的癌癥診斷/預后有關,涉及外泌體作為遞送載體方向的研究則比較少。
圖3:臨床試驗數據庫研究數量
表2:外泌體作為遞送載體方向的研究
研究1(NCT05043181)為首次人體研究旨在評估基于外泌體的核酸納米平臺在純合子家族性高膽固醇血癥基因治療中的安全性和初步有效性���;研究2(NCT04879810)的研究者評估單獨的外泌體、姜黃素和外泌體加姜黃素聯合使用對難治性炎癥性腸病患者癥狀和疾病評分的影響,外泌體則是為了增加姜黃素的穩定性���、溶解度和生物利用度;研究3(NCT03608631)研究了間充質基質細胞衍生的KrasG12D siRNA(iExosomes)外泌體在治療KrasG12D突變已擴散到身體其他部位的胰腺癌參與者的最佳劑量和副作用;研究4(NCT01159288)為腫瘤抗原負載樹突狀細胞來源外泌體疫苗接種誘導化療不可切除非小細胞肺癌患者的臨床試驗。
圖4:游離藥物����,臨床批準的合成納米顆粒和細胞外囊泡的特征
外泌體的結構與脂質體較為相似,親水核心被兩親性脂質膜結構所包裹�����,其中臨床批準的脂質體在100 nm左右,與外泌體有較為相似之處����,這些為未來藥物的外泌體包載提供了可能性����。正是由于二者相似的結構����,人們不免會對二者進行類比與比較:脂質體類一般成分比較簡單明確,而外泌體含有核酸����、蛋白和脂質成分�;外泌體一般為細胞來源����,產能可能會受限,相比脂質體穩定性和安全性較好;外泌體可進行多種改造來進行裝載藥物��,如利用外泌體蛋白PTGFRN作為支架在外泌體表面展示具備完全活性的IL-12��。脂質體和外泌體兩者作為納米級遞送載體����,都存在肝臟脾臟的積累問題��,限制其靶位點的活性,脂質體的另一個問題是會引起急性超敏反應��,天然遞送載體可能是結局這些問題的良好方式��,目前少有文章對脂質體和外泌體進行直接對比�����。
介于細胞來源的外泌體有如上問題,出現了許多辦法:如紅細胞通過一定孔徑膜來制備外泌體類似物解決成分復雜問題���、通過大規模細胞培養結合過濾與切向流技術解決產能問題、通過細胞膜連接“CD47”來觸發“別吃我”信號來增加循環時間等��,當然也有研究嘗試通過提前施加空載外泌體藥物來躲避網狀系統的吞噬��,相關技術仍在不斷向前發展變化中����。
圖5:外泌體的載藥以及改造策略
脂質體載藥有主動和被動兩種方式的藥物裝載方法�。主動載藥法為空脂質體與藥物混合,藥物在磷脂相變過程中通過擴散進入脂質體(如載多柔比星根據硫酸銨梯度原理將藥物由外水相主動載到內水相)����,該方式載藥通常為弱酸/堿性藥物���。被動載藥為脂質體制備過程中將藥物混合在脂質組分中直接制備載藥脂質體����。外泌體脂質包裹的結構對外源藥物的包載提出了一定的挑戰性��,目前有被動和主動兩種方式的藥物裝載方法�����。被動載藥法:藥物分子與供體細胞或者提取完成的外泌體共孵育�����,借助藥物的濃度梯度差異完成藥物的裝載�。藥物分子與供體細胞共孵育的方式�,后續步驟仍然避免不了分離純化步驟來提取外泌體,而且藥物分子對細胞的毒性應該進行評估,但對于脂質體而言��,外泌體獨有的細胞內源裝載藥物可能是一個潛在的優勢�。被動載藥方式條件比較溫和,操縱比較簡單且一般不會對膜結構造成損傷,但是一般裝載效率比較低�,常用于疏水性藥物分子(如姜黃素)的裝載�����。相比于被動載藥法����,主動載藥法通過暫時破壞囊泡的膜結構來對藥物分子進行高效裝載����。常見的主動載藥方式有1)電穿孔:通過電場的施加來破壞膜結構使得藥物分子進入到膜內,該方法疏水性藥物分子的裝載效率較低��;2)凍融法:通過凍融循環(如液氮低溫冷凍-室溫復溶循環)來裝載藥物�,但應該注意到外泌體可能會存在聚集情況;3)透化劑孵育:通過添加透化劑來破壞膜結構來裝載藥物�,當然�����,透化劑如皂苷產生的溶血問題應該注意;4)擠出法:外泌體與藥物混合后通過一定孔徑的裝置�,在此過程中膜結構破壞而使得藥物裝載進外泌體����。主動載藥法免不了對囊泡的膜結構的破壞���,在此過程中外泌體膜結構恢復完整性的效率有待評估�,而且該方法由于裝載條件劇烈而不可避免出現外泌體聚集等問題的發生�。
圖6:外泌體的主動和被動載藥
脂質體低毒性源于其成分中磷脂和膽固醇為細胞膜成分,靶向成分的添加可以提高其向病灶的主動靶向性����,但是臨床效果未能實現�����。外泌體表面進行改性,如連接其他分子如CD47或治療性分子如神經元特異性狂犬病病毒糖蛋白(RVG)肽來達到增加循環時間或靶向性達到治療疾病的目的。上市脂質體包在的藥物均為分子量小于1000道爾頓的化合物,外泌體的載藥實驗從小分子如姜黃素到大分子如核酸、多肽等均有涉及。
納米粒子裝載藥物后的遞送有主動和被動的靶向策略:主動靶向涉及的是納米粒子在表面進行工程化改造來對感興趣位點進行優先結合���,而被動靶向則是利用納米粒子自身屬性如粒子大小來對感興趣位點進行遞送,比如腫瘤位點的EPR效應。
外泌體和脂質體有各自的優點和局限性����,如果將兩者進行雜交制造出新型納米遞送載體(利用脂質體可調節的脂質和蛋白質組成�����、成本低等和外泌體的天然靶向特性、低免疫原性等)會不會更好呢?這些方法確實已經啟動。
圖7:外泌體和脂質體的雜交融合
目前臨床評價的載體產品都涉及工程外泌體�����,目前沒有其他類型的“外泌體樣囊泡”在試驗中����。目前的研究中關于外泌體PD/PK信息有限,對于這部分信息的匱乏可能會嚴重限制其進入臨床研究中的進程���。細胞外囊泡(包括外泌體、微囊泡體和凋亡小體)中三個種群粒徑之間相互重疊��,特異性蛋白缺少共識而阻礙了它們在亞水平層面的表征而進一步限制其發展���。雖然科研工作者們正在嘗試使用外泌體的獨特性質來遞送各種生物藥物��,但外泌體包括本身成分以及生產過程的復雜性、粒徑異質性和尚未有明確的質控標準在內的諸多因素限制其基礎和轉化研究�。外泌體的使用已被臨床證實����,《細胞外囊泡治療定義的最低實驗要求》(Minimal information for studies of extracellular vesicles, misev)早在2014年提出���,但監管部門尚未有指南明確規定應在外泌體產品檔案中需要報告的數據��,何時實現這個目標仍然需要廣大科研人員的不懈努力�����。
全球以外泌體作為遞送載體的公司中最具代表性的為成立于2015年的Codiak,2020年該公司便將外泌體療法推進到了臨床實驗并上市納斯達克����。今年3月Codiak宣布破產保護�����,一位外泌體治療的先行者轟然倒下����。Codiak將外泌體療法推進到臨床階段���,而且其臨床效果比較顯眼�,如exoIL-12的效果很好,IL-12不僅成藥而且具有治愈淋巴瘤的效果�����。Codiak雖然倒下����,至少其證明了外泌體治療的潛在價值��,其后還有眾多追隨者前仆后繼���。
圖8:Codiak外泌體載藥管線分布
藥物的研發本就不是一帆風順的事情��,路途雖遠,行則將至���。
Reference
1. Yáñez-Mó, María et al. “Biological properties of extracellular vesicles and their physiological functions.” Journal of extracellular vesicles vol. 4 27066. 14 May. 2015, doi:10.3402/jev.v4.27066
2. Witwer, Kenneth W, and Joy Wolfram. “Extracellular vesicles versus synthetic nanoparticles for drug delivery.” Nature reviews. Materials vol. 6,2 (2021): 103-106. doi:10.1038/s41578-020-00277-6
3. Butreddy, Arun et al. “Exosomes as Naturally Occurring Vehicles for Delivery of Biopharmaceuticals: Insights from Drug Delivery to Clinical Perspectives.” Nanomaterials (Basel, Switzerland) vol. 11,6 1481. 3 Jun. 2021, doi:10.3390/nano11061481
4. Ducrot, Coline et al. “Hybrid extracellular vesicles for drug delivery.” Cancer letters vol. 558 (2023): 216107. doi:10.1016/j.canlet.2023.216107
5. Armstrong, James P K et al. “Re-Engineering Extracellular Vesicles as Smart Nanoscale Therapeutics.” ACS nano vol. 11,1 (2017): 69-83. doi:10.1021/acsnano.6b07607
6. https://www.codiakbio.com/pipeline-programs/pipeline