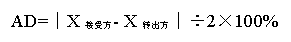對于技術轉移���,分析界的筒子們應該并不陌生��,提到技術轉移��,我們首先想到的是“技術轉移都需要轉移什么?什么時間進行轉移?轉移的目的是什么?如何進行轉移����?”等問題����。對于這些問題����,下面的表格進行了簡單的介紹。今天����,我們著重分享的是分析方法的轉移。
對于分析方法的轉移����,2020版《中國藥典四部》和2019年版《中國藥品檢驗標準操作規范》中都有介紹��。分析方法的轉移分為:分析方法轉移類型、分析方法轉移要素���、分析方法轉移方案、分析方法轉移方法��、分析方法轉移報告五個部分�����。流程圖如下:
分析方法轉移類型主要有一下幾種方式:
一���、對比試驗
比對試驗是分析方法轉移時最常用的方法���,需要接收方和轉移方共同對預先確定數量的同一批次或多批次樣品進行對比檢驗����,然后對比檢驗結果。對比試驗中需要考慮的因素主要包括:被測樣品的數量��、批次(2~5批)����;被測樣品的濃度級別(1~3個濃度);重復測定的次數(4~6次)��;被分析物個數(1~2個)�����;分析時間(2~5天);來自一個或多個實驗室的分析儀器(兩個實驗室使用相同的儀器)等�����。以上參數均可根據風險評估的結果(如下圖)進行適當的調整�����。
由于不同實驗室�,使用的儀器設備不同����、人員操作水平不一,故對比檢測雖為分析方法轉移最常用的方法�,但轉移失敗的幾率也相對較大����,且失敗原因比較難識別���。
例:在某某腸溶片項目溶出度方法的轉移��,因主成分溶解度限制����,對照品溶液需用pH1.0鹽酸溶液配制����,高效液相色譜儀檢測時,轉出方實驗室大量試驗數據均未出現異常,但在接收方實驗室檢測時出現5針對照品溶液主峰峰面積波動,RSD%值不合格����,且發生頻率較多���,對色譜柱、流動相以及樣品配制均進行了調查��,均未發現異常�,最終導致轉移失敗。導致失敗的最終原因是��,不同實驗室檢測儀器不同��,相同型號儀器使用年限不同�����,機器部件老化程度不同,對酸性溶液的耐受力也不同,故最終修改了對照品溶液的配制溶劑����,重新進行轉移�����。
二、兩個或多個實驗室共同驗證
眾所周知�,分析方法在轉移之前必然要經過方法學驗證�,為降低對比試驗檢測數據的偶然性,并縮減方法轉移的時間,我們可以采用兩個實驗室共同驗證的方法來進行方法學轉移���,在這種情況下,轉出實驗室的試驗人員需要參與接收實驗室的內部試驗來獲取重現性數據并評估不同實驗室之間的差異,最終通過統計學方法來評估轉移是否成功,但是在轉移過程中,轉出方和接收方應盡量使用相同或等同的檢驗設備(如高效液相色譜儀�、色譜柱等)��。
例:某項目在有關物質分析方法轉移時發現各雜質對照品得量較少,只夠方法學驗證使用,而采購周期過長�,故雙方進行共同驗證方法���,在方法學驗證的同時���,QC實驗室通過重現性來實現分析方法的轉移����。
7.4.2重現性試驗
7.4.2.1可接受標準
重現6次測定結果的RSD應≤2.0%����,重復性與重現性12次測定結果的RSD應≤2.0%���。
7.4.2.2操作過程
QC實驗室�����、QC檢驗人員采用QC實驗室儀器���,相同品牌不同編號色譜柱����,于不同日期重新配制對照品溶液及供試品溶液����,與重復性試驗采用同一批樣品檢測。
7.4.2.3進樣要求
三�����、通過分析方法再驗證來進行方法轉移
通過分析方法再驗證的方式進行方法轉移�����,是指接受實驗室重復部分或者全部的方法學驗證的內容�����,如果驗證過程順利通過并符合接受標準����,那證明該實驗室有操作該分析方法的能力,即該分析方法轉移成功��。但此方法操作較為復雜�����,可能會影響實驗進度���,故此種分析方法轉移的方式一般不會被使用����。
四����、通過免除試驗進行方法轉移
免除試驗的轉移方法是一種不需要或者減少對比實驗項目的方式進行的分析方法轉移方式。接受實驗室可直接采用該方法進行正式的檢測�,但前提是確保此方法有效可靠����,并一定要有記錄并說明原因�。以下幾種情況可通過免除試驗來進行轉移:
① 新的待測定樣品的組成與已有樣品的組成類似和/或活性組分的濃度與已有樣品的濃度類似,并且接收方有使用該分析方法的經驗。
② 被轉移的分析方法與已使用方法相同或相似�����。
③被轉移的分析方法收載在藥典中,并無改變��,此時應采用分析方法確認(一般以輔料為主)��。
④轉移方負責方法開發、驗證或日常分析的人員調轉到接收方���。
⑤接收實驗室對別的分析方法驗證或者轉移時已包含此分析方法。
以上就是分析方法轉移的幾種方式����,接下來我們講述以下分析方法轉移的接受標準和結果評估��,在2019年版《中國藥品檢驗標準操作規范》中也有具體要求,如下圖:
分析方法轉移的接受標準可通過雙方檢驗結果的RSD%(相對標準偏差n=6)���、AD%(絕對偏差n=3)等來評估。

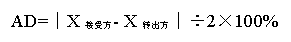
當然檢測樣品的濃度不同��,可接受標準的RSD%或AD%值也是不同的�。我們應根據自己項目或者具體分析方法來制定相應的可接受標準。
參考文獻:
[1]《中國藥典》2020年版-分析方法轉移指導原則
[2]《中國藥品檢驗操作規范》2019年版-異常檢驗結果調查指導原則