抗體藥物偶聯(lián)物(antibody-drug conjugates,ADC)是一類由單克隆抗體和小分子細(xì)胞毒性藥物通過連接子偶聯(lián)而成的新型生物治療藥物 。與傳統(tǒng)的細(xì)胞毒藥物相比,ADC具有靶向性強(qiáng),毒副作用小等優(yōu)勢,在臨床上展現(xiàn)較好的治療潛力。其中,抗體部分通過與腫瘤細(xì)胞表面的靶向抗原結(jié)合,精準(zhǔn)地將小分子細(xì)胞毒性藥物遞送至腫瘤部位,從而實(shí)現(xiàn)腫瘤特異性殺傷效果。ADC藥物結(jié)合了高特異性靶向能力和強(qiáng)效殺傷作用的優(yōu)勢,實(shí)現(xiàn)了對(duì)癌細(xì)胞的精準(zhǔn)高效殺滅,已成為抗癌藥物研發(fā)的熱點(diǎn)之一。
ADC
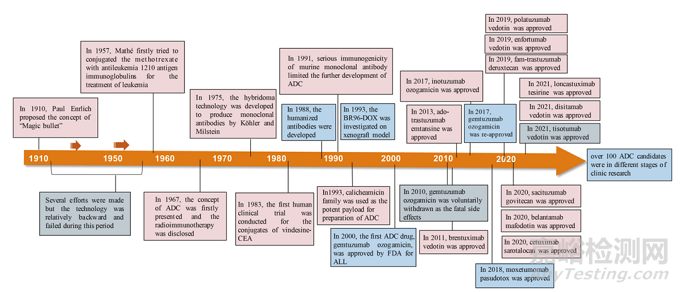
早在 20 世紀(jì)初,Paul Ehrlich 就首先提出了“魔法子彈”的概念,并假設(shè)某些化合物可以直接進(jìn)入細(xì)胞中某些所需的靶點(diǎn),從而治愈疾病。從理論上講,這些化合物應(yīng)該能有效殺死癌細(xì)胞,但對(duì)正常細(xì)胞無害。2000年,美國食品藥品監(jiān)督管理局(FDA)首次批準(zhǔn)ADC藥物Mylotarg® (gemtuzumab ozogamicin)用于成人急性髓系白血病(AML),標(biāo)志著ADC靶向治療癌癥時(shí)代的開始。圖1描繪了過去百年ADC藥物從嬰兒階段到成熟發(fā)展階段的標(biāo)志性事件。隨著靶點(diǎn)和適應(yīng)癥的不斷擴(kuò)大,ADC正在引領(lǐng)癌癥靶向治療的新時(shí)代,未來有望替代傳統(tǒng)化療藥物。
圖1 一個(gè)世紀(jì)ADC藥物開發(fā)和批準(zhǔn)的重要事件的時(shí)間表
1、 ADC藥物的構(gòu)成
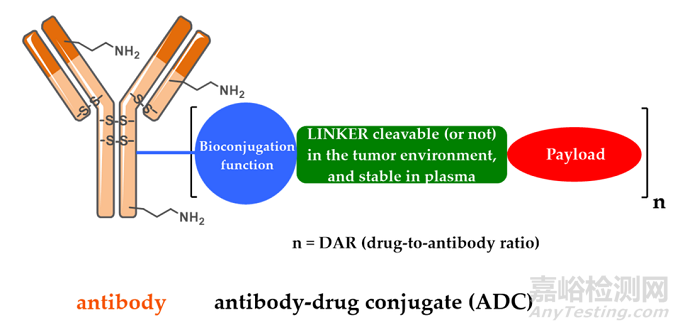
ADC由抗體、有效載荷和化學(xué)接頭組成。理想的 ADC 藥物在血液循環(huán)中保持穩(wěn)定,精準(zhǔn)到達(dá)治療目標(biāo),并最終在目標(biāo)附近(例如癌細(xì)胞)釋放細(xì)胞毒性有效載荷。每個(gè)要素都會(huì)影響 ADC 的最終療效和安全性,總體而言,ADC 開發(fā)需要考慮所有這些關(guān)鍵組成部分,包括靶點(diǎn)、抗體、細(xì)胞毒有效載荷、接頭以及偶聯(lián)方法的選擇。
圖2 ADC藥物的結(jié)構(gòu)和特性
2、ADC的作用機(jī)制
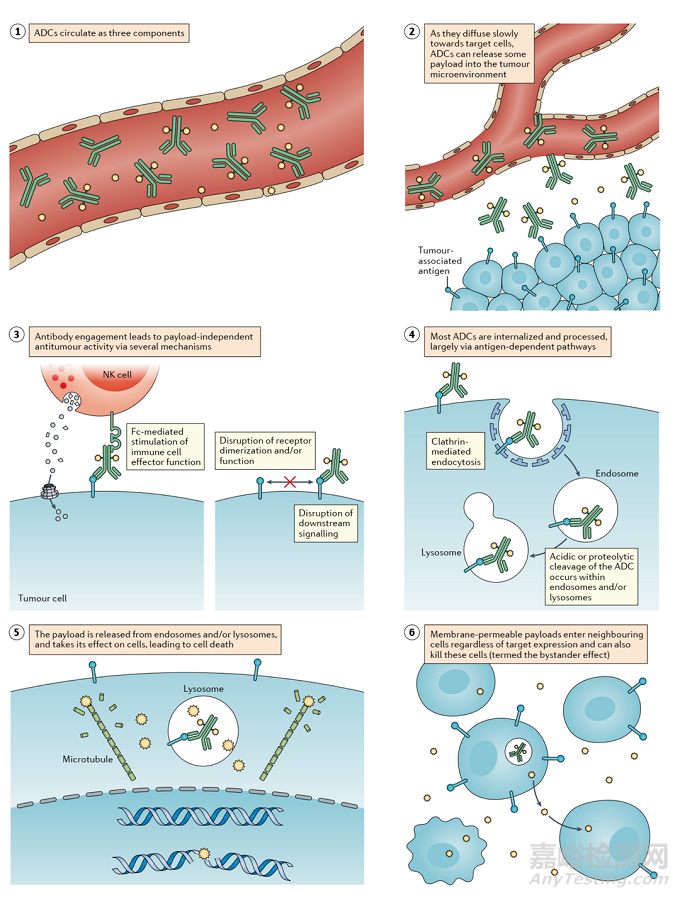
ADC通過組合發(fā)揮“特異性”靶向作用和“高效”殺傷癌細(xì)胞的作用。這類藥物就像精準(zhǔn)制導(dǎo)的“生物導(dǎo)彈”,能夠精準(zhǔn)摧毀癌細(xì)胞,提高治療窗口,減少脫靶副作用。
圖 3 ADC殺死癌細(xì)胞的作用機(jī)制
ADC的抗癌活性還涉及ADCC、ADCP和CDC的作用。一些 ADC 的抗體 Fab 片段可以結(jié)合病毒感染細(xì)胞或腫瘤細(xì)胞的抗原表位,而 FC 片段結(jié)合殺傷細(xì)胞(NK 細(xì)胞、巨噬細(xì)胞等)表面的 FCR,從而介導(dǎo)直接殺傷效果。此外,ADC的抗體成分可以特異性結(jié)合癌細(xì)胞的表位抗原,抑制抗原受體的下游信號(hào)轉(zhuǎn)導(dǎo)。
3、ADC的研究進(jìn)展
從藥物組成和技術(shù)特點(diǎn)來看,ADC藥物可細(xì)分為三代。早期ADC主要由常規(guī)化療藥物通過不可切割的接頭與小鼠來源的抗體偶聯(lián)而成。這些 ADC 的效力并不優(yōu)于游離的細(xì)胞毒性藥物,并且具有很強(qiáng)的免疫原性。后來,更有效的細(xì)胞毒劑與人源化 mAb 的組合使用極大地提高了療效和安全性,因此第一代 ADCs 獲得了市場批準(zhǔn)(包括 gemtuzumabozogamicin 和 inotuzumab ozogamicin)。
以Brentuximabvedotin 和 Ado-trastuzumab emtansine為代表的第二代 ADC 在優(yōu)化 mAb 同種型、有效載荷以及l(fā)inker后獲批。這兩種 ADC 使用IgG1 同種型 mAb,更適合具有小分子有效載荷和高癌細(xì)胞靶向能力的生物偶聯(lián)。毒性更高的有效載荷,提高了水溶性和偶聯(lián)效率。可以將更多有效負(fù)載分子加載到每個(gè) mAb 上,而不會(huì)誘導(dǎo)抗體聚集。Linker的改進(jìn)實(shí)現(xiàn)了更好的血漿穩(wěn)定性和均勻的 DAR 分布。總體而言,這三個(gè)要素的改進(jìn)提高了第二代 ADC 的臨床療效和安全性。
第三代 ADC 以 polatuzumabvedotin、enfortumab vedotin、fam-trastuzumab deruxtecan為代表。他們具有1)均一 的DAR(2 或 4),顯示出更少的脫靶毒性和更好的藥代動(dòng)力學(xué)效率;2)完全人源化抗體而不是嵌合抗體來降低免疫原性。此外,正在開發(fā)抗原結(jié)合片段 (Fab) 以替代許多候選 ADC 中的完整 mAb,因?yàn)?Fab 在體循環(huán)中更穩(wěn)定,并且可能更容易被癌細(xì)胞內(nèi)化。此外,已經(jīng)開發(fā)出更有效的有效載荷:如 PBD、微管溶素和具有新機(jī)制的免疫調(diào)節(jié)劑。總的來說,第三代 ADC 具有更低的毒性和更高的抗癌活性以及更高的穩(wěn)定性,使患者能夠接受更好的抗癌治療。
4、當(dāng)前的挑戰(zhàn)及下一代ADC
從已批準(zhǔn)藥物和開發(fā)中的候選藥物可以看出,新一代 ADC 的特異性和細(xì)胞毒性比前幾代產(chǎn)品越來越好。然而,在開發(fā)ADC 的過程中仍然存在許多挑戰(zhàn), 如復(fù)雜的藥代動(dòng)力學(xué)特征,不可避免的副作用,腫瘤靶向和有效載荷釋放及耐藥性。
下一代ADC
1、雙表位或雙靶點(diǎn)ADC
雙特異性抗體技術(shù)的進(jìn)步為ADC創(chuàng)新帶來了更多可能。與單抗藥物不同,雙特異性抗體(雙抗)可以同時(shí)識(shí)別一個(gè)靶點(diǎn)的兩個(gè)表位或是兩個(gè)不同的靶點(diǎn),進(jìn)而通過多種不同的分子機(jī)制產(chǎn)生更好的療效。雙特異性抗體的臨床治療效果優(yōu)于單克隆抗體(monoclonal antibody, MoAbs),廣泛應(yīng)用于腫瘤免疫治療和其他疾病的治療。結(jié)合了雙抗和ADC優(yōu)勢的雙抗ADC藥物,或?qū)⒊蔀橐环N新的解決ADC藥物現(xiàn)有的內(nèi)吞、毒性和耐藥問題的有效方案。
雙抗ADC藥物,是在單抗ADC優(yōu)勢之上再升級(jí)的一種嶄新形式:一方面通過雙抗更加特異性地靶向腫瘤細(xì)胞,增加藥物的安全性;另一方面通過交聯(lián)作用促進(jìn)兩個(gè)靶點(diǎn)的協(xié)同內(nèi)吞,在提高毒素進(jìn)入腫瘤細(xì)胞效率的同時(shí),進(jìn)一步通過減少受體蛋白在細(xì)胞膜上的表達(dá)量來抑制腫瘤細(xì)胞生長信號(hào),達(dá)到更好的治療效果。
圖4.靶向雙TAA靶點(diǎn)的雙抗ADC作用機(jī)制
下表整理了目前已知的一些雙抗ADC項(xiàng)目:
其中,ZW-49是由Zymeworks開發(fā)的雙特異性抗體ADC藥物,可同時(shí)特異性結(jié)合HER2受體的兩個(gè)非重疊表位(ECD4/trastuzumab和ECD2/pertuzumab),該雙特異抗體ADC是在ZW25的基礎(chǔ)上通過蛋白酶切割鏈接子偶聯(lián)Auristatin毒素A。在臨床前的NHP動(dòng)物模型中,該雙抗ADC的最高耐受劑量到達(dá)18mg/kg。因?yàn)樵撍幬锸窃陔p特異抗體ZW25上的改造,因此具有ZW25的多種優(yōu)點(diǎn),如有效地在細(xì)胞表面聚集HER2受體并增強(qiáng)HER2內(nèi)化和下調(diào)等。在臨床前動(dòng)物模型中,ZW-49可以有效的殺傷HER2中表達(dá)和高表達(dá)的腫瘤,與陽性對(duì)照藥物相比,其更能顯著的延長動(dòng)物的生存時(shí)間及生存幾率。
圖5. ZW49雙表位ADC結(jié)構(gòu)
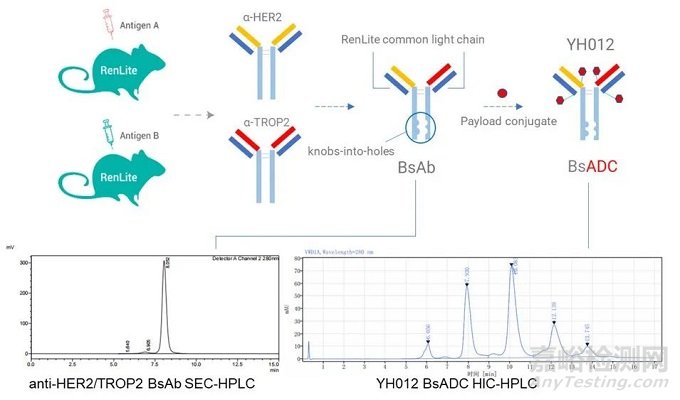
YH012是百奧賽圖利用其RenLite®雙特異抗體平臺(tái)上構(gòu)建的雙靶點(diǎn)ADC(HER2×TROP2),RenLite®利用共同輕鏈的方法防止雙特異抗體輕鏈的錯(cuò)配,同時(shí)采用Knob-In-Hole防止抗體重鏈錯(cuò)配,可以實(shí)現(xiàn)高純度雙特異抗體的生產(chǎn)。在此基礎(chǔ)上,其利用鏈間半胱氨酸進(jìn)行偶聯(lián),linker為可裂解的二肽VC(valine-citrulline),毒素為MMAE。在NCI-N87腫瘤細(xì)胞中,靶向Her2/TROP2的雙抗ADC YH012可以被腫瘤細(xì)胞快速內(nèi)化,并且其內(nèi)化效率優(yōu)于單靶點(diǎn)的對(duì)照ADC藥物。在體內(nèi)模型中,雙抗ADC YH012可以有效的抑制腫瘤細(xì)胞的生長,在療效上優(yōu)于偶聯(lián)相同毒素的單克隆抗體,而且優(yōu)于更高劑量的雙抗裸抗。
圖6. YH012雙靶點(diǎn)ADC結(jié)構(gòu)
雙抗ADC作為一個(gè)新的概念,目前還處在早期臨床驗(yàn)證階段,仍需要進(jìn)一步驗(yàn)證療效與安全性,但從藥物研發(fā)的原理以及臨床前的數(shù)據(jù)來看,這一類藥物未來的前景仍然值得期待。
2、使用兩種不同的有效載荷組合
使用兩種不同的細(xì)胞毒劑作為有效載荷的雙有效載荷 ADC 以降低耐藥性。通過準(zhǔn)確控制兩種藥物的比例,將兩種協(xié)同有效載荷遞送到癌細(xì)胞中,可以實(shí)現(xiàn)更有效的療效。并且隨著兩種不同機(jī)制的有效載荷的應(yīng)用,耐藥性的發(fā)生率將顯著降低。例如,設(shè)計(jì)了一種同時(shí)包含 MMAE 和 MMAF 的均一的抗 HER2 ADC,并在異種移植小鼠模型中發(fā)揮了比共同只用相應(yīng)的單有效載荷 ADC 更顯著的抗腫瘤活性。
圖7. 雙藥adc的分子設(shè)計(jì)和偶聯(lián)策略
3、多肽偶聯(lián)物(PDC)
另一種ADC發(fā)展策略是摒棄mAb的傳統(tǒng)結(jié)構(gòu),選擇將payload與分子量較小的多肽片段偶聯(lián)。這些策略的主要目的是降低 ADC 的分子量,從而提高穿透效率和有效載荷向腫瘤組織的傳遞。例如,PEN-221是一種 ADC,由 DM-1 與靶向生長抑素受體 2 的多肽鏈結(jié)合而成。其分子量僅為 2 kDa,遠(yuǎn)低于傳統(tǒng) ADC 中 150 kDa 的 IgG 分子。目前此類 ADC 面臨的技術(shù)挑戰(zhàn)是它們可能會(huì)在血漿中快速清除。然而,如果我們能夠克服這一障礙,它在治療難以接近的腫瘤方面具有潛力,包括血管神經(jīng)支配不良的腫瘤和中樞神經(jīng)系統(tǒng)腫瘤。
圖8. PEN-221微型藥物結(jié)合物
4、開發(fā)非內(nèi)化
ADC 傳統(tǒng)上,為了將有效載荷輸送到癌細(xì)胞中,ADC 需要高內(nèi)化能力的 mAb。然而,由于抗原屏障,mAb 通常難以擴(kuò)散到實(shí)體瘤塊中。因此,可以為 ADC 開發(fā)非內(nèi)化抗體。它是基于有效載荷在腫瘤微環(huán)境中在還原條件下直接釋放到細(xì)胞外,然后擴(kuò)散到癌細(xì)胞內(nèi)部導(dǎo)致細(xì)胞死亡的原理。最后,在有效載荷選擇方面仍有很多創(chuàng)新機(jī)會(huì)。
總結(jié)
目前已成功開發(fā)出多種 ADC 療法,使數(shù)以萬計(jì)的癌癥患者受益。14 種上市的ADC藥物以及多種 ADC優(yōu)異的臨床表現(xiàn)也引起了人們對(duì)該領(lǐng)域的更多關(guān)注,這對(duì)于這個(gè)相對(duì)年輕但高度復(fù)雜的領(lǐng)域來說非常重要。隨著這些領(lǐng)域研究人員的不斷努力,不難想象未來的ADC將在癌癥靶向治療中展現(xiàn)出更多的驚喜。
參考資料:
[1] [1] Fu Z , Li S , Han S , et al. Antibody drug conjugate:the"biological missile"for targeted cancer therapy[J]. 信號(hào)轉(zhuǎn)導(dǎo)與靶向治療(英文), 2022, 7(4):25.
[2] Drago J Z , Modi S , Chandarlapaty S . Unlocking the potential of antibody-drug conjugates for cancer therapy[J]. Nature reviews. Clinical oncology.
[3] Hamilton G S. Antibody-drug conjugates for cancer therapy: The technological and regulatory challenges of developing drug-biologic hybrids[J]. Biologicals, 2015, 43(5):318-332.
[4] You G, Won J, Lee Y, et al. Bispecific Antibodies: A Smart Arsenal for Cancer Immunotherapies.[J]. Multidisciplinary Digital Publishing Institute, 2021(7).
[5] Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates. [J]. Nature Reviews Drug Discovery, 2017, 16(5):315-337.
[6] Tarantino P, Pestana R C, Corti C , et al. Antibody-drug conjugates: Smart chemotherapy delivery across tumor histologies[J]. CA: a cancer journal for clinicians.