前言:藥物警戒風險管理中的風險分為已識別風險和潛在風險,本文從個人的理解角度對藥物警戒風險管理過程中的風險識別、風險評估、風險溝通的方法,粗略表達一些自己的見解。
一、目的
制定藥物警戒風險管理規程,通過對藥品的風險進行有效管理,對藥品風險進行識別與分析,最大限度地降低藥品安全風險,保護和促進公眾健康。
二、依據
《藥品管理法》(2019年)
《藥物警戒質量管理規范》(2021年第65號公告)
三、適用范圍
適用于藥物警戒系統中的藥品風險管理。
四、職責
1、 藥物警戒部負責本規程的建立。
2、 藥物警戒部及各相關部門負責本規程的實施。
五、內容
1、定義
1.1 風險:危害發生的可能性及其嚴重程度。
1.2 風險分析:和被確定的危害源有關的風險的分析。
1.3風險評價:用定性或定量的方法,將被評估的風險與既定的風險標準進行比較,以確定風險的顯著性。
1.4 風險控制:實施風險管理決策的行為。
1.5風險降低:采取措施減少危害發生的可能性和嚴重程度。
2、風險管理的目的
按照一個完整有效的風險管理流程,使風險發生的可能性和危害降低到可接受的程度或者提高風險發生的可預測性。
3、風險管理采取PDCA原則:PDCA原則(P計劃、D實施、C檢查、A總結)。
4、風險管理流程
風險管理流程分為五個部分:風險評估、風險控制、風險溝通、風險評審和風險回顧。
4.1 確定事件并啟動風險管理流程:由藥物警戒負責人及藥物警戒專員與風險相關的部門,收集與所評估的風險相關的可能性危險、危害或對人體健康影響的有關背景資料和數據。
4.2 風險評估:包括風險識別、風險分析和風險評估。
4.2.1 風險識別:成立風險管理小組,對收集到的不良反應信息(報告)進行分析、識別。判斷其是否有效,有效的報告應包括以下四個元素(簡稱四要素):可識別的患者、可識別的報告者、懷疑藥品、不良反應。如果四要素不全,視為無效報告。
4.2.2 風險分析:對已確認有效的不良反應信息(報告)的風險,從預期(非預期)、嚴重(非嚴重)、藥品與不良反應的關聯性(因果關系)三方面進行分析。
(1)預期(非預期)
預期:說明書不良反應一項中對此種藥品不良反應已經有記載
非預期:說明書不良反應一項中對此種藥品不良反應沒有記載;藥品不良反應的性質/嚴重程度/特性結果與說明書中所描述的不同
(2)嚴重(非嚴重)
一般:沒有給患者造成嚴重的損害,不良事件很快得到改善,也未造成其他醫學事件。
嚴重:導致死亡、危及生命;先天性異常或出生缺陷;導致顯著的或者永久的殘疾或者器官功能的喪失;導致住院或者住院時間延長;導致其他重要醫學事件,如不進行治療可能出現上述所列情況。
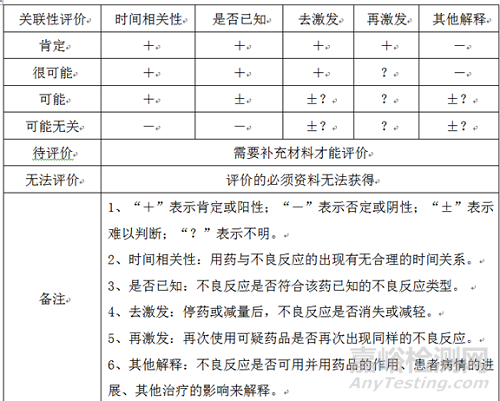
(3)關聯性
關聯性分為肯定、很可能、可能、可能無關、待評價、無法評價,分析方法如下圖:
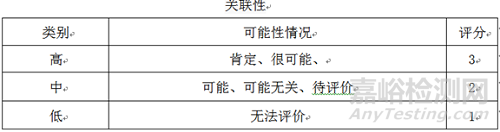
4.2.3 風險評估:根據預先確定的風險標準對已經確認并分析的風險進行評價,確認風險發生的關聯性,風險發生的嚴重性,風險發生的預期性,三項的乘積為風險等級評估的依據,對風險進行排序,確定風險等級。
4.2.4 風險優先數(RPN)
風險優先數(RPN)=嚴重性(S)×關聯性(O)×預期性(D)
4.3 風險控制
對于已識別的安全風險,藥品上市持有人應當綜合考慮藥品風險特征、藥品的可替代性、社會經濟因素等,采取適宜的風險控制措施。
風險控制措施分為常規風險控制措施、特殊風險控制措施、緊急控制措施:
常規風險控制措施:修訂藥品說明書、標簽、包裝,改變藥品包裝規格,改變藥品管理狀態;
特殊風險控制措施:開展醫務人員和患者的溝通和教育、藥品使用環節的限制、患者登記;
緊急控制措施:暫停藥品生產、銷售及召回產品。
4.4 風險溝通
4.4.1 持有人應當向醫務人員、患者、公眾傳遞藥品安全性信息,溝通藥品風險。
4.4.2 持有人應當根據不同的溝通目的,采用不同的風險溝通方式和渠道,制定有針對性的溝通內容,確保溝通及時、準確、有效。
4.4.3 溝通方式包括發送致醫務人員的函、患者安全用藥提示以及發布公告、召開發布會等。
(1)致醫務人員的函可通過正式信函發送至醫務人員,或可通過相關醫療機構、藥品生產企業、藥品經營企業或行業協會發送,必要時可同時通過醫藥學專業期刊或報紙、具有互聯網醫藥服務資質的網站等專業媒體發布。
(2)患者安全用藥提示可隨藥品發送至患者,或通過大眾媒體進行發布,其內容應當簡潔、清晰、通俗易懂。
4.4.4 溝通工作應當符合相關法律法規要求,不得包含任何廣告或產品推廣性質的內容。一般情況下,溝通內容應當基于當前獲批的信息。
4.4.5 出現下列情況的,應當緊急開展溝通工作
(1)藥品存在需要緊急告知醫務人員和患者的安全風險,但正在流通的產品不能及時更新說明書的;
(2)存在無法通過修訂說明書糾正的不合理用藥行為,且可能導致嚴重后果的;
其他可能對患者或公眾健康造成重大影響的情況。
4.5 風險評審
4.5.1藥物警戒專員對評估結果與糾正措施進行審核,確認風險分析與評估正確,采取措施與風險水平相適應,實施風險降低措施過程中,是否有可能將新的風險引入系統,或增加了其他風險發生的可能。
4.5.2 藥物警戒專員對評估結果與糾正措施審核后須有藥物警戒負責人批準。否則,應重新進行風險分析評估,并采取控制措施。
4.6 風險回顧
風險管理是持續性的質量管理過程,需要對風險進行回顧。措施實施后,通過一段時間的運行,需重新進行風險評估,以確認和評價風險是否發生新變化,行動計劃是否有效,風險是否已被正確管理。