單克隆抗體藥物在上市批準之前要經過廣泛的穩定性研究,以考察環境因素(包括溫度、濕度、光照和氧化等)隨時間變化如何影響產品的質量。其中的使用中穩定性研究是確保藥物安全性和有效性的重要組成部分[1-2]。使用中穩定性研究是指為保證藥物制劑在一定使用期間內的穩定而進行的試驗[3]。不同的監管機構均對使用中穩定性研究作出要求,其中人用藥品注冊技術國際協調會議(International Conference on Harmonization,ICH)Q1A(R2)指出,必要時,對配制或稀釋后使用的制劑應進行穩定性試驗,可為標簽上的配制、貯藏條件和配制或稀釋后的使用期限提供依據。申報批次應在配制和稀釋后的初始和建議的使用期末進行穩定性試驗,作為正式穩定性試驗的一部分[4]。世界衛生組織(World Health Organization,WHO)于2018年更新的《原料藥及藥品的穩定性測試》[5]要求藥物使用中穩定性需要盡可能地模擬實際使用的過程,進行藥品使用期間物理、化學、微生物特性等項目的檢測;試驗至少要2批中試規模樣品,并建議其中至少1批在長期穩定性試驗的貨架期末進行試驗。《中華人民共和國藥典》(以下簡稱《中國藥典》)2020年版[6]9402“生物制品穩定性試驗指導原則”也指出“其他對于需要復溶、稀釋的產品,應根據具體情況對使用過程中涉及的條件設計相應的穩定性試驗。”
腫瘤免疫靶向治療作為一種新型的治療手段,改變了晚期惡性腫瘤的臨床治療方式,也極大地扭轉了依賴放療、化療和手術等癌癥治療手段的現狀。截至2022年3月,我國已批準上市10余種PD-1/PD-L1抗體藥物,適應癥包括黑色素瘤、尿路上皮癌、霍奇金淋巴瘤、肝細胞癌、非小細胞肺癌等多種腫瘤疾病[7-11]。本次研究用的藥品為已上市的其中一種國產PD-1抗體藥物,本品首次上市申報時采用了代表性時間點的樣品進行使用中穩定性試驗,為了更加全面評價本品的使用中穩定性開展此研究。
一、 材料與方法
1.1 樣品
重組人源化抗PD-1單克隆抗體參比品及效期末樣品均為本實驗室留樣。
1.2 研究方案
參考本品說明書中描述“靜脈輸注時配制成最終濃度為1 mg·mL-1至3 mg·mL-1的輸注液;無菌操作下配制的輸注液,室溫下放置不超過6小時,在2~8 ℃下保存時間不超過24小時”,并模擬臨床實際給藥的情況,制備低濃度(1.0mg·mL-1)和高濃度(5.0 mg·mL-1)樣品,考察在2~8 ℃和室溫(25 ℃)條件下放置一定時間,以及經一次性使用無菌注射器輸注后產品質量的變化。
1.2.1 低劑量/高劑量使用中穩定性樣品的制備
1)從100 mL 0.9%氯化鈉注射液袋中抽取出相應體積的0.9%氯化鈉注射液;將相應體積的抗PD-1單克隆抗體注射液注入注射液袋中,輕輕混勻樣品并避免產生氣泡,制備低濃度和高濃度樣品,各取樣10 mL作為0 h樣品。
2)低濃度和高濃度樣品在5 ℃條件下分別放置6、24 h制備5 ℃-6 h、5 ℃-24 h樣品,再將5 ℃-24 h樣品放置于室溫(25±2)℃條件下6 h,作為5 ℃-24 h-25 ℃-6 h樣品。將5 ℃-24 h-25 ℃-6 h條件樣品連接輸液器,重力輸注至結束并收集流出液,混勻后作為5 ℃-24 h-25 ℃-6 h輸注樣品(取樣方案1)。
3)低濃度和高濃度樣品,同時在室溫(25±2)℃光照環境條件下放置3、6 h作為25 ℃-3 h、25 ℃-6 h樣品;將25 ℃-6 h條件樣品連接輸液器,重力輸注至結束并收集流出液,混勻后作為25 ℃-6 h輸注樣品(取樣方案2)。
1.2.2 評價指標
對模擬臨床使用過程中不同取樣點的低濃度和高濃度樣品進行不溶性微粒和可見異物檢查,對蛋白質濃度、分子排阻高效液相色譜、配體競爭抑制活性、生物學活性進行檢測分析(表1)。
1.3 細胞
表達PD-L1的CHO-K1細胞系(CHO-K1/PDL1)、轉染PD-L1與膜型抗CD3單鏈抗體的CHO細胞系(CHO/PD-L1-CD3L)、穩定轉染PD-1與NFAT反應元件控制下的熒光素酶基因的Jurkat 細胞系(Jurkat/PD-1-NFAT)由中國食品藥品檢定研究院單克隆抗體產品室保存、傳代。
1.4 試劑材料
TSK G3000SWXL 色譜柱(300 mm×7.8 mm,5μm)購自Tosoh 公司;胰蛋白酶購自Gibco公司;Biotin-PD-L1-Fc、PD-1抗原、辣根過氧化物酶標記鏈霉親和素為中國食品藥品檢定研究院單克隆抗體產品室留存。潮霉素B購自Roche公司,遺傳霉素購自Gibco公司;RPMI1640、F12培養基、PBS、NEAA均購自Gibco公司;ONE-Glo™熒光素酶檢測試劑盒購自Promega公司;96孔板(白板)、96孔板(透明板)購自Costar公司;十二水合磷酸氫二鈉、二水合磷酸二氫鈉、無水硫酸鈉購自國藥集團化學試劑有限公司;一次性精密過濾輸液器(0.2μm,PES filter)購自山東新華安得醫療用品有限公司,10、20 mL一次性使用無菌注射器購自碧迪醫療器械(上海)有限公司,0.9%氯化鈉注射液購自上海百特醫療用品有限公司。
1.5 主要儀器
高效液相色譜儀配有紫外檢測器及Empower數據處理系統(Waters公司);SPECTRAM5酶標儀(Molecular Device公司);紫外分光光度計;CO2培養箱;生物安全柜;細胞計數儀。
1.6 方法
1.6.1 不溶性微粒和可見異物檢查
不溶性微粒采用光阻法分析,按2020年版《中國藥典》通則0903檢測并報告≥10 μm、≥25 μm的微粒數;可見異物按2020年版《中國藥典》通則0904檢查。
1.6.2 蛋白質濃度
采用紫外-可見分光光度法對樣品蛋白含量進行檢測,用樣品稀釋液將供試品稀釋至約0.4mg·mL-1,檢測280 nm處吸收度A,根據公式計算蛋白質濃度C(mg·mL-1),C=A/ε×DF,式中,ε為消光系數(1.42),DF為稀釋倍數。
1.6.3 分子排阻高效液相色譜
用超純水將檢測樣品稀釋至2.0 mg·mL-1,采用Waters 2695 HPLC系統、2489紫外檢測器、TSK G3000SWXL色譜柱進行檢測。流動相:50mmol·L-1磷酸鹽緩沖液(NaH2PO4-Na2HPO4),300 mmol·L-1硫酸鈉溶液,pH 7.0±0.2;流速:0.5 mL·min-1;上樣量:25μL(2.0 mg·mL-1);柱溫:室溫;樣品池溫度:4 ℃;檢測波長:280nm;檢測時間:30 min。利用WATERS 2695 HPLC系統工作站對實驗結果進行數據處理,采用面積歸一化法計算純度。
1.6.4 配體競爭抑制活性
包被PD-1抗原37 ℃孵育1 h,洗板3次;用2%BSA置于37 ℃封閉1 h,洗板3次;用一定濃度的Biotin-PD-L1-Fc將樣品及參比品以100 μg·mL-1為起始濃度3倍比稀釋11個梯度,每孔加入100µL, 37 ℃孵育1 h;洗板3次,加入辣根過氧化物酶標記鏈霉親和素置于37 ℃孵育1 h,洗板6次;TMB 顯色;450 nm 讀數,并以參比品為對照計算樣品的相對活性。
1.6.5 生物學活性
用F-12培養基將CHO-PDL1細胞密度調整為5×105 cells·mL-1,每孔100 μL接種于96孔白板中;37 ℃、5% CO2培養18 h;將樣品及參比品以120 µg·mL-1為起始濃度3倍比梯度稀釋10個梯度,加入去除細胞上清的CHO-PDL1細胞板中;再將Jurkat效應細胞密度調整至2.5×106 cells·mL-1,每孔40 µL的細胞加入細胞板中,37 ℃、5% CO2培養6 h;每孔添加100 μL ONE-Glo™熒光素酶,并在SPECTRAM5 酶標儀上采用化學發光模式進行讀數,利用四參數方程進行擬合,對生物學活性進行分析。
二、 結果
2.1 外觀、可見異物和不溶性微粒
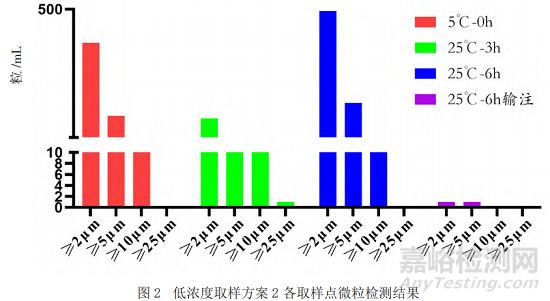
采用目視的方法對不同取樣點的樣品進行檢測,結果顯示均為無色澄清溶液且無明顯可見異物。本研究采用光阻法對不同放置時間、不同稀釋濃度的樣品的不溶性微粒進行分析,除常規的質量標準中報告≥10 μm、≥25 μm的微粒數外,還檢測了2 μm和5 μm的不溶性微粒。結果如圖1和圖2顯示(高濃度和低濃度結果趨勢一致,數據未呈現),隨著放置時間的延長,不溶性微粒數呈增加趨勢,但經輸液器輸注后樣品的微粒數明顯減少。
2.2 蛋白質濃度
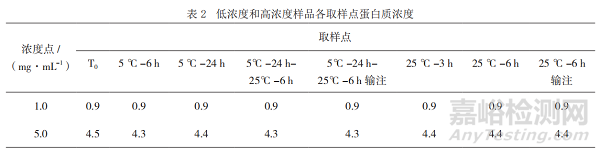
結果顯示,低濃度和高濃度樣品各取樣點(含經過輸液器流出的樣品)的蛋白質濃度均符合擬定質量標準(目標濃度±15%)且未發生明顯變化,見表2,表明本品臨床采用的一次性輸液器對產品未產生明顯的吸附。
2.3 分子大小變異體
采用SEC-HPLC(方法精密度RSD為0.3%)對低濃度和高濃度樣品每個時間點的分子大小變異體進行分析,代表性檢測圖譜見圖3,所有取樣點單體的含量均為99.3%,聚體含量為0.7%~0.8%,未檢測出片段。
2.4 配體競爭抑制活性和細胞生物學活性
采用ELISA法評價的低濃度和高濃度樣品每個時間點的配體競爭抑制活性,結果顯示,不同時間點配體競爭抑制活性均滿足擬定質量標準(70%~130%)且未見明顯變化(見圖4);
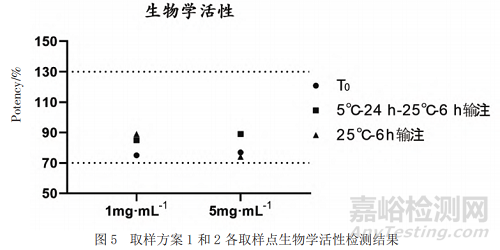
利用熒光素酶報告基因法檢測低濃度和高濃度樣品0 h以及不同條件下輸注后樣品的生物學活性,結果顯示均滿足擬定質量標準(70%~130%)且未見明顯變化(見圖5)。
三、 討論
本研究主要通過理化活性手段評價效期末樣品的高、低2個濃度的使用中穩定性。結果顯示,不同濃度點在不同時間點競爭結合活性和生物學活性未見明顯變化趨勢;對于可能影響效價和免疫原性的抗體聚體和片段未見增加;不溶性微粒檢測結果顯示,隨著放置時間的延長,不溶性微粒數呈增加趨勢,但經輸液器輸注后樣品的微粒數明顯減少,這是由于參照本品說明書,輸注時采用了連接0.2 µm過濾器的一次性精密過濾輸液器所致;另外,其他的質量屬性(外觀、可見異物、蛋白質濃度)在所有研究條件下也保持較好的穩定性。上述研究結果支持本研究采用的近效期末抗PD-1單抗藥物具有良好的使用中穩定性。
相對于小分子藥物,單克隆抗體藥物結構更復雜并且對外界環境更敏感,在配制和使用過程的多種因素均可能引起藥物關鍵質量屬性的變化,從而影響產品的穩定性[12-15];另外,藥物在配制和使用過程中還可能受微生物、細菌內毒素等污染,影響藥物的無菌保證水平,所以嚴格意義上,除評價使用穩定性樣品的理化活性類質量屬性以外,對于需要制備至輸注超過4 h的,還應開展微生物挑戰研究評估單抗注射液經稀釋后的促微生物生長和/或抗菌活性,以支持稀釋后注射前樣品的貯存。此外,一般考慮到使用中穩定性研究試驗應能夠模擬最差條件,所以建議研究應選擇貨架期末的產品進行使用中穩定性研究。但是相關指導原則[5]中也指出,實際申報時常因穩定性數據有限,無法獲得效期末的試驗數據,此時可提供申報時長期穩定性的最后一個時間點用于使用穩定性研究的試驗數據。