您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2022-11-10 22:15
上海市藥品監(jiān)督管理局藥品監(jiān)管處,從監(jiān)管的角度談如何做好藥物警戒檢查的準(zhǔn)備工作。
一檢查總體要求
藥品檢查是藥品監(jiān)督管理部門對藥品生產(chǎn)、經(jīng)營、使用環(huán)節(jié)相關(guān)單位遵守法律法規(guī)、執(zhí)行相關(guān)質(zhì)量管理規(guī)范和藥品標(biāo)準(zhǔn)等情況進(jìn)行檢查的行為。藥品生產(chǎn)企業(yè)要接受的檢查類型包括許可檢查、認(rèn)證檢查、體系檢查等。雖然藥監(jiān)部門對每類檢查都制定了法規(guī)和SOP,但是實(shí)際操作過程中由于程序和標(biāo)準(zhǔn)的不統(tǒng)一,給檢查人員及企業(yè)帶來了一定的困擾。因此2021年5月國家藥品監(jiān)督管理局發(fā)布了《藥品檢查管理辦法》,以統(tǒng)一所有的藥品檢查程序和要求。
在此管理辦法的基礎(chǔ)上,2022年國家藥監(jiān)局發(fā)布了《藥物警戒檢查指導(dǎo)原則》。此原則的適用范圍主要包括持有人自行開展的藥物警戒活動,以及對受托開展的藥物警戒活動。另外,原則中用專門章節(jié)寫了對藥品注冊申請人的檢查,結(jié)合藥物安全性特性和臨床試驗(yàn)安全信息報告及風(fēng)險評估,在臨床試驗(yàn)期間或上市許可前啟動藥物警戒檢查。這一點(diǎn)非常好,因?yàn)榇蟛糠只A(chǔ)性的藥品安全信息來自臨床試驗(yàn),如果臨床試驗(yàn)沒有做好,那么整體藥品安全性數(shù)據(jù),比如禁忌癥、不良反應(yīng)、適用人群等都不可靠。另外,藥品注冊申請人即是日后持有人,需要前期打好基礎(chǔ)。

檢查類別第一種是許可檢查,即對申請人是否具備從事藥品生產(chǎn)經(jīng)營活動條件開展的檢查。許可檢查是藥物警戒檢查的第一步。一般藥品生產(chǎn)企業(yè)具備人、機(jī)、料、法、環(huán)這幾點(diǎn)生產(chǎn)條件,但要獲得生產(chǎn)許可證,還必須設(shè)置藥物警戒機(jī)構(gòu),配備藥物警戒人員,配齊相關(guān)的軟硬件條件。
第二種檢查類別是常規(guī)檢查,即體系檢查,指遵守有關(guān)法律、法規(guī)、規(guī)章,執(zhí)行相關(guān)質(zhì)量管理規(guī)范(如GVP)以及有關(guān)標(biāo)準(zhǔn)情況開展的監(jiān)督檢查。在常規(guī)檢查中重點(diǎn)考慮因素,一個是持有人特征,包括持有品種較多、銷售量大的持有人、未接受過藥物警戒檢查的持有人、首次在中國境內(nèi)獲得藥品注冊證書的持有人、企業(yè)發(fā)生并購、組織結(jié)構(gòu)變更等導(dǎo)致藥物警戒體系發(fā)生重大變化或?qū)λ幬锞浣M織結(jié)構(gòu)有重大影響的持有人、委托生產(chǎn)的持有人、委托開展藥物警戒活動的持有人。其中藥物警戒體系發(fā)生重大變化是指企業(yè)被并購歸入某個集團(tuán),或者從A集團(tuán)劃入B集團(tuán),或者原來是企業(yè)自己做藥物警戒工作,現(xiàn)在委托其他企業(yè)做等情況。另外一個是藥品特征,包括藥品的安全性特性、藥品不良反應(yīng)監(jiān)測數(shù)據(jù)及藥品不良反應(yīng)聚集性事件發(fā)生情況、銷售量大或替代藥品有限的藥品、批準(zhǔn)上市時有附加安全性條件的藥品、創(chuàng)新藥、改良型新藥以及針對兒童、孕產(chǎn)婦等特殊群體使用的藥品、社會關(guān)注度較高的藥品。
常規(guī)檢查后,企業(yè)并不能高枕無憂,還需要面對第三種更嚴(yán)格的檢查——有因檢查。有因檢查是指可能存在的具體問題(聚集性信號、報告不及時)或者投訴舉報等開展的針對性檢查,一般以飛行檢查形式開展。有因檢查重點(diǎn)考慮的因素包括對疑似藥品不良反應(yīng)信息遲報、瞞報、漏報,報告質(zhì)量差的;藥品不良反應(yīng)監(jiān)測提示可能存在安全風(fēng)險的;未能及時發(fā)現(xiàn)、評估、控制或溝通相關(guān)風(fēng)險的;采取暫停生產(chǎn)、銷售、使用和產(chǎn)品召回,未按規(guī)定報告藥品監(jiān)督管理部門的;未按規(guī)定或藥品監(jiān)督管理部門要求開展藥品上市后安全性研究、制定并實(shí)施藥物警戒計劃,且未提供說明的;未按藥品監(jiān)督管理部門要求提供藥物警戒相關(guān)資料或提供的資料不符合要求的;延遲實(shí)施或沒有充分實(shí)施整改措施的;其他需要開展有因檢查的情形。
關(guān)于檢查方式。以前的檢查方式是現(xiàn)場檢查,檢查地點(diǎn)為持有人開展關(guān)鍵藥物警戒活動的場所。比如一家企業(yè)的生產(chǎn)場地在上海奉賢區(qū),藥物警戒部門在靜安區(qū),則檢查的地點(diǎn)就在靜安區(qū);如果集團(tuán)企業(yè)的總部負(fù)責(zé)好幾個子公司的藥物警戒工作,檢查地點(diǎn)可能在子公司進(jìn)行,也可能在總部的藥物警戒部門進(jìn)行。現(xiàn)在檢查方式增加了遠(yuǎn)程檢查,采用視頻、電話等方式開展。在檢查時持有人提供的相關(guān)資料一般為三年以內(nèi),或自上次檢查至本次檢查期間形成的資料。需要提醒的是,檢查時最重要的是真實(shí)性,企業(yè)切記不能造假。
檢查流程為首次會議、開展檢查、末次會議。企業(yè)藥物警戒部門在拿到檢查通知后,一定要和企業(yè)領(lǐng)導(dǎo)匯報,確保企業(yè)高層管理人員如:企業(yè)法人、企業(yè)負(fù)責(zé)人、大中華區(qū)的經(jīng)理、總經(jīng)理等能參加首次會議和末次會議,這樣能讓企業(yè)領(lǐng)導(dǎo)們看到藥物警戒檢查工作的重要性。因?yàn)橹挥衅髽I(yè)領(lǐng)導(dǎo)們參加過檢查,與檢查組交流后,才能體會到藥物警戒工作的重要性和辛苦,才會投入更多的資源。而且檢查中如果發(fā)現(xiàn)涉及到其他相關(guān)部門的缺陷,有這些部門的領(lǐng)導(dǎo)參與,可以更好地完成整改工作。末次會議時,如果被檢查單位對現(xiàn)場檢查通報的情況有異議,可以陳述申辯,好好與檢查組溝通。

在缺陷等級和評定標(biāo)準(zhǔn)中,檢查項(xiàng)目共100項(xiàng),其中可判定為嚴(yán)重缺陷12項(xiàng)、可判定為主要缺陷40項(xiàng),其余48項(xiàng)可判定為一般缺陷。這種缺陷分級方式對企業(yè)是有利的,企業(yè)就能知道哪些是重點(diǎn)考題,哪些是一般考題,也方便企業(yè)進(jìn)行自查。需要提醒的是,風(fēng)險過一過二不過三,前次發(fā)現(xiàn)的缺陷如果在下次檢查還存在,那么缺陷會升級。
綜合評定結(jié)論分為符合要求、基本符合和不符合要求。嚴(yán)重缺陷1項(xiàng)以上、主要缺陷10項(xiàng)以上,或者主要缺陷0到9項(xiàng)、總?cè)毕蓓?xiàng)數(shù)25項(xiàng)以上,都可判定為不符合要求。中間情形判定為基本符合要求。對于基本符合要求的結(jié)果,一般采取告誡、約談、限期整改,視情況暫停生產(chǎn)、銷售、使用。對于不符合要求的結(jié)果,藥監(jiān)部門會第一時間采取暫停生產(chǎn)、銷售、使用、進(jìn)口等風(fēng)險控制措施,消除安全隱患。
對于整改要求,需要注意的是,被檢查單位整改完成,提交整改報告后,藥監(jiān)部門還會對整改情況組織評估,必要時開展現(xiàn)場檢查,確認(rèn)整改符合要求后才會解除相關(guān)風(fēng)險控制措施,并向社會及時公布結(jié)果。
二檢查關(guān)注要點(diǎn)
對100項(xiàng)檢查項(xiàng)目進(jìn)行分類,發(fā)現(xiàn)占比最多的是質(zhì)量管理和文件記錄,共29條,3條嚴(yán)重、12條主要,其次是機(jī)構(gòu)、人員,共21條,3條嚴(yán)重、8條主要,風(fēng)險識別和評估共19條,3條嚴(yán)重、8條主要,最后是監(jiān)測和報告共17條,1條嚴(yán)重、6條主要,風(fēng)險控制共14條,2條嚴(yán)重、6條主要。其中質(zhì)量管理和文件記錄、機(jī)構(gòu)和人員是從事藥物警戒的硬性條件。
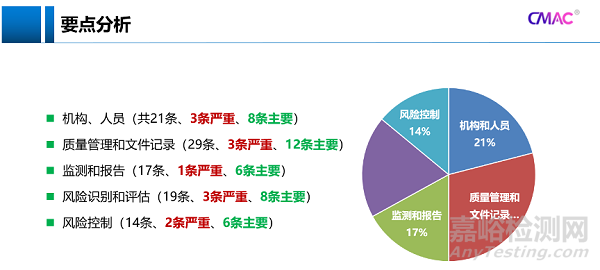
檢查項(xiàng)目中嚴(yán)重缺陷是檢查關(guān)注的重點(diǎn)。對于機(jī)構(gòu)設(shè)置,持有人是否建立藥品安全委員會,是否設(shè)置專門的藥物警戒部門,缺陷風(fēng)險建議等級最高。對于人員配備,持有人是否指定藥物警戒負(fù)責(zé)人負(fù)責(zé)本企業(yè)藥物警戒體系的運(yùn)行和維護(hù),這點(diǎn)的缺陷風(fēng)險建議等級最高。藥物警戒具體工作可以委托集團(tuán)來做,但是藥物警戒負(fù)責(zé)人必須是本公司(子公司)的人員。
對于質(zhì)量管理體系,持有人質(zhì)量管理體系中是否包含對藥物警戒體系及其活動的質(zhì)量管理要求,是否對藥物警戒體系及活動進(jìn)行質(zhì)量管理,是否制定了藥物警戒質(zhì)量目標(biāo),是否將藥物警戒的關(guān)鍵活動納入質(zhì)量保證體系中,是否針對藥物警戒體系及活動制定內(nèi)審計劃,并定期開展內(nèi)審,內(nèi)審前是否制定審核方案,內(nèi)審記錄是否完整,這是在體系要求中檢查的重點(diǎn)。
藥物警戒體系中,持有人建立自主的疑似藥品不良反應(yīng)信息收集途徑非常關(guān)鍵。這里的自主是指不依賴于國家局反饋數(shù)據(jù),而是建立自己的全面、暢通、有效的信息收集途徑,包括醫(yī)療機(jī)構(gòu)、藥品生產(chǎn)企業(yè)、藥品經(jīng)營企業(yè)、學(xué)術(shù)文獻(xiàn)、上市后研究、數(shù)據(jù)收集項(xiàng)目、相關(guān)網(wǎng)站等。對于收集的疑似藥品不良反應(yīng)信息,是否開展信號檢測,對檢測出的信號是否進(jìn)行評價,也都是檢查關(guān)注的重點(diǎn)。

三思考與展望
隨著生物醫(yī)學(xué)技術(shù)不斷取得新突破,前沿藥品給患病人群帶來希望和健康保障的同時,也伴隨著“是藥三分毒”安全風(fēng)險,所以更需要藥物警戒保駕護(hù)航。
藥物警戒中的“警”字,上面是“敬”字。第一是敬畏。藥物警戒活動是企業(yè)“敬畏藥品安全”的基礎(chǔ)。第二是敬重。通過藥物警戒檢查,企業(yè)高層領(lǐng)導(dǎo)會更敬重藥物警戒工作,會對藥物警戒工作投入更多的資源,開展更多的協(xié)調(diào)工作,推動藥物警戒能力提升。
當(dāng)前,政府對藥品安全性的高度重視,使藥物警戒工作處于歷史機(jī)遇期。各位藥物警戒的同仁們要不忘初心,牢記使命,有作為就有地位,為保障人民群眾用上好藥、放心藥做出更大的貢獻(xiàn),同時也在工作中實(shí)現(xiàn)更大的自我價值。

來源:CMAC發(fā)布


