您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-08-08 14:11
在新藥開發過程中,固態形式的選擇首選是最穩定的晶型。但是,隨著難溶性藥物如雨后春筍般冒出,有的時候不得不選擇亞穩定晶型或無定形作為固態形式進行開發,以提高藥物的溶解度和溶出速率,進而增加藥物的體內吸收,增強藥物療效。當然,選擇這種不利的條件,也是有風險和副作用的,即帶來轉晶問題。但是,隨著技術的提高,對于藥物固態形式認識不斷強化,使得藥物開發的固態形式,更具有多元化和選擇性。早期新藥更多的要求是看到其體內的治療效果,以穩定形式的晶型快速推進申報與臨床。后續開發中,可以根據藥物理化性質,進行更廣泛的固體形式研究。
a.多晶型與固態篩選
我們知道晶體的藥物存在多晶型現象,由于晶體內部分子結構的構象,構型,分子排列,分子作用力等因素造成了兩種及兩種以上的分子排列狀態,形成不同的物質存在狀態。多晶型的轉變即在一定外界環境作用下,晶型均會自發的最穩定的晶型轉變。
案例1:晶體藥物多晶型研究-利托那韋
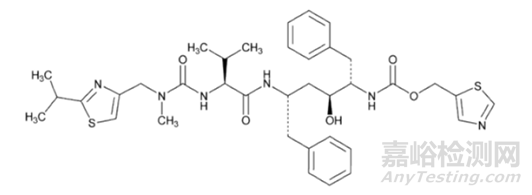
圖1利托那韋結構式 來源于FDA
利托那韋原料外觀為白色粉末,分子式為C37H48N6O5S2,相對分子質量為720.95,熔點為120-122°C,在乙醇、甲醇、丙酮等有機溶劑中易溶,幾乎不溶于水,在0.1NHCl溶出速率極慢,親脂性強。
雅培公司研發的抗艾滋病藥物利托那韋常常作為比較具有代表性的例子來說明轉晶給藥物溶出及體內帶來的災難。天冬氨酸蛋白酶是HIV顆粒成熟的關鍵酶,利托那韋通過抑制該蛋白酶的活性,阻斷HIV病毒的復制,從而阻止HIV病毒在體內的蔓延。由于利托那韋是CYP3A肝藥酶的有效抑制劑,能抑制CYP3A介導的生物轉化,因此臨床上可單獨使用,或聯用其他抗逆轉錄病毒的蛋白酶抑制劑藥物用于艾滋病病人的治療。
1995年12月,利托那韋NDA新藥申請;1996年01月,雅培(Abbott)開始商業批生產;1996年03月,FDA批準利托那韋用于治療艾滋(AIDS獲得性免疫缺陷綜合征),最先以液體制劑和膠囊制劑上市使用;1998年初,發現膠囊制劑在儲存過程中藥物API晶型變成了利托那韋的另一種更穩定的晶型Form II,與已經上市的亞穩晶型Form I相比,晶型Form II的溶解度顯著下降,出現了藥物大量析出和溶出測試不合格的情況,而且溶解性較好晶型Ⅰ憑空消失,利托那韋被迫撤市。
當然,雅培公司并沒有放棄這個品種,重新進行固態研究,即選擇更加合適的晶型進行開發。晶型Form I與晶型Ⅱ相比,屬于亞穩定晶型,易于向晶型Ⅱ轉變。晶型Form II是更穩定的晶型,無轉晶的風險,更加易得,開發晶型Form II作為優勢晶型,似乎更加能保證制劑產品質量的穩定。
當然,固態形式的選擇,不僅僅要關注不同固態形式的理化性質,包括溶解度,引濕性,機械性質以及物理化學穩定性,還要保證選擇的固態形式具有可開發性,保證產品質量的同時可以持續供應。晶型Form II在進行工藝研究過程中,發現溶劑殘留和雜質超標問題難以克服。同時,晶型Form II晶癖呈現針狀,具有比較差的機械性質,不利于后續制劑的開發。

圖2 左側為Form I,右側為晶型Ⅱ晶癖圖譜 參考文獻2
痛定思痛后,進行全面的分析研究發現:雖然晶型FormI是亞穩晶型,但是其具有更高的溶解性和溶出速率,一定程度上可以藥物的生物利用度,下表為晶型Ⅰ和晶型Ⅱ在不同比例的乙醇/水中的溶解度差異。其實,晶型Ⅱ具有比晶型Ⅰ更高的熔點(高2-3℃),恰恰也驗證了化合物熔點高低對于溶解度的影響。

來源于參考文獻2
利托那韋最初以晶型Ⅰ開發上市,晶型Form I的長期化學穩定性及晶型穩定性均滿足制劑要求,保證其貨架期的穩定性。優勢晶型的首選穩定晶型,但絕不是簡單粗暴的決定,需要全面的進行抉擇,有時為了藥物的體內的暴露,提高藥物的生物利用度,亞穩定晶型,甚至無定形形式,也是常有發生。雖然“利托那韋制劑”對晶型沒有特殊要求,公司也開發出了符合穩定晶型Form II的制劑處方。但雅培公司從“原料生產和制劑生產”的角度考慮,仍然選擇了“亞穩的晶型Form I”作為API的晶型重回市場。
b.無定形形式開發
據估計,制藥行業合成的新化學實體(NCE)中至少有三分之二屬于難溶于水的藥物,大部分屬于BCS II類。即使當這些化合物被認為具有差或低水溶性時,溶解度的低程度也可能有很大差異。大多數在1970年代和1980年代被認為水溶性差并表現出生物利用度問題的藥物的溶解度在20-100μg/mL范圍內。溶解度小于10μg/mL的最早的兩種藥物是洛伐他汀和辛伐他汀,它們于20世紀80年代后期上市。它們報道的溶解度約為7μg/mL。在過去的20年里,情況發生了很大的變化,以至于<1μg/mL的溶解度現在非常普遍。隨著難溶性藥物的增多,使用無定形固體分散體的增溶策略也越來越多。藥物的固態形式除了晶型(穩定型和亞穩定型),還包括無定形。無定形形式可以提高化合物的溶解度和溶出,最終提高藥物的生物利用度。
利托那韋的結晶形式顯示出明顯的pH依賴性溶解度。利托那韋結晶形式在SGF(pH=1.2)和FaSSGF(pH=1.6)中的溶解度相對較高(383µg/ml和77.9µg/ml)。相反,在pH值高于利托那韋pK值(1.9和2.6)的介質中的溶解度非常低。在pH4醋酸鹽介質中,溶解度為6.2µg/ml。在SIF(pH=6.8)中,溶解度甚至更低,為3.4µg/ml。在FaSSIFV1(pH=6.5)中,由于膽汁鹽和卵磷脂的影響,溶解度稍高(11.5µg/mL),已知它們會增加中度至高度親脂性化合物的溶解度(利托那韋logP=3.9)。
表2 結晶利托那韋在不同介質中的平衡溶解度(來源于參考文獻2)

利托那韋是屬于低溶解性,低滲透性藥物,屬于BCS Ⅳ類。為了改善其藥物的理化性質,后來通過熱熔擠出技術制備固體分散體,以片劑上市,并且可以室溫下放置,不必冷藏,生物利用度比膠囊劑高。由于耐藥性和毒性的問題,利托那韋常常和其他抗病毒藥物聯合使用,也就是“雞尾酒療法”。不管是在一線治療方案還是二線治療方案,利托那韋都起著重要作用。

圖3 利托那韋固體分散體處方 來源于FDA
總結:
新藥的上市之路離不開醫藥公司投入大量的時間與資源,強的的研發實力決定了藥物上市的時間與所耗費的資源。而一個新藥能否上市,需要同時藥物分子-藥物固態形式-藥物制劑三層次的要求。本文從藥物固態形式的角度,介紹了以利托那韋為代表的藥物產品,固態形式的研究之路。最初以看似獨一無二的晶體形式進行上市,可是,上市后,晶型轉變引發藥物的上市危機。憑借強大的研發實力以及對于藥物的認識,以原有晶型重新上市。根據藥物比較差的理化性質,跳出以晶態上市的固有思維,以無定形固體分散體的形式,以片劑再次上市,舊瓶裝新酒,也別有一番風味。新藥的開發,需要潛心的研究,積累深厚的經驗,加強理論知識的學習,才能很好的應對藥物研發路上的變化。
參考文獻:
1.Biorelevant two-stage in vitro testing for rDCS classification and in PBPK modelling – Case example ritonavir.
2.Dealing with the Impact of Ritonavir Polymorphs onthe Late Stages of Bulk Drug Process Development.2
3消失的多晶型:利托那韋重新上市的晶型研究策略
4.FDA
5.EMA

來源:藥事縱橫


