您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-12-08 22:36
本文根據借鑒了法規的要求,同時結合筆者的工作經驗 ,整理此稿供交流學習。
隨著《美國藥典》USP新通則<232>和USP<233>、ICH Q3D元素雜質指南、《中國藥典》元素雜質限度限度和測定指導原則等法規的實施日益受到藥企重視,同時元素雜質研究也作為關系到藥品國內外注冊申報、原料藥等進出口貿易直接相關材料。所以本文從元素雜質的風險評估、不同法規對元素雜質的要求、以及分析方法開發與驗證三個部分分享元素雜質對醫藥相關企業思考。
一、元素雜質的風險評估
風險評估過程可以描述為以下三步:(1)識別已知和潛在可能進入藥品的元素雜質來源(2)通過測試已知或預期雜質,將其水平與已有PDE 值比較,評估藥品中特殊的元素雜質出現的可能性,(3)總結和記錄風險評估。識別出工藝中嵌入控制是否充分,或識別出要考慮增加控制來限制藥品中的元素雜質
在很多情況下,這些步驟其實是同步的。風險評估的結果,可以是一個迭代的結果,用以建立一種方法來保證潛在元素雜質不超過PDE 值。
元素雜質從來源上說,一般由四個來源,(1)生產過程中有意添加的元素(例如催化劑)的殘留雜質;(1)是非有意添加, 但原輔料、生產用水等引入的元素雜質;(3)生產設備引入的元素雜質;(4)是由容器密封系統浸出至API或制劑的元素雜質。所以我們在原材料的選購、生產設備的選擇、藥品內包材的使用、一次性生產使用系統使用過程中,都要考慮到元素雜質的引入風險。
在對潛在元素雜質進行識別后,可能會有兩種結論:(1)風險評估未能識別出任何潛在元素雜質。風險評估的結論和支持性資料和數據要進行記錄。(2) 風險評估識別出了一個或多個潛在元素雜質。對所有識別出的元素雜質,如果該元素雜質有多個來源,要考慮進行風險評估。并記錄評估的結論和支持性資料。
總結要考慮相對于元素雜質PDE 值,已觀察到的或預期的元素雜質水平的顯著性。這里,將藥品中已建立的PDE 值的30%定義為控制閾值,作為對已觀察到的元素雜質水平的顯著性的衡量方法。
如果藥品中所有來源的總元素雜質水平預期會保持一致,且低于PDE 值的30%水平,而申報人已對數據進行了適當的評估,證明對元素雜質的控制已經足夠充分,則不需要采用更多的控制措施。
如果風險評估未能證明一種元素雜質的水平具有一致性且低于控制閾值,則要建立控制措施來保證元素雜質水平不會超過藥品的PDE 值。
控制元素雜質是藥品全面控制策略的一部分,它能保證元素雜質不超過PDE 值。當元素雜質有可能超過控制閾值時,需采取更多措施來保證其水平不會超過PDE 值。申報人可以采用的措施包括但不僅限于:(1)改進生產工藝步驟,通過特定或非特定的精制步驟將元素雜質降低至控制閾值以下;(2)實施中控或上游控制,用以將元素雜質的濃度限定在制劑的控制閾值以下;(3)建立輔料或原料的質量標準限度(例如,合成中間體)(4)建立原料藥質量標準限度;(5)建立制劑質量標準限度;(6)選擇適當的容器包裝系統。
二、不同法規對元素雜質的要求及控制方法
(1) EMA、EP關于元素雜質的要求
2008年2月21日EMEA/CHMP頒布了金屬催化劑或金屬試劑殘留量限度規定的指導文件(GUIDELINE ON THE SPECIFICATION LIMITS FOR RESIDUES OF METALCATALYSTS OR METAL REAGENTS),并將于2008年9月1日在歐盟正式實施。該指導文件從1998年6月開始起草,歷經多次咨詢、討論,最后定稿。該指導文件基于安全考慮(對人體健康的潛在風險),將金屬分為以下3類。
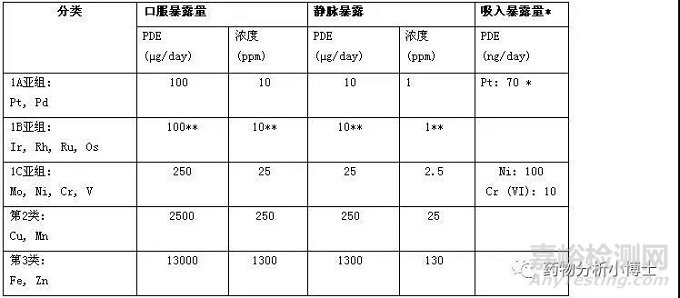
第1類金屬:具有顯著安全性擔憂。這一類金屬具有已知的或懷疑的人體致癌性,或者具有其他顯著的毒性。包括鉑(Pt)、鈀(Pd)、銥(Ir)、銠(Rh)、釕(Ru)、鋨(Os)、鉬(Mo)、鎳(Ni)、鉻(Cr)、釩(V)十種金屬。其中第1類金屬又被分為1A、1B 、1C三個亞組,1A亞組包括Pt、Pd。1B亞組包括Ir、Rh、Ru、Os。1C亞組包括Mo、Ni、Cr、V。
第2類金屬:具有低的安全性擔憂。這一類金屬對人體有潛在的較低毒性。通常可以較好耐受此類金屬在常見藥物中的暴露量。可能是營養需要的痕量金屬,常存在于食物原料中或營養補充劑中。包括銅(Cu)、錳(Mn)。
第3類金屬:安全性擔憂最小。這一類金屬無明顯毒性。已建立了安全范圍,在遠大于常見藥物中的量時,也可以較好耐受。通常廣泛存在于環境、植物或動物中。包括鐵(Fe)和鋅(Zn)。
該指導文件的14種金屬分類見表1。
表1:金屬催化劑和金屬試劑的分類、PDE和濃度限度
(2) ICH Q3D元素雜質的要求
ICH于2009年10月批準了Q3D,經過多方討論后,修訂版本的Q3D step4于2014年12月16日生效,其中列出了24種元素雜質的三種給藥途徑的PDE值,確定了實施日期為:新上市許可為2016年6月生效,已上市品種為2017年12月生效。
ICH Q3D規定了元素雜質在藥品、原料藥和輔料中的允許濃度,單位為ug/g。可以使用這些濃度來評估日劑量不超過10g/天的藥品中含有的元素雜質。數值如下表。
|
元素 |
分類 |
口服濃度 |
注射濃度 |
吸入濃度 |
|---|---|---|---|---|
|
Cd 鎘 |
1 |
0.5 |
0.2 |
0.2 |
|
Pb 鉛 |
1 |
0.5 |
0.5 |
0.5 |
|
As 砷 |
1 |
1.5 |
1.5 |
0.2 |
|
Hg 汞 |
1 |
3 |
0.3 |
0.1 |
|
Co 鈷 |
2A |
5 |
0.5 |
0.3 |
|
V 釩 |
2A |
10 |
1 |
0.1 |
|
Ni 鎳 |
2A |
20 |
2 |
0.5 |
|
Tl 鉈 |
2B |
0.8 |
0.8 |
0.8 |
|
Au 金 |
2B |
10 |
10 |
0.1 |
|
Pd 鈀 |
2B |
10 |
1 |
0.1 |
|
Ir 銥 |
2B |
10 |
1 |
0.1 |
|
Os 鋨 |
2B |
10 |
1 |
0.1 |
|
Rh 銠 |
2B |
10 |
1 |
0.1 |
|
Ru 銣 |
2B |
10 |
1 |
0.1 |
|
Se 硒 |
2B |
15 |
8 |
13 |
|
Ag 銀 |
2B |
15 |
1 |
0.7 |
|
Pt 鉑 |
2B |
10 |
1 |
0.1 |
|
Li 鋰 |
3 |
55 |
25 |
2.5 |
|
Sb 銻 |
3 |
120 |
9 |
2 |
|
Ba 鋇 |
3 |
140 |
70 |
30 |
|
Mo 鉬 |
3 |
300 |
150 |
1 |
|
Cu 銅 |
3 |
300 |
30 |
3 |
|
Sn 錫 |
3 |
600 |
60 |
6 |
|
Cr 鉻 |
3 |
1100 |
110 |
0.3 |
同時,如果藥品中元素雜質允許濃度不適用時,指導原則也給出了方法2a、2b或3的允許濃度限值的計算方法。
(3) USP<232>、USP<233>元素雜質的要求
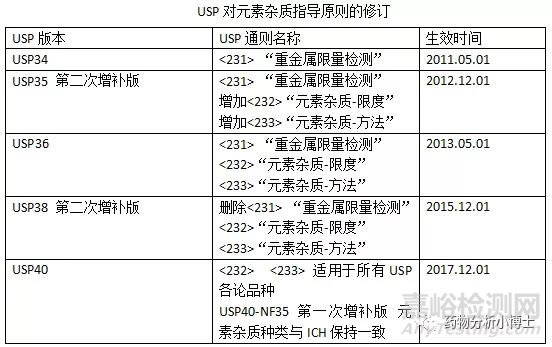
USP<232>、USP<233>元素雜質的要求從元素雜質種類和限值要求上基本與ICH保持一致,USP<233>推薦了兩種基于現代分析儀器額檢測方法,方法1是ICP-AES法(或ICP-OES法)、方法2 是ICP-MS,這兩種分析方法具有較高的靈敏度和準確性,可以檢測出藥品中很低殘留量的元素雜質。同時,針對固體樣品,新通則給出了首選密閉容器微博消解技術作為固體樣品的前處理方式。
(4)中國藥典對重金屬元素雜質的要求
中國藥典2015版 四部通則 0821重金屬檢查法 對重金屬檢測的檢測方法仍然使用比色法。2017年隨著中國食品藥品監督管理局加入ICH成員,未來中國的藥品法規也是向ICH指南靠攏。所以2018年國家藥典委員會發布了《元素雜質限度和測定指導原則》2020年版第一次征求意見稿。元素雜質研究要求正式接軌ICH Q3D的要求。
三、元素雜質分析方法開發與驗證的經驗分享
(1)儀器設備的選擇
目前比色法依然是中國藥典采用的方法,但因為這一方法無法準確定性定量不同重金屬元素的含量,缺乏專屬性、靈敏度的要求,所以檢測方法限定為ICP-MS法、ICP-OES法(或者ICP-AES法)、原子吸收分光光度法。筆者實驗室均有這些儀器設備,所以分析一下各儀器設備的優劣勢供大家參考。
ICP-MS法:
優勢:檢測限低至ppt級別,線性范圍寬,專屬性強, 多元素同時檢測;
劣勢:光譜干擾嚴重,耐鹽性差,鉀鈣鈉等元素干擾嚴重,儀器成本高。
ICP-OES法(或者ICP-AES法)
優勢:檢測限高于ICP-MS,精密度更準確度高,線性范圍寬,多元素同時檢測
劣勢:譜線復雜、干擾強烈、導致分析測試能力下降。
原子吸收分光光度法(FAAS GFAAS)
優勢:常用于Na、K、Ca、Mg、Fe、Zn、Li等元素的分析。儀器不貴,重現性好。
劣勢:基質干擾嚴重、線性范圍窄、只能一次檢測一個元素,時間成本高。
所以我們在原料藥中進行方法學開發儀器選擇時,需要根據目標物的種類和個數來選擇儀器設備。常規ICH Q3D中24元素基本選擇ICP-MS來操作最為方便,目標物限值濃度較高時建議選擇ICP-OES比較合適。選擇了儀器設備,我們下一步進行試驗部分。
(2)前處理方法的選擇
明確了要分析的金屬元素之后,就要確認方法開發與驗證中最重要的部分-樣品前處理。好的方法,從前處理開始。與指導原則不同,USP<233>對于適用的四種前處理方法做出了明確的規定。需要強調的是,絕大多數的驗證數據偏差和后續方法開發的挑戰,都來自前處理的環節。雖然每種方法都有自己的特點和適合的樣品類型(見下表),總體來說直接溶解法在操作的簡易性與安全性,結果的穩定性上都具有一定的優勢,也是可以最先嘗試的步驟。
四種前處理方法特點對比如下:

對于有些易于直接溶解于有機溶劑(比如異丙醇, 二甲亞砜等等)中的醫藥中間體來說,由于避免了高溫高壓的反應過程,很多反應性,揮發性強的金屬雜質都能獲得不錯的回收,可以為后期的方法驗證以及最終的QC測試節約大量的工作量。 對于不能直接溶解的化合物,還可以選擇間接溶解法。其中密閉容器微波消解法是最主流的選擇,涉及的方法參數組合也比直接溶解要復雜些。選擇消解方式時需要考慮酸的選擇、樣品量的選擇、消解模式程序的選擇問題。(3)預實驗在摸索出完全溶解樣品的方法之后,需要進行預實驗確認消解溶液的的穩定性,以及設置儀器參數的準確度和精密度的大致范圍,為最終的驗證做準備。
元素分析預實驗常見的問題與原因供參考如下:

(4)完整的方法學驗證方法學驗證在USP、EP、中國藥典中會有區別,但是區別不大。以下按照中國藥典2015年版 四部通則 9101為例說明要驗證的部分。驗證部分一般包括:專屬性、線性與范圍、本底測試、準確度、重復性、中間精密度、檢出限、定量限、耐用性、系統適用性、溶液穩定性等內容。以下簡短分別闡述做法。
線性與范圍:ICP-MS線性范圍廣,常規定量分析做0.5J與2J即可,也可作5標準點。檢測限與定量限:在制作好標準工作曲線后,連續測定空白溶液21次,記錄空白溶液的響應值。根據公式計算儀器檢出限以及儀器定量限。系統適用性:常規試驗開始前后分別測試三次J標樣濃度, 評價RSD。
準確度:高中低濃度加標回收。
重復性:6份J溶液,計算RSD。
中間精密度:常規換人員、時間分別6份J溶液,計算RSD。專屬性:根據元素選擇對應的內標物質;汞元素測試可以采用金溶液作為汞的清洗液,消除汞記憶效應。耐用性:一般考慮消解溫度、消解時間、泵速、溶液穩定性試驗。以上根據經驗所寫,供大家參考使用。

來源:Internet


