您當(dāng)前的位置:檢測資訊 > 行業(yè)研究
嘉峪檢測網(wǎng) 2021-08-30 09:40
至今還清晰記得報考研究生選專業(yè)的時候自己非常堅決地選擇了藥物化學(xué),在我當(dāng)時有限的書本知識范圍里,小分子靶向藥物的春天就要來了,而我蠢蠢欲動,想做那“站在風(fēng)口的豬”。研究生入學(xué)是2014年,也正是PD-1單抗上市的元年,BMS的Opdivo(O藥)與MSD的Keytruda(K藥)相繼成功上市,并以摧枯拉朽之勢迅速拿下多個腫瘤適應(yīng)癥。再到后來基因療法、細胞療法等多種創(chuàng)新生物技術(shù)的層出不窮,我想可能很多從事小分子藥物研發(fā)的人和我一樣如坐針氈,這也迫使我在五年研究生階段一直到后來參加工作都在思考小分子藥物“尚能飯否”這個問題。關(guān)于這個問題,我和同學(xué)、同事以及導(dǎo)師都有過多次激烈的討論,終究也沒有誰能完全說服對方,小分子藥物與生物創(chuàng)新療法(包括抗體、基因療法、細胞療法等)的博弈,到底是“愈久彌香”還是“長江后浪拍前浪”,我想結(jié)論還是留給時間來檢驗。
1小分子藥物的困境—“前狼后虎”
回顧創(chuàng)新藥近20年的銷售數(shù)據(jù),我們發(fā)現(xiàn)在2000年全球銷售額Top10創(chuàng)新藥中8個為小分子藥物,從2008年開始Top10銷售額創(chuàng)新藥中的小分子藥物開始小于等于5個,到2019年Top10中僅有4個為小分子,小分子藥物逐步失去了銷售額的頭把交椅,在整體銷售額中的占比也呈現(xiàn)逐步下降趨勢。在眾多潛力生物技術(shù)療法的沖擊下,小分子藥物的市場正在逐步被侵蝕,更有悲觀者擔(dān)憂隨著層出不窮生物療法的涌現(xiàn),小分子藥物是否可能最終逐步退出歷史的舞臺。
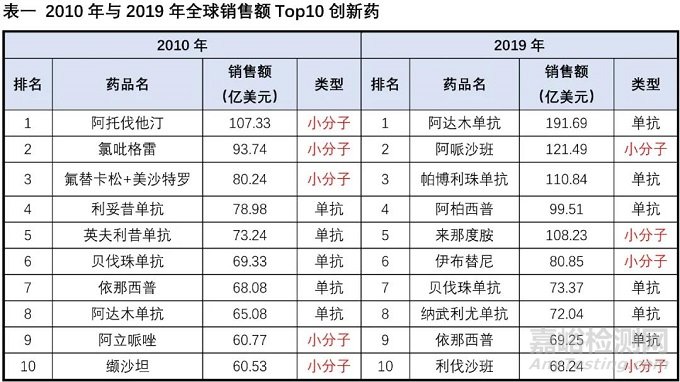
小分子藥物從最早罌粟中的嗎啡、柳樹中的水楊酸到上個世紀(jì)出現(xiàn)歷史上第一個年銷售額超10億美元的“重磅炸彈”藥物-地西泮,到2001年第一個針對癌細胞特定基因突變的靶向小分子藥格列衛(wèi),再到如今有獲批超過60個的激酶抑制劑小分子,小分子藥物的開發(fā)經(jīng)歷了輝煌的歷史。從2005-2020年FDA批準(zhǔn)的新藥統(tǒng)計數(shù)據(jù)可以看出,新分子實體(即小分子藥物)的占比從2005的90%左右,逐步下降到70%附近,并呈現(xiàn)進一步緩慢下降的趨勢。小分子藥物的開發(fā)貌似進入了“前狼后虎”的困境期,當(dāng)前小分子藥物的開發(fā)不僅受限于新靶點發(fā)現(xiàn)與小分子庫多樣性的增速逐年降低,使得小分子藥物的開發(fā)一直保持相對較低的成功率(小分子靶向藥物成功率均值約為11%,腫瘤藥物的成功更是低至5%),同時還受到抗體、基因療法、細胞療法、ADC、溶瘤病毒等眾多創(chuàng)新生物技術(shù)對相同適應(yīng)癥市場的圍住堵截。在尚未充分開拓的適應(yīng)癥市場(包括各類罕見病),新開發(fā)的生物技術(shù)療法同樣表現(xiàn)出非常好的潛力與優(yōu)勢,如血友病(雙抗藥物Hemlibra與基因療法ValRox)、地中海貧血癥(基因療法Zyntegl)、三陰性乳腺癌(ADC藥物-Sacituzumab Govitecan)、家族性淀粉樣多發(fā)性神經(jīng)病變(siRNA藥物-Patisiran)等。
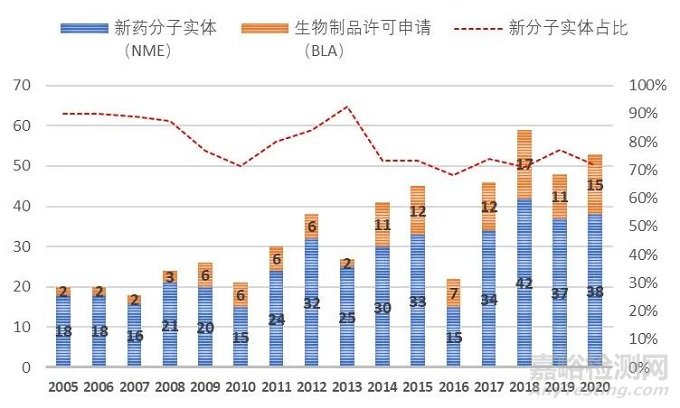
圖1 FDA 2005-2020批準(zhǔn)新藥
想要探討小分子藥物自身發(fā)展的困境,首先需要了解現(xiàn)代小分子藥物研發(fā)最重要的基礎(chǔ)手段-篩選(Screening)。要進行篩選,首先你要有一個代表某種疾病指征的“篩子”,這個“篩子”可能是一個靶點蛋白,也可能是一個細胞株,甚至可能是一批實驗動物。其次要有一個庫(小分子library),庫里面要有足夠的分子供你篩選,從相應(yīng)的庫里面“大海撈針”找到一個或多個符合要求的苗頭化合物(Hit),經(jīng)過層層結(jié)構(gòu)優(yōu)化得到先導(dǎo)化合物(Lead)、候選化合物(Candidate),再經(jīng)過系統(tǒng)的臨床試驗充分驗證安全性與有效性,才能得到患者使用的藥物。
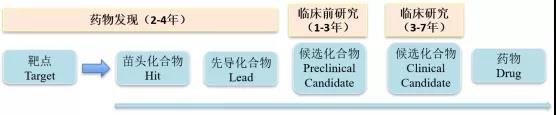
圖2 小分子藥物研發(fā)流程
上個世紀(jì)末到本世紀(jì)初,小分子藥物研發(fā)的突飛猛進很大程度依賴于疾病新靶點和疾病指征的發(fā)現(xiàn)以及有機合成化學(xué)的爆發(fā)式發(fā)展與各類檢測技術(shù)的進步。有機合成化學(xué)從上個世紀(jì)70-80年代開始迎來爆發(fā),導(dǎo)致了大量復(fù)雜、帶有雜原子的、用原有方法很難合成的分子的出現(xiàn);而質(zhì)譜(MS),核磁共振(NMR)等檢測手段的進步也導(dǎo)致了很多天然產(chǎn)物的成功分離,與此同時檢測手段的進步也助推了新靶點的發(fā)展(如基因測序、蛋白質(zhì)組學(xué))。生物技術(shù)的發(fā)展導(dǎo)致了一些重要的疾病指標(biāo)和靶點的發(fā)現(xiàn),從而使得各大制藥公司能夠使用手中數(shù)百萬計的小分子對這些疾病和靶點進行篩選,進而促使了小分子新藥的大爆發(fā)。雖然說小分子庫到現(xiàn)在還在逐年增長,但是分子的類型和多樣性的增速卻在逐年降低,促進小分子藥物研發(fā)突破的主要還是新的靶點和疾病指征的發(fā)現(xiàn)。目前大多數(shù)的公司其實是在用新的“篩子”不停地篩舊的化合物庫,期望那些之前沒有被篩出來或者已經(jīng)被篩出來的分子能在新的靶點上起效。當(dāng)然藥物化學(xué)家們也很早期就意識到了這個問題的存在,之后又陸續(xù)開發(fā)了組合化學(xué)(Combinatorial Chemistry)、DNA編碼化合物庫(DNA Encoding Library,DEL)技術(shù)來擴充化合物庫。這兩種技術(shù)在一定階段上緩解了化合物庫匱乏的危機,但是它們都依賴于現(xiàn)有的經(jīng)典有機合成反應(yīng),同時對反應(yīng)條件還有嚴格的要求,受限的化學(xué)反應(yīng)類型在一定程度上決定了的分子種類規(guī)模上限,進而影響了化合物庫中化合物結(jié)構(gòu)的多樣性。
2博弈
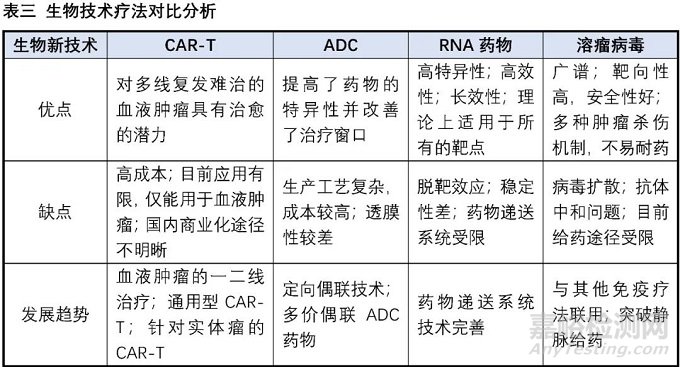
在巨大的醫(yī)藥市場與強大的社會責(zé)任感的驅(qū)使下,全球主要經(jīng)濟體都在竭盡所能努力發(fā)展生物醫(yī)藥產(chǎn)業(yè),各種創(chuàng)新生物技術(shù)療法如雨后春筍般涌現(xiàn),為廣大的病患帶來更多恢復(fù)健康、延長壽命的選擇。目前已經(jīng)有成功上市產(chǎn)品的生物技術(shù)療法包括抗體藥物、ADC、CAR-T細胞療法、基因療法、RNA藥物、溶瘤病毒等,其中抗體藥物的發(fā)展最為成熟,以2019年為例,銷售額Top10中有6個為抗體藥物。下表我們以小分子藥物與抗體藥物的對比為例,來探討小分子藥物與創(chuàng)新生物技術(shù)的優(yōu)劣勢。
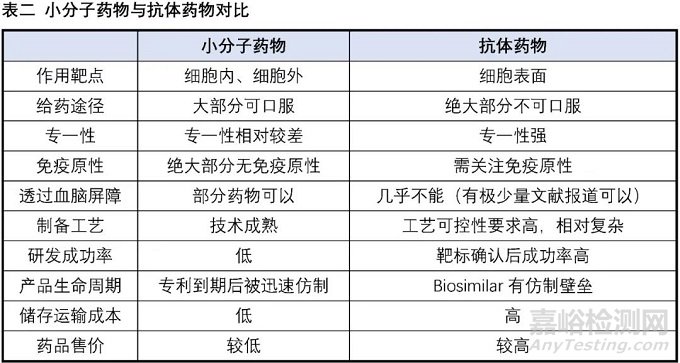
相對大分子抗體藥物等生物技術(shù),小分子藥物的優(yōu)勢:
(1)大部分的小分子藥物可以口服,給藥方便,相比之下絕大部分的生物技術(shù)產(chǎn)品都采用注射類給藥方式,患者依從性差。
(2)小分子藥物能很好地作用于細胞內(nèi)(包括細胞核內(nèi)靶點)與細胞外的靶點。
(3)部分小分子藥物能通過血腦屏障,可用于腦部疾病治療,目前作用于中樞神經(jīng)體統(tǒng)的藥物依然以小分子為主。
(4)小分子藥物對儲存環(huán)境的敏感性相對較低,儲存運輸方便。
(5)幾乎沒有免疫原性,生物技術(shù)產(chǎn)品如抗體、基因治療的AAV病毒等都有可能被免疫系統(tǒng)識別為抗原激發(fā)免疫反應(yīng)。
(6)小分子藥物相對更容易實現(xiàn)差異化,這受益于小分子藥物眾多且相對成熟的靶點,同時針對小分子進行的微小改動往往能收獲意向不到的效果(如代謝改善、選擇性提高、毒性降低等)。相比之下生物技術(shù)相關(guān)療法的起步相對較晚,技術(shù)相對不是那么成熟,從而使得同一技術(shù)在相同領(lǐng)域容易出現(xiàn)嚴重的同質(zhì)化現(xiàn)象,如“百家爭鳴”的PD-1/PD-L1抗體、CD-19-CAR-T細胞療法(這兩個產(chǎn)品的國內(nèi)臨床試驗登記項目數(shù)量都超過了100家)。
相對大分子抗體藥物等生物技術(shù),小分子藥物的劣勢:
(1)對于沒有適合作用口袋的靶點較難開發(fā),比如蛋白質(zhì)-蛋白質(zhì)相互作用界面一般大而平坦,沒有很好的口袋容納小分子,而利用大分子藥物比如擁有類似作用面的抗體來干擾卻特別有效。
(2)特異性不高,小分子藥物由于結(jié)構(gòu)相對較小,往往容易對多個靶點有活性,這也是許多小分子藥物副作用大的原因。
(3)半衰期短,往往需要一日一次甚至一日多次服用。
(4)開發(fā)成功率較低,以抗體藥物為例的整體研發(fā)成功率約為20%,相比之下小分子藥物整體研發(fā)成功率僅為約11%。
(5)制備工藝相對簡單成熟。這一點既是優(yōu)勢也是劣勢,相對簡單成熟的制備工藝使得小分子藥物的生產(chǎn)成本遠低于其他生物技術(shù)產(chǎn)品,同時正是相對簡單成熟的制備工藝,當(dāng)一種小分子藥物的專利到期時,仿制藥能以相對低廉的成本搶占原研市場,造成小分子藥物的“專利懸崖”。
小分子藥物作為最傳統(tǒng)的藥物形式,雖然當(dāng)前的發(fā)展遇到一些困境,但也有其難以替代的優(yōu)勢。ADC、細胞療法、基因治療等新藥物形式正在逐步興起,在多個治療領(lǐng)域表現(xiàn)自己獨到的優(yōu)勢和驚人的潛力,但同時也面臨著各自的嚴峻挑戰(zhàn),相信在不久的將來也會是多種藥物形式共存的競爭格局,各類療法的追隨者也會努力在自己的領(lǐng)域?qū)で笸黄啤?/span>
3小分子的出路—
“長出一個小翅膀,就能飛得更高”
“站在風(fēng)口上豬都能飛起來”后面其實還有下半句—“長出一個小翅膀,就能飛得更高”。小分子藥物作為曾經(jīng)“站在風(fēng)口的豬”,當(dāng)前的發(fā)展雖然遭遇困境,但是只要在某些關(guān)鍵點做出新的突破,為自己加上一個小翅膀,我想小分子藥物的未來當(dāng)然可以更高更遠。隨著分子生物學(xué)、結(jié)構(gòu)生物學(xué)的快速發(fā)展,小分子藥物發(fā)現(xiàn)進入基于靶點的藥物設(shè)計的時代,我們能夠基于某個靶點進行高通量篩選,可以獲得小分子和靶蛋白的復(fù)合晶體結(jié)構(gòu),在計算機的輔助下進行合理優(yōu)化,藥物的研發(fā)變得如此清晰。高通量篩選(High Throughput Screening,HTS)、虛擬篩選(Virtual Screening)、基于結(jié)構(gòu)的藥物設(shè)計(Structure-based Drug Design,SBDD)以及基于片段的藥物設(shè)計(Fragment-based Drug Discovery,F(xiàn)BDD)逐漸成為小分子藥物研發(fā)的常見技術(shù)。這些技術(shù)取得了很大的成功,也仍然在不斷豐富和發(fā)展中,然而小分子藥物發(fā)現(xiàn)的效率并沒有如人們期待的那樣大幅提高。近幾年小分子領(lǐng)域也在出現(xiàn)諸多新的思路,實現(xiàn)新的突破,小編認為小分子可能在如下幾個方面實現(xiàn)突破:PROTAC技術(shù)、分子膠、變構(gòu)調(diào)節(jié)、老藥新用。
1. PROTAC技術(shù)
PROTAC(Proteolysis Targeting Chimera,蛋白降解靶向嵌合體)是一種雙功能小分子,由靶蛋白配體和E3泛素連接酶配體通過Linker連接得到,利用泛素-蛋白酶系統(tǒng)識別、結(jié)合并降解疾病相關(guān)的靶蛋白。該技術(shù)最早由Raymond Deshaies等人在2001年提出,理論上可以將任何過表達和突變的致病蛋白清除,從而治療疾病。
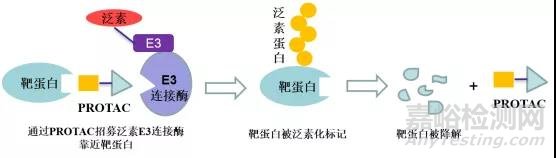
圖3 PROTAC作用機理圖示
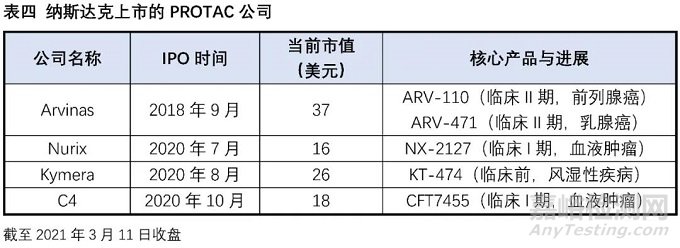
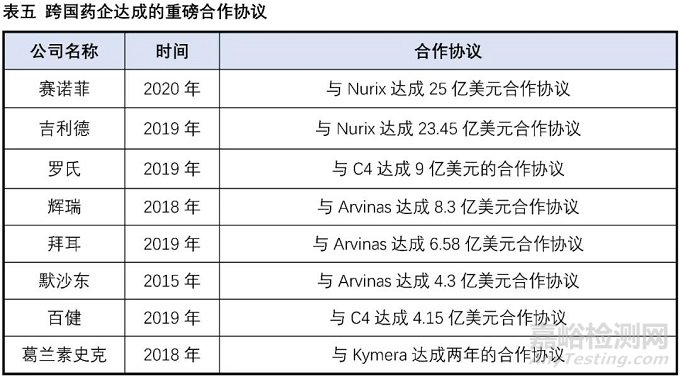
實際在臨床上也有部分藥物被意外發(fā)現(xiàn)具有降解靶蛋白的作用:比如乳腺癌治療藥物氟維司群可以降解雌激素受體;來那多胺可以特異性降解轉(zhuǎn)錄因子IKZF1和IKZF3;第三代EGFR抑制劑奧希替尼也能選擇性誘導(dǎo)EGFR-T790M的降解。這些意外的發(fā)現(xiàn)沒有普適性,也較難通過合理設(shè)計來得到。PROTAC作為主觀設(shè)計的降解靶標(biāo)蛋白的小分子,在腫瘤、自身免疫性疾病領(lǐng)域已經(jīng)取得了驚人的進展,同時在“不可成藥靶點”與當(dāng)前療法耐藥患者治療中表現(xiàn)出巨大的潛力,獲得了科學(xué)界和資本市場的廣泛認可,目前已有多家PROTAC公司登陸納斯達克,多家跨國藥企也積極參與布局該賽道,達成了多筆重磅合作協(xié)議。PROTAC技術(shù)戴著“明星光環(huán)”前行,是否能夠帶領(lǐng)小分子藥物再度崛起,取決于未來幾年相關(guān)產(chǎn)品的臨床進展。
2. 分子膠
分子膠(Molecular Glues)是一類可以誘導(dǎo)或穩(wěn)定蛋白質(zhì)間相互作用的小分子化合物。當(dāng)其中一個蛋白質(zhì)分子為泛素連接酶時,分子膠可以引起另外一個蛋白質(zhì)發(fā)生泛素修飾,并通過蛋白酶體途徑發(fā)生降解,與PROTAC有異曲同工之妙。經(jīng)典的分子膠降解劑如沙利度胺類似物和芳基磺酰胺類抗癌藥Indisulam等都是利用E3泛素連接酶與靶蛋白之間的互補蛋白-蛋白作用界面,重編程泛素連接酶的選擇性,以催化劑的方式驅(qū)動靶點泛素化。因此,分子膠也巧妙地避開了傳統(tǒng)抑制劑的局限性,使得一部分靶點從“無成藥性”變?yōu)?ldquo;有成藥性”,同時分子膠相比PROTAC有更小的分子量,理論上會有更好的成藥性。早期發(fā)現(xiàn)的分子膠也多是偶然所得,近年來主動設(shè)計的分子膠也取得了不錯的進展。2020年11月,禮來制藥與萬春醫(yī)藥子公司萬春Seed完成簽署總金額達到7.9億美元的合作,將借助Seed自主研發(fā)的獨特分子膠蛋白降解專利技術(shù)開發(fā)候選新藥。2020年12月,分子膠技術(shù)公司Neomorph宣布完成1.09億美元的A輪融資,用以推進專有的靶向蛋白降解平臺以及相關(guān)項目的發(fā)展。同月,勃林格殷格翰也在分子膠領(lǐng)域有所布局,與Proxygen簽訂了合作和授權(quán)協(xié)議,共同開發(fā)靶向多種致癌靶點的分子膠降解劑。2021年3月,Monte Rosa Therapeutics宣布完成9500萬美元的C輪融資用于將其主要分子膠產(chǎn)品推入臨床,加速管線發(fā)展并增強平臺能力。
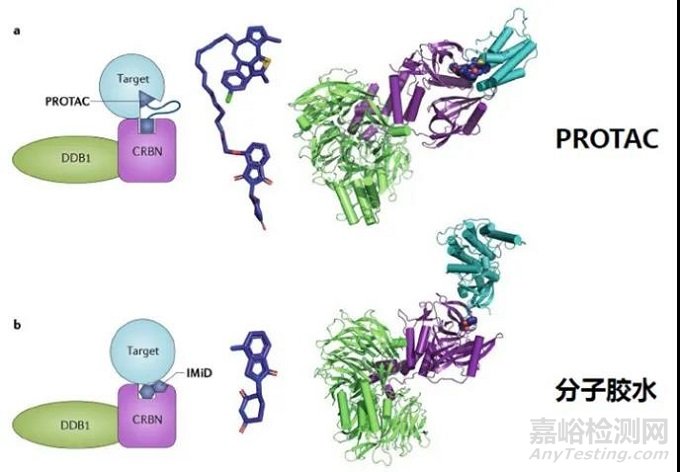
圖4 PROTAC與分子膠水作用機理比較
3. 變構(gòu)調(diào)節(jié)
變構(gòu)調(diào)節(jié)(Allosteric Regulation)通過特異性影響蛋白構(gòu)象變化,從而將其穩(wěn)定在某個非活化或活化狀態(tài),這與傳統(tǒng)的底物競爭性抑制劑比如ATP競爭性激酶抑制劑有所不同。變構(gòu)調(diào)節(jié)中有一個有趣的“胖子理論”,以激酶抑制劑設(shè)計為例,激酶底物比如ATP與酶活性中心結(jié)合緊密,就像是一個胖子坐在一把椅子上。傳統(tǒng)的競爭性抑制劑要把這個胖子拉起來,需要更大的力氣,也就是更高的親合力。而變構(gòu)抑制劑則是在椅子的某處扎了一根釘子,胖子自己就跳起來了,并不需要多大的力氣。變構(gòu)調(diào)節(jié)因為其“四兩撥千斤”的獨特機制,不僅具有更好的選擇性、安全性和克服耐藥的潛力,還能使得一部分靶點從“無成藥性”變?yōu)?ldquo;有成藥性”,引起了眾多科研機構(gòu)和制藥企業(yè)的重點關(guān)注。隨著結(jié)構(gòu)生物學(xué)的發(fā)展,變構(gòu)位點的確認變得相對容易,也進一步推動了變構(gòu)調(diào)節(jié)小分子藥物的開發(fā)。
諾華的BCR-ABL1變構(gòu)抑制劑Asciminib,與BCR-ABL1蛋白的肉豆蔻酰基位點結(jié)合(非ATP結(jié)構(gòu)位點),通過不同于其他BCR-ABL1激酶抑制劑的機制將BCR-ABL1鎖定為無活性構(gòu)象。Asciminib在用于曾接受過兩種以上酪氨酸激酶抑制劑(TKI)治療,并且對最近接受的TKI治療產(chǎn)生耐藥性或不耐受的慢性髓系白血病(CML)患者的3期臨床試驗的初步分析中達到主要臨床終點,并于近期獲得FDA授予的2項突破性療法(Breakthrough Therapy)資格。最近兩年比較火熱的KRAS抑制劑(如AMG510,臨床III期,已提交上市申請)、SHP2抑制劑(TNO155,臨床II期)都是相應(yīng)靶點的變構(gòu)抑制劑,均是“不可成藥靶點”的偉大突破。
4. 老藥新用
“The best way to discover a new drug is to start with an old one”,這是1988年諾貝爾生理學(xué)或醫(yī)學(xué)獎獲得者藥理學(xué)家James Black提出的,簡而言之就是“老藥新用”。“老藥”是指已上市的藥物或正在進行臨床試驗的藥物,“新用”是指發(fā)現(xiàn)在新的適應(yīng)癥上使用這些藥物。
阿司匹林于1899年在美國被發(fā)明,作為解熱鎮(zhèn)痛藥的應(yīng)用已有百余年,隨著臨床研究的不斷深入,阿司匹林的許多新功效和新作用逐漸被發(fā)現(xiàn),特別是其心血管疾病預(yù)防和治療中的作用。《中國心血管病預(yù)防指南(2017)》中開始將低劑量阿司匹林作為心血管疾病預(yù)防的基礎(chǔ)藥物。臭名昭著的沙利度胺同樣也是老藥新用的經(jīng)典案例,20世紀(jì)50年代沙利度胺(商品名:反應(yīng)停)成功在歐洲上市,在短短幾年時間里就造成了全球上萬例新生兒畸形(海豹胎),成為藥物史上最大的悲劇之一,使得該藥品于1963年被迫退市。1964年醫(yī)生在給麻風(fēng)病患者使用時,結(jié)果意外發(fā)現(xiàn)沙利度胺可以有效地減輕患者的皮膚癥狀。20世紀(jì)90年代又陸續(xù)發(fā)現(xiàn)了抗炎、抗腫瘤作用,1998年沙利度胺被FDA批準(zhǔn)用于多發(fā)性骨髓瘤的治療。西地那非(商品名:萬艾可)最初開發(fā)是用于擴張心血管平滑肌以擴張血管治療心絞痛,但是療效不盡人意,同樣的作用機制,臨床上發(fā)現(xiàn)其對陰莖海綿體平滑肌的舒張作用卻很顯著。1998年,F(xiàn)DA正式批準(zhǔn)西地那非用于勃起功能障礙治療。
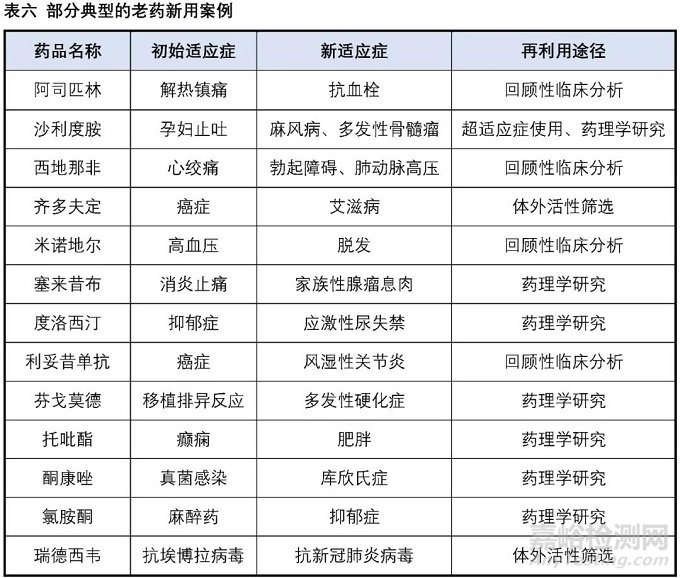
過去幾十年里,與阿司匹林、沙利度胺、西地那非等藥物一樣,“老藥”改變用途成為“新藥”的成功案例也不在少數(shù),為患者與制藥公司都帶來不可估量的獲益。2020新型冠狀病毒肺炎疫情中,“老藥新用”也同樣發(fā)揮了重要的作用。新冠疫情來得非常突然,想要從頭設(shè)計獲得一個全新的抗新冠病毒藥物用于疫情的控制顯然是來不及的。除了抓緊研發(fā)新冠疫苗,也有非常多的科學(xué)家希望能從現(xiàn)有的上市的或者進入臨床后期的化合物中進行篩選,找到潛在的新冠治療藥物。抗瘧藥如羥氯喹,抗病毒藥物如洛匹那韋、利托那韋、利巴韋林等,也包括了“人民的希望”-瑞德西韋都開展了針對新冠的臨床試驗。美國FDA于2020年5月1日宣布授予瑞德西韋緊急使用授權(quán)(EUA)治療COVID-19患者,雖然最后的治療效果并不是那么理想,但也為阻止全球新冠疫情的進一步惡化起到了一定的積極作用。
4展望
在氘代藥物、共價抑制劑、多肽藥物等發(fā)展相對成熟的技術(shù)方面,小分子藥物也很有可能迎來突破。隨著人工智能(AI)技術(shù)的不斷成熟以及在新藥研發(fā)中的不斷滲透,人工智能在靶點發(fā)現(xiàn)、苗頭化合物與先導(dǎo)化合物發(fā)現(xiàn)、藥物分子合成路線設(shè)計、疾病模型建立、新適應(yīng)癥挖掘等諸多方面助力新藥研發(fā),將大大提高新藥的研發(fā)效率。近日,AI制藥巨頭強強聯(lián)合,Roivant擬以20.5億美元收購Silicon Therapeutics(首付款4.5億美金+里程碑付款);國內(nèi)互聯(lián)網(wǎng)巨頭BAT(百度、阿里、騰訊)近年來也投入大量精力積極布局AI藥物發(fā)現(xiàn),相信借助人工智能技術(shù)不論是小分子藥物還是大分子藥物都能迎來蓬勃發(fā)展的時機。小分子藥物有其難以替代的優(yōu)勢,它的發(fā)展也是困境與突破交替輪動的歷史,隨著各種新科技的不斷涌現(xiàn),我們也期待能有更多的“黑科技”助力小分子藥物研發(fā)的突破,給世界帶來更多的驚喜。
勇當(dāng)主角,甘當(dāng)配角。小分子藥物在藥物發(fā)展史的中一直擔(dān)任“主角”,隨著各種生物技術(shù)療法的日益豐富與成熟,疾病的治療手段必然會呈現(xiàn)百花齊放的趨勢。近年來聯(lián)合用藥也逐漸成為臨床試驗發(fā)展的趨勢,特別是腫瘤免疫療法的興起,更是進一步推動了聯(lián)合用藥方案的嘗試與突破。我想未來在某些疾病領(lǐng)域小分子藥物依然會是“主角”,在另一些領(lǐng)域小分子藥物可能真的會逐步被取代直至淘汰,在更多的領(lǐng)域?qū)⑹切》肿铀幬锱c生物技術(shù)療法的“強強聯(lián)合”,從而更好地為患者排憂解難。

來源:培優(yōu)創(chuàng)新論壇


