您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-07-07 23:09
口腔崩解片因服用方便、口感好、起效迅速、生物利用度高等優點在口服制劑研發領域得到了 廣泛關注,其制備工藝隨著制劑技術的進步也得到了長足發展。針對口腔崩解片存在的問題,近年來大量新 興制劑新技術也相繼被研發應用,為新型口腔崩解片的制備提供了多種選擇,也為新制備工藝的研發提供了新思路。
本文通過對近年來用于口腔崩解片制備的制劑新技術研究進展進行綜述,為研發可滿足不同臨床 需要的口腔崩解片提供理論指導,為該劑型制備技術的進一步發展提供一定的參考與借鑒。
口腔崩解片( orally disintegrating tablets,ODT) 又稱口崩片,系指在口腔內不需要用水即能迅速崩 解或溶解的片劑。該片劑要求在口腔內迅速崩解或 溶解、口感良好、容易吞咽,對口腔黏膜無刺激 性[1]。口腔崩解片中的藥物主要通過腸道黏膜吸收,部分藥物可以通過口腔黏膜吸收,具有吸收快、起效迅速和生物利用度高等優點。
口腔崩解片是近 年來研發的一種新型固體速釋與速效制劑,已成為 繼咀嚼片和分散片后片劑研究與開發的熱點。該類 制劑不僅為速效制劑研發提供了新思路,也為特殊 患者的臨床用藥開辟了新途徑,特別適合兒童、老年 人、患有精神疾病或者吞咽困難不愿配合的患者和 需在特殊環境作業的人員服用[2-3]。
國外研究人員從20 世紀 70 年代末開始研究制 備口腔崩解片,經過多年實踐,目前應用于制備口腔 崩解片的制備技術與方法層出不窮,如冷凍干燥、噴霧干燥、濕法制粒壓片、干法制粒壓片、直接壓片和 模制法等在生產應用中已十分成熟,也有文獻對其制劑特點、臨床應用、制備技術與工藝等進行了綜 述[4-11]。近年來隨著該劑型藥品數量的增多,越來 越多的藥物被研發為口腔崩解片,國外相關上市 品種有 60 多種,目前我國也有 30 余種批準上市, 主要品種見表 1。

隨著口腔崩解片制備技術的不 斷改進和創新,針對口腔崩解片普遍存在的載藥量低、硬度小、口感差等問題,創新技術也呈多元 化發展。本文對近年來發展的口腔崩解片制劑新 技術進行綜述,以期為制備工藝和技術的再創新 和優化提供參考借鑒,解決困擾口腔崩解片制劑 發展的相關問題,不斷促進該劑型制備技術日趨完善。
1. 控制口腔崩解片載藥量的制劑新技術
1.1 直接壓片法
直接壓片法是將藥物和適宜輔 料充分混合均勻后不經過濕或干處理直接壓片的制 備方法。該制備技術簡單易于控制、高效低能耗、運行成本低廉,適于大規模生產,而且不同于常規的濕 法制粒壓片和干法制粒壓片法,可負載高劑量的藥 物,是口腔崩解片提高載藥量的重要方法[4]。
該方法制備出的口腔崩解片的質量主要依靠輔料本身的特性和輔料間的作用。因此,直接壓片法對輔料性 質要求較高,除具備較強的崩解性能外,還要有較高的流動性和可壓性。微晶纖維素( MCC) 分子結構 具有多個羥基,可壓性和流動性好,且當 MCC 含量超過 20%時,崩解效果也較好,是直接壓片法的常用填充劑,可加速口腔崩解片的崩解。
Gulsun 等[12] 分別以低取代羥丙基纖維素( L-HPC) 為崩解劑, MCC 為填充劑,阿斯巴甜為矯味劑,硬脂富馬酸鈉為潤滑劑。與藥物混合均勻后,采用直接壓片法制備得到呋塞米口腔崩解片。利用輔料自身特性和配比的優化,使其每片載藥量可達 80 mg,甚至高于口服常規制劑的劑量。
1.2 棉花糖技術
棉花糖技術是以瑞士 Fuisz 公司 研發的 Flashdose技術為基礎,利用獨特的旋轉機械裝置將多糖類輔料通過閃溶和離心力的處理制成類似棉花糖的多孔絨狀物,在快速熔融和旋轉的同時形成多糖基質,部分多糖基質經重結晶后粉碎,與藥物和其他輔料混合后直接壓片,制成口腔崩解片。采用 Flashdose技術所得多糖基質改善了其 流動性和可壓性,具有令人滿意的機械強度,而且可負載大劑量的藥物,但熔融基質時所需的高溫限制了這種技術在熱敏感藥物口腔崩解片制備中 的應用[11,13]。
1.3 3D 打印技術
3D 打印是在計算機設定的參 數下將藥物與物料粉末層層疊加打印,再以潤濕 液黏結成型的制備新技術( 見圖 1) 。口腔崩解片的 3D 打印過程簡單快速,主要通過軟件設計和特 定參數設置控制片劑性狀和大小來實現制劑的個體化分劑量,可以制備出性能優良、劑量可控的片劑,為藥物劑型設計在實現個體化醫療方面提供了 新的思路[14-15]。
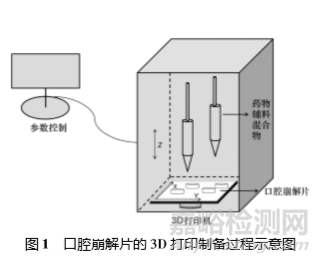
Tian 等[16]將華法林鈉、 D-蔗糖、預 糊化淀粉、聚維酮 K30、 MCC 和二氧化硅( 重量比為 1 ∶42.45 ∶46.15 ∶5.1 ∶4.9 ∶0.4) 混合作為 3D 打印機的 打印粉,使用預設參數準確打印制得 3 種不同劑量 的華法林口腔崩解片。
Fina 等[17]將 3D 打印技術與 激光燒結技術結合,在控制劑量的同時,通過調節激 光燒結的參數可以改變片劑的釋藥特性,當激光掃描速度達到 300 mm·s-1 時,含有聚乙烯吡咯烷酮 ( PVP) 的打印片具有更優的口腔崩解特性,能夠在 4 s 內完全崩解。2015 年,癲癇治療藥物 Spritam作 為第一個采用 3D 打印技術生產的口腔崩解片被 FDA 批準上市,證實了 3D 打印技術制備口腔崩解片的可行性和準確性[17]。
2. 改善口腔崩解片口感的制劑新技術
2.1 包合物技術
包合物技術是將藥物分子全部 或者部分包藏于另一種分子的空穴結構內形成復合 物的制劑技術。包合作用的外層分子以環糊精及其 衍生物最為常用。由于藥物被包裹在包合物內,使 得藥物不會直接接觸味蕾,起到了掩味的作用。包合物技術制備的是一種制劑中間體,其可以繼續與 其他輔料混合制備口腔崩解片。
Ainurofiq 等[18]在 不同摩爾比下,以 β-環糊精為包合材料通過共沉 淀、噴霧干燥法制成美洛昔康/β-環糊精包合物,然 后與羧甲基淀粉鈉( CMS-Na) 、 MCC、甘露醇、硬脂富 馬酸鈉混勻,直接壓片制得美洛昔康/β-環糊精包合 物口腔崩解片。該口腔崩解片克服了美洛昔康常規 劑型味苦、口感差的缺點,提高了患者依從性。
2.2 固體分散體技術
固體分散體技術是將藥物 高度分散在適宜載體材料中形成固體分散體系的制 劑技術。該技術利用載體的包蔽作用減少藥物在口腔內的暴露量,進而掩蓋藥物的刺激性味道,同時還能減緩藥物的氧化水解,提高藥物的穩定性。Song 等[19]將普伐他汀鈉、碳酸氫銨和甘露醇的水溶液經 噴霧干燥制備普伐他汀鈉固體分散體顆粒,再與其他輔料直接壓片制得普伐他汀固體分散體口腔崩解 片,有效地掩蓋了普伐他汀較強的苦味,而且崩解時 間為 12 s, 30 min 內溶出度可達 95%。
2.3 離子交換樹脂復合物技術
離子交換樹脂是 含有可以電離基團的高分子聚合物。在一定 pH 條件下,藥物通過離子交換吸附在樹脂上,形成藥物樹脂復合物。由于口腔內唾液量少,藥物樹脂復合物還未解吸附即刻便進入胃中,口腔內藥物濃度低于 味覺閾值,產生掩味作用[20-21]。
Wu 等[22]使用乙醇 溶液作為離子交換反應介質制備莫沙必利離子交換樹脂,以 L-HPC、 MCC、甘露醇為輔料經直接壓片, 制備得到莫沙必利離子交換樹脂口腔崩解片。該口腔崩解片崩解后所得藥物樹脂復合物在口腔內難以完全解吸附,因此可有效掩蓋莫沙必利在口腔內的 苦味。藥物樹脂到達胃后與 H+ , Na+ , Ka+ 進行交換 解吸附,釋放出藥物,同時也可提高莫沙必利的溶 出度。
2.4 微囊化技術
微囊化技術是利用天然或者合 成的高分子材料為囊材,將藥物包裹或者分散在高 分子材料中制成微囊或微球的制劑技術[23]。所得 微囊或微球可與崩解劑、矯味劑、潤滑劑、填充劑等 輔料混勻后壓片,制得口腔崩解片。天然高分子囊 材如明膠、海藻酸鹽等因其穩定、無毒、成膜性好的 優點,是最常用的載體材料。近年來,合成高分子材 料也得到了迅猛發展,常用囊材有丙烯酸樹脂( Eudragit) 、聚乳酸( PLA) 等。
采用微囊化技術制備的 口腔崩解片能夠將藥物包裹在微囊或微球內,有效 掩蓋藥物的不良氣味,提高藥物的穩定性。張艽等[24]以 Eudragit E100 為囊材,MCC 和交聯聚維酮 ( PVPP) 為混合崩解劑,制備得到鹽酸小檗堿微囊 口腔崩解片。所得口腔崩解片兼具微囊和口腔崩解 片的優點,鹽酸小檗堿被包裹在 Eudragit E100 囊材中,起到了掩味效果。該口腔崩解片口感良好,平均 崩解時間為( 22±5) s,在 pH 為 1.0 和 2.0 的酸性介 質中 10 min 內溶出超過 70%。
2.5 擠出法
擠出法是用水溶性的聚乙二醇和甲醇的混合溶液把藥物和輔料的混合物進行軟化處 理,并通過擠出機或注射器排出軟化的物料,得到圓柱形擠出物,最后使用加熱的刀片將其切成均勻的小段得到片劑( 見圖 2) ,也可將上述小段粉碎后進 行再壓制得到相應片劑。
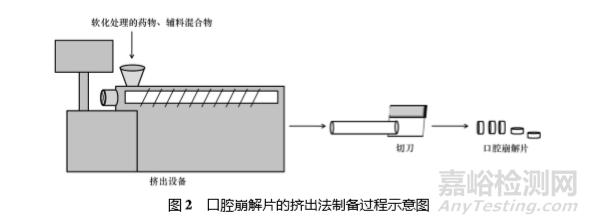
該方法所得口腔崩解片可 有效掩蓋藥物的不良味道。Rajan 等[25]將甲基丙烯 酸鹽共聚物和不同比例的 Eudragit E100 采用擠出法對有強烈苦味的尼扎替丁進行掩味處理,成功制備得到了能夠快速崩解的口腔崩解片,崩解時間為 34 s,藥物在模擬胃液中15 min 溶出度為 99.5%。
3. 提高口腔崩解片硬度的制劑新技術
3.1 真空干燥法
真空干燥法是以冷凍干燥法為 基礎,在除掉非結合溶劑的初次干燥過程中,使用低氣壓,并保持溫度在崩塌溫度以上、平衡冷凍點以 下,使非結合性溶劑從固態經過液態轉變為氣態,而 非直接從固態升華為氣態[6]。冷凍干燥法是研究最早的口腔崩解片制備方法,是將藥物溶解或分散在適宜基質中,把制得的溶液或混懸液滴入一定模具,于低溫低壓下凍結成固體,經真空干燥條件處理直接升華除去水分制得。
冷凍干燥法制備的口腔崩 解片結構疏松、孔隙率大、密度小、崩解速度快,但片 劑硬度差、容易裂片、易磨損破碎,且對生產設備和生產條件要求嚴格,生產成本高[7]。與冷凍干燥法制得的口腔崩解片相比,經真空干燥法制備的口腔 崩解片孔隙率小,崩解時間略長,但其完整性更好, 硬度得到明顯提高。
3.2 固態溶液技術
固態溶液技術也是基于冷凍 干燥法的一種衍生新技術,同樣適用于熱敏性藥物。該技術制備出的口腔崩解片硬度明顯高于冷凍干燥 法制備的片劑。該技術將明膠、果膠、黃原膠、羥乙基纖維素、甘露醇等骨架材料溶解在第1 溶劑中,降低溫度至低于或等于第 1 溶劑的凝固點,冷凍固化 第1 溶劑后,加入第 2 溶劑置換出第 1 溶劑,揮發出 去殘余的第 2 溶劑,得到具有高孔隙率的空白骨架, 再將藥物溶液加入載有空白骨架的模具中,經真空 干燥除去相應溶劑后,制得口腔崩解片。
藥物可以根據其溶解性選擇在空白骨架制備前或制備后加 入。該技術對溶劑要求較為苛刻,第 1 溶劑需滿足 能夠溶解骨架材料,且與第 2 溶劑互溶,常用溶劑為 水和聚乙二醇等。第 2 溶劑應與骨架材料不溶,凝 固點低于第 1 溶劑,但揮發性高于第1 溶劑,常用溶 劑為無水乙醇和異丙醇等[8,26]。Gole 等[27]用明膠、 甘露醇、阿斯巴甜為骨架材料,以水為第 1 溶劑,無 水乙醇為第 2 溶劑,制得硬度明顯高于普通冷凍干 燥法的氟哌啶醇口腔崩解片。
3.3 微波輔助照射技術
微波輔助照射技術是基 于模制法的一種新技術。模制法是口腔崩解片的常 用制備方法,是將藥物粉末與輔料提前用水或者乙 醇潤濕,壓入模板中形成濕潤團塊,再經低壓干燥, 或者將藥物直接溶解或混懸在熔融基質中,常壓下蒸發掉基質中的溶劑制得口腔崩解片。
該方法的缺點在于制備的口腔崩解片硬度一般較差,而且片劑硬度的提高常常使崩解時間延長、溶出速率降低。Kande 等[28]在模制法的基礎上將初步制成的藥片 經加濕處理后再進行微波輔助照射,制備得到拉莫 三嗪口腔崩解片,其硬度>5 kg·cm-2,崩解時間<30 s, 5 min 時體外溶出度幾乎可達 100%。
Tanaka 等[29]以甘露醇、糖醇為稀釋劑,利用微波輔助照射 技術制備得到含有魚鱗苷 A( CFA) 和魚鱗苷 B ( CFB) 的口腔崩解片。制備過程中,當微波照射 3 min 后,片劑溫度可升高至 140 ℃,含甘露醇的濕 藥片內部形成水蒸氣,導致氣孔膨脹,形成空泡狀穴網,這些新形成的空泡穴網能夠被水滲透,使崩解時 間<30 s。而且在微波照射過程中形成的水蒸氣也 使得部分甘露醇顆粒溶解,藥片內部顆粒間形成新 的固態交聯,降低崩解時間的同時,顯著提高了口腔 崩解片的硬度。
3.4 高壓二氧化碳輔助技術
傳統制備工藝中,為 了制得良好硬度的片劑,口腔崩解片制備中需要經 過壓制處理。高壓成型往往會損壞片劑中用于掩味 和有持續釋放功能的涂層顆粒。高壓二氧化碳輔助技術是一種不依賴于高溫、高濕和高壓縮力的新制備技術。
Kobayashi 等[30]利用高壓二氧化碳無毒、 不可燃且能夠溶解藥物和輔料的特性,在低壓縮力 下對藥物輔料混合物進行壓片,然后通過高壓二氧 化碳處理以降低聚合物輔料的玻璃化轉變溫度 ( Tg) ,使得聚合物粒子間相互交聯,從而顯著增加 口腔崩解片的硬度。而且該制劑新技術的出現也為 高溫、高濕和高壓條件下不穩定藥物口腔崩解片的。
4. 結語
雖然目前報道的口腔崩解片的制備工藝多種多樣,但在實際生產中所使用的制備技術仍是較為經典的方法,這些制備技術雖工藝穩定,但也各有缺 陷,所得口腔崩解片普遍存在載藥量低、口感差、硬度小等問題。
隨著制劑新技術的不斷引入和創新, 在口腔崩解片具體制備時可根據原料藥的理化性質 與穩定性、輔料特點和實際臨床用藥特點與需求來 選擇較為合適的制備技術與方法。在控制載藥量方 面,可以選用直接壓片法、棉花糖技術和 3D 打印技 術提高其載藥量,但設計片重不宜過大,以免影響患 者用藥依從性。
2007 年 FDA 發布的口腔崩解片指 導原則建議其重量不宜超過 500 mg。在改善口感 方面,除在處方中加入適宜的矯味劑之外,可采用包 合物、固體分散體、離子交換樹脂、微囊化等制備新 技術達到掩蓋藥物的不良味道和沙礫感的效果。在 提高硬度方面,模制法聯合微波照射技術和高壓二氧化碳輔助技術可有效實現在低壓縮力條件下顯著 提高口腔崩解片的硬度。
近年來,大量制劑新技術不斷涌現與發展,在已應用成熟的口腔崩解片制備 工藝基礎上聯合新的制劑新技術可明顯改進口腔崩解片存在的一些問題,但也存在制備工藝較為復雜、 能耗成本高等局限性,部分制備工藝還處于實驗室 研發階段,將其應用于實際生產仍需大量研究工作要做。
隨著制劑新技術的進一步發展和口腔崩解片相關制備技術的完善,有望研發出應用廣泛、簡單易行、節能低耗、穩定可控的可滿足相關臨床需要的口腔崩解片制備工藝。

來源:Internet


