您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-03-19 07:27
一直以來,對“設計空間”這個概念充滿著好奇,總想深刻地掌握它,但是又不甚了解,無法在實驗中進行具體的把握,正如大家所知道的那樣,研發是比較有意思的,但過程確是那樣的繁瑣,你通過試驗做出來了自己所期望的結果,當然這個結果也并非是百分之百能達到預期,但總歸是朝著好的方向發展。就這樣不斷摸索優化,最終解決產品開發的階段性成果。其實,對于一名研發人員,無不希望這自己所設計開發的處方、工藝以及分析方法是好用的、耐用的,能夠穩健的進行商業化生產,滿足市場需求。這才是一名研發人員值得欣慰的地方,但事實總是不那么完美展現,因為沒有什么是不變的,任何的設計思路,也可以說是開發思路總是研究人員對當時產品的理解深度而呈現出來的,隨著對產品的理解加深,對產品的把控也就越來越好,那么設計空間也就會發生變化,設計空間雖然不是一層不變的,但它能夠滿足一段時間的需求。下面我就來說一下設計空間(因為個人能力的局限性,我只是收集整理了有關設計空間的知識以供大家了解)
1、什么是設計空間
設計空間(Design Space):設計空間是已被證明能保證產品質量的輸入變量(如物料屬性)和工藝參數的多維組合和交互作用的范圍。
設計空間是通過對知識空間的風險評估和實驗研究而得到的。知識空間是關于過程或系統的全部信息,這部分信息或知識可以是經驗理解,也可以由實驗和文獻調研等方式獲取。知識空間之外代表尚未探索的未知領域。知識空間中符合要求的輸入變量與工藝(或方法)參數的多維組合構成設計空間。由于設計空間的邊界存在一定的不確定性,為保證能夠持續可靠地生產出合格或產生高質量分析數據,往往在設計空間的范圍內建立一個控制空間。

設計空間是與PAR(被證明的可接受范圍)和NOR(正常運行范圍)之間是有區別的。既然說到這里了,那就說一下PAR和NOR。PAR(被證明的可接受范圍)是在保持其它參數不變的前提下,對單個變量的范圍進行考察。操作應在此范圍內進行,當保持其他參數恒定時,在此參數范圍內操作將生成符合相關質量標準的產品。如下圖,綠色區域代表建立的整個設計空間,由于PAR未評估輸入(物料屬性、工藝參數等)之間的關系和相互作用,由兩個參數獲得的PAR范圍組合(橙色區域,其部分范圍位于不合格區域)并不與設計空間完全等同。

NOR(正常運行范圍)描述的是目標操作條件鄰近范圍,其中包括正常的操作波動(波動并不總能控制)。如下圖,在其中間確定一個設定點,該設定點設置的一個鄰近范圍稱之為正常運行范圍。正常運行范圍是在被證明的可接受范圍內被定義的范圍,用在生產操作指南中作為一個工藝參數能夠被控制的目標和范圍,在此范圍內,生產單元操作的物料和最終產品能夠符合放行標準和CQAs的要求。

2、為什么要“設計空間”
以往,我們只提交每個參數的正常運行范圍,在該范圍以外的任何改變將表示批次失敗,或者必須在變化實施之前提交并獲批補充申請。而應用批準的設計空間,任何在正常運行范圍外而在設計空間范圍內的變化均可接受。在設計空間內的變動,在監管上不被視為變更。比如,壓片時,設計空間在30-70N進行控制,40-60N進行生產,以后想變更到50-70N進行生產,不需要向官方提出變更申請。而一旦超出設計空間,則應視為變更,并應啟動上市后的變更申請。設計空間由申報者提出,送交管理當局審評并批準。可以說有了設計空間,既可以減少藥品企業注冊申報成本,也可以降低藥監部門的監管成本。正所謂大家好,才是真的好。
3、怎樣確定設計空間
設計空間具體上可分為處方設計空間、工藝設計空間和分析方法設計空間,處方設計空間是在處方篩選時運用的比較多,這樣能夠在前期增加對處方篩選可操作性的評估,一旦處方確定下來了,處方設計空間就很少使用了,因為實際的大生產中,處方只是一個固定的量,我們申報的時候也不可能把處方用量給寫成一個范圍吧,那樣也是不可行的。其實在在藥學研究中,設計空間更多的是指工藝設計空間和分析方法設計空間。工藝設計空間(Process Design Space):是經驗證能保證產品質量的輸入變量(如物料屬性)和工藝參數的多維組合和相互作用。分析方法設計空間(Analysis Method Design Space):是經驗證能保證分析數據質量的輸入變量(如材料屬性)和分析方法參數的多維組合和相互作用。
對于分析方法的設計空間來說,一般按照從外向內的順序進行設計空間的探索。首先,根據經驗、知識、資料或文獻等得到一個理論空間,方法開發過程中可能得到多個控制空間,不同的控制空間有不同的控制策略,這些控制空間總稱就是理論空間。而在理論空間之內存在一個保證方法穩健性和耐用性的設計空間;在設計空間內通過實驗設計和驗證得到一個穩健的操作空間;而按質量標準或規定在操作空間內確定一個嚴格的控制空間,屬于一個公認的質量控制范圍。

對于工藝設計空間來說,由于工藝設計空間依賴于生產規模,在實驗室小試規模中或中試規模確定的設計空間可能不適用于商業化大生產。這是因為通常對單元操作原理的理解是有限的,規模擴大在很大程度上是基于一般的經驗及試錯方法。所以,如果工藝過程存在放大效應,則應確定在放大過程中起主導作用的因素,并建立不同規模之間的放大關聯模型,以避免或減少放大風險。但如對操作原理等充分理解時,設計空間也可以跨規模平移,此外,工藝設計空間還與制藥設備有關。同一工藝采用不同類型的設備,所建立的工藝模型和設計空間可能會有所不同。所采用的步驟包括:1、通過科學的和基于風險的方法,確定產品的CQA(Critical Quality Attribute).這是設計空間建立的前提。2、模型設計——構建設計空間的基礎。此過程是確定輸入變量、工藝參數與輸出響應之間關系的過程。3、設計空間的展示。要對所研究的制藥過程進行進行充分的科學描述,總結與之關聯的文獻資料和歷史數據,濾除不必要和關聯性小的信息。在此基礎上,對設計空間的研究和(或)實驗設計的科學性進行充分論證,再采用規范通用的語言闡述屬性和參數的評價過程以及模型設計的過程和結果,并重點說明工藝過程的CMA(Critical Material Attributes)、CPP(Critical Process Parameter)和產品CQA之間的關系。
4、采用適當的工具,如圖示(等高線圖或等高線重疊圖)或數學方程式等,將設計空間予以展示。
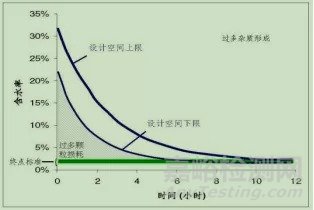
比如濕顆粒干燥步驟的設計空間取決于溫度和/或壓力隨時間變化的路徑。含水率終點為1-2%。在高于設計空間上限時運行會導致過多雜質形成,而在低于設計空間下限時運行會導致過多顆粒損耗。
下面是關于設計空間開發的流程(可供參考):

4、“設計空間”的適用條件
設計空間僅適用于特定的條件,包括:1、適當定義的輸入變量的質量屬性。2、適當選擇的工藝參數或方法參數。3、適當選擇的產品CQA或方法關鍵性能特性。建立一個可以實際使用的設計空間需要開展更多的研究工作,如設計空間的構建方法、設計空間在不同規模和設備之間的傳遞、在設計空間內改變屬性或參數的風險及其與產品有效性和安全性的關聯、設計空間的可靠性和持續改進等。在工藝或方法生命周期中,隨著理解的不斷深入,設計空間可能會有變化,屬性或參數也有可能需要隨之修正。在工藝或方法生命周期某一階段建立的設計空間,僅代表當前對生產工藝或分析方法的最佳理解。
科學家錢學森曾說:“正確的結果,是從大量錯誤中得出來的,沒有大量的錯誤做臺階,也就登不上最后正確結果的高座”。此文章因為個人能力的局限性,只是作了一個簡單的陳述,如果是一個錯誤,希望正確的結果由您來得出。希望這方面的老師,能夠以“設計空間”這個話題,多寫些自己的見解,讓“設計空間”這個詞,在同行中深刻理解,并在實踐中得到普及應用。
參考文獻:
1、QbD與研發:概念與實例;
2、藥品研發Q8(R2);
3、Quality by Design for ANDAs:An Example for Immediate-Release Dosage Forms;
4、制劑研發人員使用QbD的終極目標(上、下);
5、QbD和原料藥工藝開發:一場化學和工程學的“聯姻”;

來源:CROU制藥在線


