您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-03-08 17:21
溶出度即指片劑、膠囊劑或顆粒劑等普通制劑在規定條件下溶出的速度和程度,在緩釋制劑、控釋制劑、腸溶制劑及透皮貼劑等制劑中也稱釋放度,它是一種模擬口服固體制劑在胃腸道中的崩解和溶出的體外試驗方法,根據Noyes-Whitney方程可知,影響溶出度的因素包括有藥物的溶出面積(可通過機械粉碎或氣流粉碎減小粒徑等增大溶出面積)、藥物的溶出速度常數(加強攪拌或提高藥物的擴散系數)以及藥物的溶解度(升高溫度、改變晶型、制成納米晶或固體分散物等)。體外溶出度被認為是連接體內外相關性的橋梁,是反映口服固體制劑處方工藝質量情況的一雙眼睛,對處方工藝的研究具有重大的指導作用。隨著質量源于設計(quality bydesign, QBD)理念在制藥行業中愈發重視,在難溶性藥物的新藥制劑開發過程中,我們要切記制劑樣品本身才是決定質量的關鍵因素,而溶出是產品質量體系中非常重要的一個項目。努力優化處方工藝,以藥物pH-溶解度為依據指導尋找具有區分力的制劑溶出曲線是制劑研發人員工作的重中之重。那么如何建立一個有效的溶出方法呢?
在進行溶出方法開發前,處方前研究是一個非常重要的工作內容,而處方前研究,是在已完成全面、充分的文獻調研基礎上開始進行的實驗研究,但以前很多研究者往往將其忽略在外,一上來就直奔主題,直接進行處方工藝研究,但欲速則不達,折騰一通可能還是回歸起點。處方前研究最主要的工作就是完成原料藥的BCS分類、滲透性、pH-溶解性試驗、以及原料在不同pH溶液中的穩定性、濾膜吸附性等試驗考察,在此基礎之上方可開發有效的溶出方法。溶出方法開發是基于陽性藥的藥動學信息、考慮原料藥的理化性質、劑型特點及穩定性因素,選擇合適的溶出實驗條件及裝置,具體內容包括:溶出介質及體積、轉速、表面活性劑、取樣時間點的篩選及溶出方法區分力的驗證。
1. 溶出實驗條件篩選
1.1 溶出介質選擇
溶出介質的合理選擇很大程度上依賴于對原料藥自身理化性質和胃腸道液性質的了解。
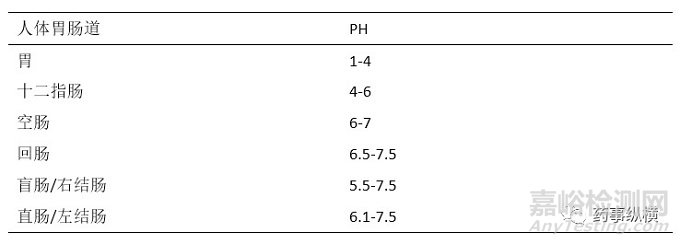
溶出介質一般采用pH1.0-6.8的水性介質,溫度為37℃±0.5℃,特殊情況下可采用更高pH值的溶出介質,一般不應超過pH8.0。溶出介質pH范圍的確定主要依據該藥物在體內吸收主要消化道部位的生理pH值。胃內pH值會隨著年齡增長而發生變化,這也就是為什么有些藥物在一部分人中很有效,而在另一些人中則無效的重要原因,可能就是胃內pH值不同,所以做溶出時不應該只做一個介質的溶出,而是做不同pH值的介質溶出曲線。當然,在小試研究階段溶出度重點是通過尋找最具有區分力的溶出條件進行不同處方工藝樣品的篩選考察,而不是一味的“扎進”溶出室對不同pH介質曲線進行無休止對比,要根據本制劑產品的特性“有所為而有所不為”。
1.2 溶出介質體積
溶出介質體積的選擇一般是根據藥物的溶解度和制劑規格確定的,以保證符合漏槽條件;常用體積一般為500、900和1000ml;藥物在介質中應具有較好的物理化學穩定性。
1.3溶出裝置(轉籃法與槳法)及轉速選擇
一般根據項目經驗,多采用USPⅡ法(槳法)或USPⅠ法(轉籃法)溶出裝置,片劑多選擇槳法,膠囊劑多用于籃法,轉速大部分在50~100rpm/min。籃法以100rpm/min為主,槳法以50rpm/min為主。若50 rpm低轉速槳法中溶出杯底部有結塊未崩散或圓錐形堆積(一般是由水不溶性輔料堆積所致),應考察75rpm,提高轉速可使輔料分散的更好,使溶出不受阻礙;在充分研究論證的基礎之上,選擇100轉速也是可以的。在溶出方法開發中一個好的診斷工具是在溶出試驗結束后增加一個高轉速---即在最后一次正常取樣點后,將轉速增加至150-250rpm維持15-30min再進行取樣,這樣做可以使溶出杯底部的圓錐形堆積被強制分散同時使未溶解的API的溶解。這種做法可以快速檢查制劑的含量,并確保溶出不是受到溶解度的限制或者低的溶出量不是由含量低引起的。
1.4表面活性劑篩選
對于水不溶性或難溶性藥物,可以考慮在介質中加入適量的表面活性劑使其溶解度增加。但選擇加入表面活性劑往往是“The last choice”,通常在確定加入表活之前,應進行以下研究:不含表面活性劑的常規介質及常規低轉速下(槳法50rpm或籃法100rpm)溶出曲線考察、提高轉速(75rpm、100rpm、150rpm)、增加采樣時間點考察,若在規定截止時間內,所有介質、方法的溶出度均達不到85%以上,則考慮加入表活。十二烷基硫酸鈉是首選的表活,因為不同來源的表面活性劑質量參差不齊,可能對溶出實驗結果帶來顯著影響,所以選擇SDS應使用高純度級并盡量固定廠家來源。
關于表面活性劑的使用量,在《普通口服固體制劑溶出曲線測定與比較指導原則》中規定:表面活性劑濃度推薦在0.01%-1.0%(W/V)范圍內依次遞增考察,特殊品種可適度增加濃度,此時應有研究說明。1.5 取樣時間點及溶出曲線測定
取樣時間點的確定主要根據制劑本身特性及方法追蹤處方核心屬性的能力。例如:若產品為快速溶出制劑,則應該縮短取樣時間間隔,可間隔5、10或15min取樣;若溶出較慢,可適當增加取樣間隔時間;若希望更好的研究或追蹤崩解效應,5min或10min時間點都是必須的。采樣時間點應確保產生足夠的樣品量,直至藥物溶出度達85%以上或達到溶出平臺。繪制得到的溶出曲線最好是有一定弧度的曲線,即開發出足夠多的時間點以充分表征上升期和平臺期,無拐點和突釋的溶出曲線。一定弧度的溶出曲線才能更科學、合理的橋接人體內的生物利用度,才能保證制劑具有更好的內在品質。
2.溶出方法區分力的驗證
溶出方法區分力即指通過溶出數據可以發現和區分固體制劑質量變化的情況。作為創新藥研發階段的溶出方法,體外溶出試驗必須具有良好的區分力:即當影響處方篩選或體內行為的處方/工藝參數發生變動時,可通過溶出結果判斷這些變動情況。創新藥在研階段影響制劑溶出因素可能包括:原料藥晶型、原料粒徑、輔料、制粒的硬度和粒徑分布及片劑硬度等,故具有區分力的溶出方法在前期處方工藝研究中占據重要比例,但是也要注意的一點是區分力的適度拿捏,不可無區分力,亦不可過度區分,創新藥在研階段最理想的區分力溶出條件即:可區分API晶型、粒徑、輔料類型及用量等變化所導致的溶出差異;可區分制粒、壓片階段關鍵質量參數發生變化所導致的溶出差異;可區分處方工藝變更、小試工藝放大、生產地點或規模發生變化所導致的溶出差異等。而溶出方法的過度區分,其實并沒有嚴格的定義,因為不同制劑產品溶出特性有所不同,關鍵還是取決于原料藥本身的理化性質和體內藥動/藥效學性質,簡單理解,借用謝沐風老師的話講,就是將原研制劑的批間差異都給區分了,秉持著不懷疑原研質量的出發點,此時的試驗條件就是區分過度,亦或者把與用藥患者無關的變異性區分開來等。所以區分力的“度”還是要拿捏得當,引用謝老師的話講:玩兒技術,關鍵是實用!
根據制劑產品本身特性以及在處方工藝開發及生產工藝中可能影響制劑內在質量的關鍵因素,專門設計一些異常狀態下生產的片劑,例如通過調整制備工藝(例如,改變素片硬度)或處方(例如,更改崩解劑用量)有意制備質量有差異的制劑,以考察溶出方法的區分能力,溶出趨勢差異較大證明有區分力。
2.1 不同原料粒徑對溶出行為的影響
依據Noyes-whitney方程,理論上原料粒徑的變化將會影響片劑的溶出行為。因此,可使用粒徑分布不同的批次原料藥自制顆粒,其它濕法制粒參數不變,制得的顆粒壓制成片,考察不同原料粒徑對溶出曲線的影響。一般粒徑越小,溶出度越大,而且隨著片劑逐漸崩解,原料從顆粒中釋放,這種差異會變得愈發明顯,這種溶出曲線的差異變化即可說明篩選出的介質具有較好的區分力。
2.2 不同硬度片劑對溶出曲線的影響
可通過壓制不同硬度的自制片,考察硬度對溶出的影響。根據項目經驗,一般硬度會設置低、中、高硬度,且硬度越大的素片,溶出度越低,即可說明篩選出的介質具有較強的區分能力。
2.3 崩解劑用量對溶出曲線的影響
可加入不同崩解劑用量從而改變顆粒性質的處方,考察其對溶出曲線的影響。自制不同批次顆粒,崩解劑用量分別占處方量為不同比例,且保證其它制粒參數不變,考察不同崩解劑用量對溶出曲線的影響。依據項目經驗,正常情況下崩解劑加入比例越多時的溶出最快,比例越少時最慢,照此就可以區分出因崩解劑用量不同而導致顆粒性質有差異的片劑。
具體案例分析
xxx片依據藥典方法進行的溶解度研究結果如下:

從表可看出:原料藥在四種常規介質中幾乎不溶,屬于BCS Ⅱ類水難溶性藥物,且溶解度受pH影響不大,后續可考慮在水加入一定量的表面活性劑作為溶出介質。
接下來篩選表面活性劑的濃度,設置0.1%SDS、0.3%SDS、0.5%SDS、0.7%四種濃度的介質,模擬溶出條件,將0.1g原料加入1000ml介質,50rpm不同時間點取樣測定溶出曲線。
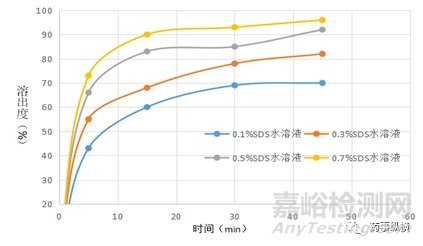
圖1. 原料藥在不同SDS濃度水溶液中的溶出曲線
結果發現原料藥在不同濃度SDS水溶液中的溶出存在顯著差異,在0.1%SDS和0.3%SDS水溶液中45min時的溶出度均低于90%;而在0.5%和0.7%SDS水溶液中45min的溶出度均可達到90%以上,在這種情況之下我們的初步選擇依據是:當溶出曲線不重合時,選擇最終釋放量在90%以上,溶出最慢的介質。因此,選擇SDS用量較少且溶出速度相對較慢的0.5%SDS水溶液作為本品的溶出介質。
測定片劑樣品在三種不同濃度SDS水溶液中的溶出曲線,研究發現片劑在0.5%SDS和0.7%SDS水溶液中45min溶出度均大于95%,而0.3%SDS溶液中45min溶出度低于90%,因此最終確定選擇槳法50rpm、以1000ml0.5%SDS水溶液為溶出介質。
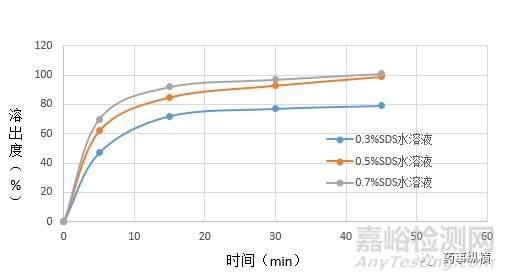
圖2. 片劑在不同濃度SDS介質中的溶出曲線
溶出方法區分力驗證

圖3 不同粒徑原料藥在0.5%SDS水溶液中的溶出曲線
不同粒徑的原料對片劑的溶出度影響顯著。粒徑越小,溶出度越大,而且隨著片劑逐漸崩解,這種差異變得越明顯,45min時D9045μm粒徑的溶出度不到80%。因此,以上數據表明,0.5%SDS水溶液可以區分出由不同粒徑原料所制備的片劑,溶出介質具有區分力。
不同崩解劑用量會影響片劑的崩解時間,崩解劑加入比例越多溶出最快,1%崩解劑溶出最慢,而10%崩解劑用量的片劑溶出最快,在15min左右差異最為明顯。因此,綜合以上數據可以得出:0.5%SDS水溶液既可以區分出原料藥粒度的差異,同時可以區分出因崩解劑用量不同而導致顆粒性質有差異的片劑。

圖4 不同崩解劑用量在0.5%SDS水溶液中溶出曲線
綜上,溶出是丈量制劑內在質量的一把尺子,只有對體外溶出度實驗進行全面深入細致的研究,才能更為科學、有效的間接評價和提高用藥患者體內生物利用度。且在創新藥研發階段,建立科學合理的溶出方法是一個動態過程,會隨著處方研究工作的推進不斷有所調整,在該過程中開發具有區分力的的溶出方法、確定合理的溶出試驗條件及實驗參數是制劑科研人員的工作關鍵所在,嚴格控制制劑產品的內在質量品質,才能更多的受益于用藥患者。
參考文獻:
[1] 中國藥典2015版
[2] 藥劑學. 人民衛生出版社
[3] 速釋固體口服制劑質量控制溶出方法開發策略
[4] 難溶性藥物的溶出試驗中使用表面活性劑時注意事項
[5] 普通口服固體制劑溶出曲線測定與比較指導原則
[6] 具有區分力的溶出方法開發
[7] 淺談溶出度檢查方法的分辨力
[8] 論溶出(釋放度)試驗條件的選擇對藥物體內外相關性的影響
[9] 適度區分力溶出方法的開發細節及要點
[10] 具有區分力的溶出曲線

來源:藥事縱橫


