您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-01-23 08:46
近來隨著人們對環保、安全、可持續發展越來越重視,殼聚糖作為天然高分子材料,逐步進入人們的視野,也引來了大批的研究者的關注研究,由于其具有生物降解性、生物相容性、可持續性、無毒、抑菌等多種優勢特點,已廣泛應用于食品、紡織、農業、環保、化妝品等各個行業。本文主要講述了殼聚糖的特性及其在各種給藥系統中的最新研究進展。
1. 前言
近年來隨著新藥研發技術的進步,許多藥物活性化合物已被發現。然而,將藥效物質傳遞到靶向目標是治療疾病的關鍵。合適的給藥系統(DDSs)可以增強這些新型藥物的藥代動力學和藥效學特性,增強其細胞/組織和生物相容性。因此,研究高效、可靠、安全的給藥系統成為了研究學者們的香餑餑。
新型給藥制劑在過去的四十年里快速發展,與傳統制劑相比有很多優勢,如增強吸收速率和生物相容性,保護藥物避免被酶解,精準給藥至細胞和組織,調控體內的藥物濃度。盡管這些優點很有吸引力,但也存在一些缺陷,比如毒性、降解副產品和不可生物降解,這仍然是我們面臨的問題。因此可降解的生物相容性聚合物受到高度重視,天然高分子材料,如多糖、多肽或磷脂通常被用作載體。其中,殼聚糖是一種陽離子多糖,其卓越的物理特性和生物特性在給藥系統中獲得越來越多的認可。
2. 來源
殼聚糖是甲殼素(如圖2a)衍生物,通常是通過甲殼素的堿性脫乙酰化獲得的。如果甲殼素的來源是真菌,則需進行酶提取得到甲殼素,然后將甲殼素部分脫乙酰以獲得殼聚糖。螃蟹和蝦殼至今仍然是甲殼素的主要來源。圖1說明了提取來源和從該來源加工甲殼素和殼聚糖的方法。

圖1殼聚糖的來源和提取方法
殼聚糖是一種無毒,半結晶,可生物降解,具有生物相容性的線性多糖,由隨機分布的N-乙酰氨基葡萄糖和β1-4相連的氨基葡萄糖單元組成(如圖2b)。

圖2甲殼素和殼聚糖的化學結構圖(a.甲殼素、b.殼聚糖)
殼聚糖由于含伯氨基,帶正電荷,具有良好的粘接特性,能增強粘膜黏附,增加藥物滲透作用的時間。殼聚糖具有較高的腎臟清除率,可以被酸和酶降解,降解產物可以通過腎臟清除。殼聚糖在生物系統中的生物降解速度和程度取決于脫乙酰度(DD),降解率隨DD的增加而降低。殼聚糖的抗氧化特性也吸引了科學家的注意。AbhijeetB Muley等指出具有較低分子量(Mw)的殼聚糖具有比具有更高Mw的殼聚糖具有更高的抗氧化性能。殼聚糖可以有效地加工成各種功能形態,包括凝膠,納米纖維,微珠,膜,支架,納米原纖維,納米顆粒,微粒和海綿狀結構。因此,殼聚糖由于其卓越性能和各種形態被廣泛應用于各種給藥系統中。
3. 殼聚糖在給藥系統中的研究進展
在過去幾十年里大量的藥品被發現,其中有些具有極佳的療效,然而,它們的生物利用度和藥代動力學非常差,導致全身不良反應。因此,給藥系統研究成為了關鍵,如利用水凝膠,微珠、微球、納米顆粒、納米纖維、脂質體等來提高療效。這些給藥系統的制備方法有很多,如乳化交聯、凝聚/沉淀、噴霧干燥、聚合法、離子凝膠法、反膠束法、篩分法。以下是以殼聚糖為載體的制劑通過不同的給藥途徑,使藥物到達所需部位,發揮療效的應用。
3.1 粘膜給藥
為了避免首過效應,出現了粘膜給藥系統,殼聚糖由于其粘附性和高滲透性是最理想的粘膜給藥載體之一。膠束具有分子可修飾性,生物相容性,載藥性,生物降解性,被應用于該給藥系統中。研究人員合成了磷酸化的殼聚糖-硬脂酸共軛物(CSSAP),隨后將其轉化為ζ電勢變化的膠束。最初,帶負電荷的區域使膠束跨粘液層擴散,隨后的正電荷改善藥物與細胞膜和粘液的接觸,從而避免向后擴散的效果(見圖3)。CSSAP膠束顯示出較高的粘液滲透和細胞締合(HEK-293細胞)性,因此可用于疏水性藥物和大分子藥物的粘膜給藥。
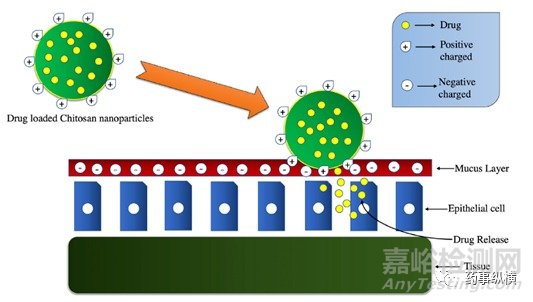
圖3.殼聚糖納米顆粒(CS-NP)的結構及其與黏液層的關系示意圖。
(從左邊開始的CS-NP,當它到達黏液層時,在靜電吸引的幫助下與帶負電荷的黏液層結合,并隨著時間釋放藥物)
癌癥研究仍然是所有研究人員喜歡的內容。但是,設計對人體內部新陳代謝狀態有反應的輸送系統仍然很麻煩。在各種刺激類型的系統中,pH響應系統是用于設計敏感納米制劑來進行抗癌治療最常用的方法。梁毅等利用席夫堿反應,制備了一種多功能的黏膜粘附和pH響應的殼聚糖二氫咖啡酸(CS-DA)和氧化支鏈淀粉(OP)注射用水凝膠,包載阿霉素(DOX)來治愈結腸癌。他們制備的水凝膠顯示出優異的可注射性,體外pH依賴性和流變性,在不同pH條件下的釋放性極好,可有效破壞結腸腫瘤細胞(HCT116細胞),可注射的pH響應型水凝膠主要用于粘膜粘附或結腸癌的藥物給藥。
處方藥依卡貝鈉具有抗黏膜性,為了克服這一缺點,J.Y.Kim等制備了依卡貝鈉殼聚糖蔗糖電解質復合物(ChEs)。在藥物釋放實驗中,與依卡貝鈉懸浮液相比,ChEs在12小時內顯示出高達80%的持續釋放。C.N.Cheaburu-Yilmaz等制備并表征了伏立康唑交聯N異丙基丙烯酰胺(PNIPAAm)和聚乙烯醇(PVA)(CS-g-PNIPAAm/ PVA)冷凍凝膠。伏立康唑的載藥量為70%。該藥物的體外釋放曲線顯示出符合Fickian擴散,8小時內釋放38%,穩定研究表明,儲存兩個月后冷凍凝膠制劑仍然穩定。此外,HK-2細胞培養實驗表明PNIPAAm/ PVA冷凍凝膠無毒。該復合材料是合適的粘膜給藥材料。
最近的殼聚糖制劑研究,如3D打印的木糖醇和雙氯芬酸鈉殼聚糖/PVA,曲安奈德兒茶酚共軛殼聚糖,強力霉素琥珀酸酯和吡哆醇鹽酸鹽戊二醛/殼聚糖,奧沙利鉑殼聚糖混懸液,西替利嗪殼聚糖,阿霉素殼聚糖和阿霉素的季銨鹽衍生物殼聚糖等均應用于促進粘膜給藥。
3.2 眼用制劑
傳統的眼科制劑如滴眼劑通常是用于治療眼前部疾病。由于眼中的結構,如淚膜(鼻淚引流,催淚,淚液周轉,淚液稀釋),角膜(對擴散的抵抗力高),結膜(對擴散的抵抗力,全身性的吸收),使眼用制劑達到治療眼底疾病所需的治療濃度是一項艱巨的任務。為了促進局部眼部治療給藥,科學家主要強調了兩種方法:(1)利用粘度增強劑,粘膜粘附劑,顆粒和/或原位膠凝系統來延長角膜滯留時間,(2)利用滲透促進劑,膠體載體(例如納米顆粒和脂質體)。殼聚糖及其衍生物由于其粘膜黏附特性和可降解性,被用作眼部制劑控制釋放的載體。此外,殼聚糖制劑在角膜表面的保留時間比傳統眼用制劑更長。
影響眼底病以令人震驚的速度增長(占眼部疾病總數的55%)。膠體藥物載體(例如聚合物納米膠束)的最新發展為藥物輸送到眼后部的途徑打開了一個窗口。如今,研究人員正在研究用于眼底疾病的納米膠束,使藥物濃度達到治療水平。例如,X.Xu等開發了基于地塞米松(Dex)的殼聚糖寡糖-纈氨酸-纈氨酸-硬脂酸(CSOVV-SA)納米膠束,增強眼后部藥物生物利用度,該膠束被證明對增強粘膜粘附性,生物相容性和穿透性以及持續釋放藥物非常有用。
右旋糖酐(Dex)是用于治療不同炎癥的最大甾體活性物質之一,像其他傳統的眼藥水一樣,Dex眼藥水給藥后也迅速通過眼淚或鼻淚引流除去,以及角膜上皮層的不滲透性導致生物利用度低。因此,市售的Dex滴眼液通常療效低下,需重復給藥以維持藥物治療所需濃度。為了克服這些缺陷,研究人員一直專注于一些如角膜前藥物保留,持續釋放藥物,及擴大角膜通透性的研究。A.Yu等設計了共軛地塞米松-乙二醇殼聚糖(Dex-GCS)納米顆粒(粒徑-277-289nm)水溶液。以磷酸鹽緩沖液(PBS,pH= 7.4)為釋放介質的體外釋放實驗顯示Dex逐漸釋放,釋放時長可達48小時。該Dex-GCS無細胞毒性,可以治療不同眼部炎癥疾病。
為了克服眼部用藥的缺陷,研究者們還研究了一種原位膠凝制劑,該制劑注入眼睛時,呈液體形式,但到達眼睛的結膜囊部位后變成粘彈性凝膠,隨后藥物持續釋放,可降低給藥頻率。H.Shi等人合成了基于己酰二醇殼聚糖(HGCS)的熱敏水凝膠(原位凝膠),以增強左氧氟沙星的眼生物利用度,研究結果表明HGCS可以延長角膜前藥物的保留時間,體外細胞毒性研究表明無細胞毒性。體內藥代動力學研究表明,載有左氧氟沙星的H-GCS水凝膠相比左氧氟沙星的水溶液可提供較高的Cmax和AUC0–12h(曲線下的面積),增強生物利用度。因此, H-GCS水凝膠可以用作局部眼用給藥的有利載體。
研究學者們設計了不同的殼聚糖用于改善眼部給藥的制劑。例如,酒石酸溴莫尼定殼聚糖,氟比洛芬殼聚糖,京尼平殼聚糖/明膠,噻嗎洛爾殼聚糖/明膠,鹽酸倍他洛爾MTT/殼聚糖,左氧氟沙星殼聚糖,槲皮素京尼平殼聚糖,香豆素殼聚糖,這些是最近的具有改善的眼部用藥的殼聚糖制劑。
3.3 經皮給藥
經皮給藥被認為是最受青睞的替代口服和靜脈給藥的途徑,因為其具有明顯優勢,即各種藥物載體均可以通過透皮途徑直接進入全身循環,避免肝臟代謝,并且不受胃中酸性介質,酶以及可變血漿濃度的影響。可將藥物以無創方式,如噴霧、貼劑或凝膠形式通過皮膚給藥。該給藥系統需要具備無毒、無刺激的材料,同時該材料不應與治療藥物反應。但是上市經皮給藥產品很少能透過皮膚角質層障礙,為了克服這一缺陷,必須提高藥物制劑的細胞滲透性。J.Radwan-Prag等以乙酰水楊酸為模型藥物,采用化學交聯法,制備了殼聚糖氧化鋅納米水凝膠,小鼠成纖維細胞L929毒性試驗表明該制劑無毒,藥物釋放試驗研究表明,新型水凝膠按一級動力學模型釋放,可有效控制藥物的釋放。
卵磷脂/殼聚糖納米顆粒(LCNs)已受到全世界的關注。LCN是通過靜電相互作用通過自組裝帶正電荷的殼聚糖和帶負電荷的卵磷脂而合成的。由于殼聚糖和卵磷脂均具有增強的滲透性和粘膜粘附性,可以擴大藥物在不同生物屏障上的滲透,可以通過口腔,粘膜,透皮和眼的生物屏障,具有廣闊的應用前景。黃芩素是一種天然的類黃酮,具有抗菌和消炎作用,是治療皮膚病的理想藥物。但是,由于其不良的親脂性和親水性,其藥用受到限制。為了增強黃芩素的穩定性,藥物滲透性和延長藥物保留時間,J.Ye等制備了黃芩素卵磷脂/殼聚糖納米顆粒,包封率高達84.5%,具有良好的滲透性和較長的藥物保留時間,無皮膚刺激性。
一種有效的阿片類藥物拮抗劑納曲酮(NTX)鹽酸鹽可以肌內或口服給藥。這兩種給藥途徑都有明顯的缺點。口服NTX會通過肝臟代謝,導致胃腸道不適及血漿濃度波動。肌內注射NTX成本高昂,需要醫學專業知識,并且注射會引起局部疼痛。NTX的透皮給藥可以克服肌肉和口服給藥的缺點。然而,NTX的親水性限制了其在透皮吸收中的應用。近年來,微針(MN)透皮給藥已被發現可用于NTX的透皮給藥,可增強藥物向皮膚深層的滲透。A.T.Ogunjimi等將殼聚糖-NTX微球與微針給藥相結合,可使NTX通過皮膚屏障。采用噴霧干燥法將NTX包封到殼聚糖微球中,包封率為70%~87%,殼聚糖-NTX微球經過微針注射NTX的通量為11.6±2.2μg/cm2?h,遠大于NTX皮膚直接給藥量,殼聚糖-NTX微針可增強患者的依從性,并改善NTX在皮膚上的持續給藥。
為了克服肌肉和口服藥物給藥的缺陷和提高患者順應性,研究人員設計了許多新型透皮給藥制劑,如吲哚菁綠殼聚糖包衣脂質體、玫瑰紅B水溶性殼聚糖、鹽酸西替利嗪殼聚糖、吡非尼酮殼聚糖海藻酸鈉、利多卡因殼聚糖等,這些制劑均可以促進透皮給藥吸收。
3.4 口服給藥
口服給藥由于可以大規模生產,患者順從性較好,通常為首選給藥方式,但是要實現有效的口服治療,必須克服幾個障礙,例如,pH值可變(胃是高酸性的),酶的存在,肝臟中的首過代謝以及腸吸收障礙。上述問題限制了活性物質進入全身循環,因此降低了口服藥物生物利用度。喜樹堿(CPT)被認為是一種功能強大的有效活性物質,在不同的癌細胞系中具有廣泛的細胞毒性。但CPT容易水解為羧酸鹽和水溶性差限制了其功效。水凝膠作為載體,可為增加藥物溶解度。其次,其三維結構主要由抗腫瘤藥物組成,可控制CPT在作用部位的釋放,延長作用時間。研究人員通過殼聚糖的胺基和THPC的羥甲基之間的共價鍵合制備了CPT殼聚糖水凝膠,提高了CPT的溶解性,可保護腸粘膜,以及延長給藥部位的CPT濃度(持續釋藥48小時),較好的生物相容性和低毒性。
大黃酸(RH,1–8二羥基-3-羧基蒽醌),具有保護腎臟、抗炎、抗腫瘤、抗菌等藥理作用,已引起了全世界的關注。然而由于RH水溶性較小,生物利用度低,使其在生物醫學領域的應用受到阻礙。L.Jingwen等采用酰胺化法制備大黃酸殼聚糖(RH-LMWC),研究結果表明RH-LMWC共軛體系可提高穩定性,可幫助延長RH的半衰期,增加了溶解性。
蝦青素(ASTX)是治療肝纖維化的藥物,由于其水溶性差和生物利用度低,用藥受到限制。Q.Hu等將ASTX摻入硬脂酸共軛物中制備殼聚糖-酪蛋白酸鈉-葡聚糖三元復合物(SA-CS/ NaCas /Odex)。這項研究為開發納米粒子基于通過口服提供親脂性藥物來治療肝纖維化提供了一種新穎的方法。另外,Q.Hu和他的團隊利用戊二醛(GA)和氧化葡聚糖作為交聯劑制備姜黃素殼聚糖納米顆粒(SA-CS/ NaCs)。該納米顆粒被證明在進食狀態和禁食胃腸道條件下均具有良好的控釋特性,在中性環境下表面電荷呈正電荷,這表明其有望作為疏水性藥物的口服緩釋載體。在另一項研究中,M.Motiei等人通過水包油乳液/離子膠凝方法制備的兩親性殼聚糖NP促進了疏水性藥物來曲唑(LTZ)的吸收體外實驗證明起初,LTZ突然釋放,隨后是緩慢釋放。
4 、結語
除上述給藥系統以外,殼聚糖在肺部給藥、陰道給藥、鼻腔給藥等等,均有應用,如布地奈德殼聚糖納米顆粒、妥布霉素海藻酸鹽/殼聚糖顆粒、頭孢克肟的殼聚糖-海藻酸鹽微球、克霉唑包裹在殼聚糖/PLGA納米顆粒、布洛芬殼聚糖、馬來酸氯苯那敏殼聚糖等等。這篇綜述講述了利用殼聚糖制備成不同給藥途徑的藥用劑型,殼聚糖及其衍生物在藥物制劑給藥系統方面具有巨大的應用前景。
原文來源:
B S P A , C V S . Connecting the dots in drug delivery: A tour d'horizon of chitosan-based nanocarriers system[J]. International Journal of Biological Macromolecules, 2020. https://www.sciencedirect.com/science/article/abs/pii/S0141813020352491?via%3Dihub

來源:Internet


