您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-01-03 20:02
摘要:目的 探討如何構建有效的藥品生產企業藥物警戒體系。方法 通過回顧藥物警戒體系的現狀和要素,結合本企業藥物警戒工作,從組織機構、制度與文件、日常實施、關鍵指標設計和信息挖掘等方面進行實例分析與探討。結果與結論 藥品生產企業應主動實施藥物警戒體系建設工作,可將企業生產信息與藥物警戒信息關聯設計藥物警戒信號指標,從而獲得藥品真實世界的警戒能力;建議相關監管機構能夠提供和共享更多的藥物警戒信息。
關鍵詞:藥品生產企業 藥物警戒 藥品不良反應監測 百批不良反應發生率
藥品生產企業是藥品安全有效的第一責任人。藥物警戒則是圍繞藥物安全開展的,監測、識別、評估和控制藥物不良反應或其他任何可能與藥物安全有關問題的工作,貫穿藥品生命整個周期。與不良反應監測工作相比,藥物警戒工作更強調主動性和全面性,從臨床試驗階段到產品試驗結束成功上市后,都需要連續監測和分析藥品的安全性;通過收集安全性數據后進行分析和評價,發現潛在的安全風險并及時反饋給社會和患者,或修訂說明書,最終保障患者的安全和權益。1974年,法國人首先提出了“藥物警戒”(Pharmacovigilance,PV)的概念[1]。相比國外藥品生產企業,我國藥物警戒工作比較滯后。藥物警戒大約于2000年以后在我國興起,發展到今天,也不過十幾年的歷程,初期主要是大型外資企業才有藥物警戒的專職人員從事該項工作,其他企業大部分沒有設立專職的藥物警戒部門和招聘專職的藥物警戒人員。之后,胡軍等[2]借鑒全面質量管理中“人、機、料、法、環”五大要素,介紹了建立藥物警戒體系的迫切性,提出了我國藥品生產企業如何開展和建立藥物警戒體系的相關建議。2019年8月,新修訂的《藥品管理法》明確了國家需建立藥物警戒制度。本文從藥品生產企業的藥物警戒工作實踐出發,探討如何實現藥物警戒體系的高效規范運行并提出相關建議。
1、建立藥品生產企業藥物警戒組織機構與制度文件
本公司于2017年設立獨立機構開展不良反應監測工作,建立了以國家藥品不良反應(ADR)報告平臺、文獻數據庫及常態化公司上市產品質量調研(含話務中心和銷售人員反饋的消費者信息)為三個主要監測信息來源的不良反應監測工作平臺。根據國家頒布的《藥品不良反應報告和監測管理辦法》,參考國外藥品生產企業藥物警戒工作現狀,為落實公司關于加強藥物警戒工作的有關意見,成立了統籌開展包括不良反應基礎監測工作的藥品安全委員會(藥物警戒工作領導小組),指導公司藥物警戒工作,其核心職責是落實國家《藥品不良反應報告和監測管理辦法》及公司相關要求,落實藥品安全、有效、穩定、均一及消費者滿意的高品質要求,建立健全并監督藥品安全問題處理機制,本公司初步建成了比較完整的藥物警戒組織體系和制度體系。如表 1、圖 1。

表 1 藥物警戒組織體系
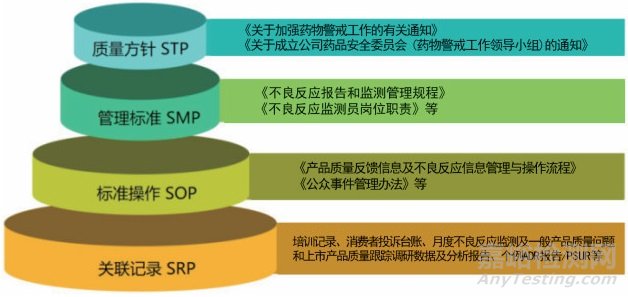
圖 1 藥物警戒文件制度體系
在制度層面,以成立公司“藥品安全委員會/藥物警戒工作領導小組”為標志,明確了制造、質量、市場、銷售、研發、技術、法務等相關部門作為公司藥物警戒體系成員。藥物警戒部是開展具體業務工作的日常部門。藥物警戒部負責人兼任“藥品安全委員會/藥物警戒工作領導小組”辦公室主任,同時,接受公司技術中心的技術支持。藥物警戒部成員包括部門經理/副經理、不良反應監測員和數據分析員,主要成員要求具有相應的專業背景,并要求參加各級ADR和藥物警戒技術培訓,同時開展對內培訓。
2 開展日常藥物警戒工作
在不良反應監測中心基礎上成立藥物警戒部,負責開展日常藥物警戒工作,包括公司各產品不良反應的信息收集(包括公司內外各單位反饋數據,文獻報道等匯總、整理和分析及個案跟蹤);負責不良反應報告的撰寫、審核和上報;負責消費者的產品反饋信息(產品質量研究信息)的匯總整理分析;負責與藥品監督管理部門不良反應監測中心的日常聯系;協助召集和組織相關會議;關注和學習醫藥法規政策,編寫學習材料進行相關培訓;開展部門內外專業技術支持,包括產品不良反應知識的宣傳和培訓等工作。
2.1 藥物警戒信息的監測與識別
藥物警戒信息的監測與識別,是藥物警戒工作起始的兩個銜接緊密的過程,是后續評估和控制工作的基礎。藥物警戒信息來源包括企業業務信息(制造過程產品相關信息等)、專業機構(包括國家ADR中心平臺、專業學術期刊數據庫)、一般媒體,結合企業生產和技術信息形成定期(月度)專業分析和處理報告,其操作流程如圖 2。

圖 2 藥物警戒信息管理與操作流程
為了規范地收集各種相關信息,企業建立了基于不良反應報告規范要求和一般質量信息投訴及建議的標準記錄工具,采用網絡調研手段(問卷星,wjx.cn),用于直接收集消費者、公司市場和銷售人員對產品質量的反饋信息。該工具可以通過手機或PC進行填報(如圖 3),極大地提高了企業產品相關信息反饋效率,在第一時間保證了收集信息的規范性。該工具后臺具有數據分析功能,可以直接進行數據預處理,形成了與國家ADR中心平臺數據互補的信息源。

圖 3 手機和PC端產品質量問題反饋表
藥物警戒信息的識別在監測信息匯總過程中同步實施,重點是提取國家ADR平臺反饋報告、公司接收的直接投訴的有效信息。對國家ADR平臺反饋信息的提取,主要包括對ADR報告各要素的復核,剔除非本企業產品、錯誤產品信息,并及時通過平臺反饋。
除國家ADR中心平臺數據外,消費者的直接投訴也是一個主要的不良反應信息來源,但其中同樣包含大量龐雜信息。其處理流程是根據實際需要,將包括不良反應在內的投訴進行分類:1)常規問題(參考現有標準可回答的投訴);2)非常規問題(參照現有的標準無法回答的問題)。對于常規一般問題,市場部話務中心在接到投訴時都能給予回復和解決,而對于參照現有標準無法回復的非常規問題,又會根據問題的屬性,分為產品力問題和質量問題。由產品研發及設計本身帶來的(如劑型),或者藥品的自身性質帶來的(如不良反應),稱之為產品力問題,此類問題將轉經研發部門進行識別并形成相關報告。質量問題一般指產品生產及流通過程中帶來的藥品缺陷(如產品包裝破損、少板少粒等),該類問題將轉經質量部進行核實,形成相關報告。藥物警戒部門將對其進行信息識別和收集。
藥物警戒工作以《個例藥品不良反應報告》《定期安全性更新報告》兩個基礎性報告作為日常工作輸出內容。同時,在相關信息收集和預處理的基礎上,進行信息分析和信號挖掘,完成月度藥物警戒報告,提交公司副總裁、市場、生產、質量、研發等部門。
2.2 藥物警戒信息的評估
適合產品特征的藥物警戒信息挖掘和關鍵指標設計是需要持續開展的探索性工作,也需要結合市場同類產品的監測信息進行。目前,開展的工作主要包括時間及空間上的產品ADR發生率總體分析、ADR主要發生因素分析、人群基本特征相關分析、制造因素相關性分析。
2.2.1 藥品ADR發生率分析
目前,較多的不良反應文獻分析多是一定期間和范圍內不良反應發生種類、比例、特點和規律分析,包括不同功能主治制劑的ADR發生率,常見不同給藥途徑中、西藥的ADR發生率(不是占已發生ADR的比例,而是具體以劑型為分母的發生數量)[3-7]。從藥品質量設計和生產角度,沒有提供更多價值。
除了根據時間軸對比同一品種的不良反應發生率變化以評價本藥品不良反應發生率狀態外,還應當橫向分析不同廠家同一品種,甚至同類藥品的不良反應發生率,以提供更加全面的信息。但目前除了藥品生產企業自身,其他企業無法獲得該數據。因此,只能根據國際醫學科學組織委員會(CIOMS)推薦的不良反應發生率表示方法進行判斷:十分常見(≧10%),常見(1%~10%,含1%),偶見(0.1%~1%,含0.1%),罕見(0.01%~0.1%,含0.01%),十分罕見(<0.01%)。例如,本公司某片劑產品,其不良反應發生率為十萬分之二,屬于十分罕見。這似乎可以為該片劑說明書的不良反應事項修改提供依據。但這仍舊是比較粗糙的結論,需要與同類品種進行對比分析。如果同類品種的不良反應發生率偏高或偏低,則有必要進一步開展安全性評估,分析和研究其中的影響因素,進而說明本企業該品種安全性有別于同品種其他企業的原因。這一項工作具有更加重要的意義。
2.2.2 藥品ADR發生時間和發生地域聚集性
藥品ADR發生時間和發生地域聚集性的分析,目的是發現藥品ADR的時空聚集性信號和風險。例如,通過統計某品種ADR發生率,發現不良反應發生的高發區,進而和藥品的特性相關聯,以便更好地理解不良反應,如圖 4(橫坐標代表不良反應發生率,縱坐標表示省份)。圖 5以生產年月為橫坐標,收集到的該月的不良反應數為縱坐標,對不良反應數量和生產年月的相關性進行聚類分析,以發現不良反應在藥品生產時間上的聚集規律。

圖 4 不良反應發生率-地區聚集性

圖 5 不良反應發生數-生產年月聚類分析
2.2.3 藥品ADR嚴重程度、相關性分析
藥品ADR嚴重程度、相關性分析的目的是了解藥品ADR的危害程度和相關程度,進行藥品風險-效益分析,為藥物警戒行動提供依據。如圖 6,通過分析某藥品ADR發生程度的比例,對藥品可能帶來的潛在風險保持警惕。

圖 6 不良反應嚴重程度占比
2.2.4 藥品不良反應發生的人群特征
選取我公司搜集的某品種(含國家不良反應監測中心反饋數據)報告為觀察對象,從來源、患者年齡、性別、給藥途徑以及所累及的器官/系統等方面進行回顧性分析,找出ADR發生機制和發生特點。如圖 7。

圖 7 ADR-人群特征分析
2.2.5 結合生產信息的藥品不良反應發生率分析
藥物警戒信息除了包括一般意義上的藥品安全性信息,還包括其他影響藥品產生預期效果的信息,如何充分利用這些信息,是企業藥物警戒工作的重點之一。本企業建立“百批ADR數”(ADRs/100Batch)概念作為開展藥物警戒信息應用的基礎。
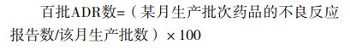
此定義將生產的時段信息與不良反應關聯起來,是進一步分析不良反應信息與生產制造信息之間相關或因果的橋梁。如,對某片的不良反應發生率分析,發現其201609***批次的“百批ADR數”最高,并且與其產量具有明顯的負相關,見圖 8。該結果提示,藥品產量的波動可能通過某些中間環節影響了產品的不良反應敏感因素,間接影響了不良反應。因此,藥品生產應當保證產量的穩定性。
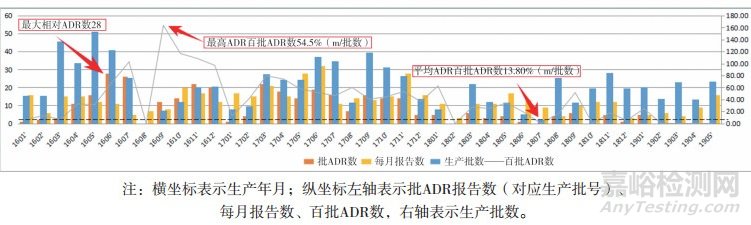
圖 8 不良反應數與產量之間的關系分析
2.3 藥物警戒行動
藥物警戒信息經過評估之后,進入控制階段,即藥物警戒行動,包括現場(臨場)處理、藥品安全性信息升級、上市后安全性研究等。
2.3.1 藥品安全問題的現場(臨場)處理
藥物警戒工作過程中,針對各類突發或需要前往現場處理的問題,由公司相關部門(包括總裁辦、市場部、質量部、研發部等)根據上文“1”項所述制度和文件,在職權范圍內進行現場處理,如派員立即專訪用戶,按規定取樣,必要時封樣,向當事人了解并核實情況,詢問用藥或聯合用藥與不良反應狀況,索要致使發生不良反應的藥品實物或包裝殘盒,必要時與患者的見證醫生聯系,采取適宜的醫療措施。對涉及公眾事件的,由總裁辦依據公司《公眾事件管理辦法》協調公司銷售、法務、臨床等相關部門予以處理。在特定情況下,根據風險或國家行政指令要求實行藥品的召回。
同時,對發現的ADR波動相關時間段批生產進行回顧分析,尋找相關因素,制訂措施并跟蹤效果。
2.3.2 藥物安全性信息升級
根據藥品常見的適應癥、適用人群、用藥方法、注意事項等相關的安全性問題,質量、研發部門制定手冊、規范,在開展內部藥品安全性教育的基礎上,為銷售部門提供指導,對藥品各環節進行把關,減少處方開具和用藥的風險,提高藥店、藥房人員藥品銷售行為和指導用藥的合理性和準確性。
同時,依據ADR分析結果,質量中心對藥品標準、藥品說明書和標簽進行修訂,及時增加藥品不良反應警示內容、注意事項和禁忌項。
2.3.3 產品上市后安全性研究
企業根據藥品特點,開展產品上市后臨床研究。如:2013年8月至2014年8月期間,我公司開展了某中藥片劑品種上市后臨床再評價試驗。同時,由于關注到有關中藥材的安全性報告,也與相關研究所合作開展該片劑有關藥材及復方的安全性研究。該研究目前正在實施中。
2.3.4 將藥物安全性信息納入產品品質評價綜合指標體系
企業將產品安全性信息、一般質量問題定量化,并納入企業建立的產品品質指數指標當中,與產品的批制造過程工藝信息、風險監測信息、批產品生命周期信息(原料-中間產品-成品及其留樣等)統一評價產品品質的可控性,為利用大數據進一步分析批產品安全性與批制造的相關性提供了基礎。相關探索性應用結果將另文報告。
3 結語
目前的藥物警戒和不良反應監測文獻多從政策、監管和臨床角度開展分析[8],對生產企業從制造角度開展具體品種針對性分析的幫助有限。藥品上市之后,其安全性和有效性的保證是由生產企業承擔的,這也是近年來國家要求加強企業開展藥物警戒和不良反應監測工作的原因之一。孫駿、董鐸等[9-10]提出了藥品生產企業開展藥物警戒監測的方法建議,為藥物警戒監測信號評價與控制提供了思路。本文介紹了本企業的一些實踐經驗,提出開展基于具體品種的時間、空間不良反應發生率的分析和統計方法,提供了制劑優化、生產、二次開發的間接評價手段。為進一步提高藥物警戒工作的效能,建議國家ADR中心平臺能夠采用適當的方法進行數據共享,比如在簽署互相保密協定的前提下實現數據共享。
參考文獻
[1] 劉巍, 陳易新. 藥物警戒的概念和起源[J]. 中國執業藥師, 2008, 5(7): 16. DOI:10.3969/j.issn.1672-5433.2008.07.007
[2] 彭麗麗, 范燕, 胡軍, 等. 探討藥品生產企業如何建立藥物警戒體系[J]. 中國藥物警戒, 2017, 14(11): 666-670. DOI:10.3969/j.issn.1672-8629.2017.11.006
[3] 王昆, 李飛, 劉屏, 等. 我院住院病人65535例次中藥制劑應用及不良反應報告分析[J]. 中國藥物應用與監測, 2010, 7(2): 97-99. DOI:10.3969/j.issn.1672-8157.2010.02.011
[4] 姚佳晨, 胡晉紅, 王卓, 等. 797例中藥不良反應報告分析[J]. 藥學服務與研究, 2007(2): 130-132. DOI:10.3969/j.issn.1671-2838.2007.02.011
[5] 沙建萍, 胡晉紅, 王卓, 等. 上海市藥品不良反應監測系統中4491份有效報告的分析[J]. 藥學實踐雜志, 2007, 25(4): 257-260. DOI:10.3969/j.issn.1006-0111.2007.04.024
[6] 叢駱駱, 吳彬, 郭洪祝, 等. 抗生素藥品不良反應發生率與雜質總量的數據挖掘與關聯分析[J]. 中國新藥雜志, 2016, 25(9): 964-967.
[7] 齊武強, 王明昭. 復方甘草片吞服與含服的療效和不良反應發生率分析[J]. 臨床醫學研究與實踐, 2017, 2(12): 25-26.
[8] 李利軍, 胡晉紅, 王卓, 等. 藥品不良反應嚴重程度分級評分標準的制定及藥品不良反應嚴重度指數的應用[J]. 藥學服務與研究, 2008(1): 9-13. DOI:10.3969/j.issn.1671-2838.2008.01.003
[9] 孫駿, 黃倩倩, 甘戈, 等. 藥品生產企業應對藥品不良事件聚集性信號的策略探討[J]. 中國藥物警戒, 2017, 14(11): 671-673. DOI:10.3969/j.issn.1672-8629.2017.11.007
[10] 董鐸, 孫利華. 應用德爾菲法研究藥品生產企業不良反應報告和監測指南[J]. 中國藥物警戒, 2013, 10(9): 523-526. DOI:10.3969/j.issn.1672-8629.2013.09.004
作者:張坤 , 劉巧麗 , 耿炤
江西匯仁藥業股份有限公司

來源:xml-data


