您當(dāng)前的位置:檢測(cè)資訊 > 法規(guī)標(biāo)準(zhǔn)
嘉峪檢測(cè)網(wǎng) 2025-07-11 20:59
|
產(chǎn)品信息 |
|
|
NDA序號(hào) |
219249 |
|
規(guī)格 |
3 mg和9 mg |
|
使用途徑 |
口服 |
|
申請(qǐng)人 |
GENENTECH, Inc. |
|
治療分類 |
腫瘤 |
|
RLD |
新分子實(shí)體 |
|
擬定適應(yīng)癥 |
磷脂酰肌醇-4,5-二磷酸3-激酶(PIK) 催化亞基α亞型蛋白(p110α;由PIKCA基因編碼)的選擇性抑制劑,用于治療乳腺癌 |
|
產(chǎn)品外觀 |
薄膜衣片: • 3 毫克:紅色圓形凸面片劑,一面刻有"INA 3"字樣。 • 9 毫克:粉色橢圓形片劑,一面刻有"INA 9"字樣。 |
原料藥信息:
商品名含有(lnavolisib, 一種激酶抑制劑。Inavolisib的化學(xué)名為(2S)-2-[[2-[(4S)-4-(二氟甲基)-2-氧代-噁唑烷酮-3-基]-5,6-二氫咪唑并[1,2-d][1,4]苯并氧氮?-9-基]氨基]丙酰胺。Inavolisib為白色至類白色、灰粉色、灰橙色或灰黃色粉末。Inavolisib的分子式為C18H19F2N5O4,分子量為407.37 g/mol。其化學(xué)結(jié)構(gòu)如下所示:

TRADENAME薄膜包衣片有兩種規(guī)格可供口服,分別含有3毫克和9毫克的inavolisib。本品還含有乳糖、硬脂酸鎂、微晶纖維素。

貯存在20°C至25°C(68°F至77°F)條件下,允許在15°C至30°C(59°F至86°F)之間短暫波動(dòng)[參見USP控制室溫要求]。
NDA 219249 是針對(duì)新分子實(shí)體(NME)的原研1類新藥申請(qǐng),旨在批準(zhǔn)lnavolisib片劑(3 mg和9 mg)作為速釋制劑。該藥物活性成分是磷脂酰肌醇-4,5-二磷酸3-激酶(PIK)催化亞基α亞型蛋白(p110α;由PIK3CA基因編碼)的高效選擇性抑制劑,擬用于乳腺癌患者的治療。
擬商業(yè)化制劑為速釋型(b)(4)薄膜衣片(FCT),口服給藥,提供3 mg和9 mg兩種規(guī)格。劑量規(guī)格設(shè)計(jì)旨在滿足精準(zhǔn)便捷的給藥方案:使用9 mg片劑單次給藥9 mg,或通過3 mg片劑實(shí)現(xiàn)劑量遞減至6 mg或3 mg。
本次生物藥劑學(xué)審評(píng)重點(diǎn)包括:
1) 對(duì)擬用受試制劑溶出度檢測(cè)方法及可接受標(biāo)準(zhǔn)的評(píng)估與適用性判定;
2) 對(duì)制劑橋接必要性的評(píng)估。
體外溶出度方法和接受標(biāo)準(zhǔn):
根據(jù)申請(qǐng)人提供的全部信息和數(shù)據(jù),以下溶出度方法和接受標(biāo)準(zhǔn)被認(rèn)為是充分且可接受的。
在臨床開發(fā)過程中處方的變更橋接:申請(qǐng)人開發(fā)了標(biāo)記為F01-F17的一系列擬定處方藥品,貫穿整個(gè)臨床開發(fā)階段。申請(qǐng)人通過體外溶出度研究橋接了臨床研究期間進(jìn)行的各種處方變更。從早期處方(F01)到II期及主要穩(wěn)定性處方(F19),片劑在pH 1和pH 6.8條件下均顯示出與速釋產(chǎn)品藥物釋放行為一致的相似溶出特性。
申請(qǐng)人提出的溶出方法及檢測(cè)條件(3mg規(guī)格使用500 mL 0.1N HCl、9mg規(guī)格使用900 mL介質(zhì),采用USP第二法(槳法),50轉(zhuǎn)/分鐘,37±5°C),兩規(guī)格批次放行和穩(wěn)定性測(cè)試的溶出接受標(biāo)準(zhǔn)均為Q=80%(30分鐘內(nèi)),該方案對(duì)lnavolisib片劑具有充分適用性。
生物藥劑學(xué)總體建議
從生物藥劑學(xué)的角度來看,建議批準(zhǔn)新藥申請(qǐng)NDA-219249-ORIG-1所申報(bào)的Inavolisib片劑(3毫克與9毫克規(guī)格)。
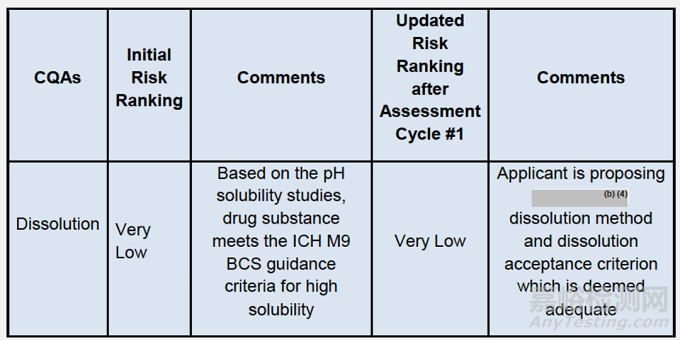
溶解度:如表1所示,原料藥inavolisib在pH依賴性(b)(4)溶解度

滲透性:申請(qǐng)人認(rèn)為Inavolisib的被動(dòng)滲透性為中等(MDCK細(xì)胞試驗(yàn)表觀滲透系數(shù)1.9×10^-6厘米/秒;流速滲透系數(shù)0.9×10^4厘米/秒)。
溶出度:擬定的Inavolisib片劑(3 mg和9 mg)在采用USP溶出度測(cè)定法II、槳速50 rpm、溶出介質(zhì)為500 mL 0.1 N鹽酸且不含表面活性劑的條件下,顯示快速溶出特性(b)(4)。基于(b)(4)的考量,溶出介質(zhì)體積確定為500 mL 0.1 N鹽酸。
溶出方法與接受標(biāo)準(zhǔn):
背景:
Inavolisib被歸類為一種具有高水溶性且中等滲透性的分子。其制劑設(shè)計(jì)為速釋片劑。單次和多次給藥后均顯示劑量-暴露量呈線性關(guān)系。據(jù)申請(qǐng)人數(shù)據(jù),單次口服9 mg[14C]標(biāo)記inavolisib膠囊后的絕對(duì)生物利用度為76%(90%置信區(qū)間:69-83%),表明該藥物具有較高的絕對(duì)生物利用度(臨床總結(jié)模塊2.7.1)。由于擬定制劑具有快速溶出特性(30分鐘內(nèi)藥物釋放(4)%),預(yù)計(jì)藥物釋放速率對(duì)整體吸收速率的影響極小。
溶出度方法:
Inavolisib的溶解度數(shù)據(jù)(表2)表明該化合物具有pH依賴性溶解特性,根據(jù)生物藥劑學(xué)分類系統(tǒng)可歸類為高溶解性分子。基于此評(píng)估,申請(qǐng)人參照2018年FDA工業(yè)指南《含有高溶解性藥物的速釋固體口服制劑溶出度測(cè)試及驗(yàn)收標(biāo)準(zhǔn)》,采用(b)(4)條件下的溶出測(cè)試方案用于制劑生產(chǎn)及有效期內(nèi)的常規(guī)質(zhì)量控制。由于Inavolisib兩種規(guī)格片劑(3mg與9mg)具有劑量比例性且采用相同生產(chǎn)工藝(b)(4),初始階段應(yīng)用了相同的體外溶出方法和測(cè)試條件。申請(qǐng)人提出的溶出度方法與驗(yàn)收標(biāo)準(zhǔn)詳見表2。

根據(jù)2024年6月3日IR回復(fù),使用900 mL溶出介質(zhì)用于9 mg規(guī)格產(chǎn)品已被驗(yàn)證合理性,并被判定為可接受。
解讀:兩種上市規(guī)格,小規(guī)格3mg采用了500ml介質(zhì)體積、大規(guī)格9mg采用了900ml介質(zhì)體積的溶出方法進(jìn)行放行,pH均為0.1N HCl,說明化合物在水性介質(zhì)中溶解度較低,采用了較強(qiáng)酸性介質(zhì)。體內(nèi)數(shù)據(jù)也表明,藥物體外的釋放速率對(duì)其整體吸收速率影響較小。
溶出方法區(qū)分能力:
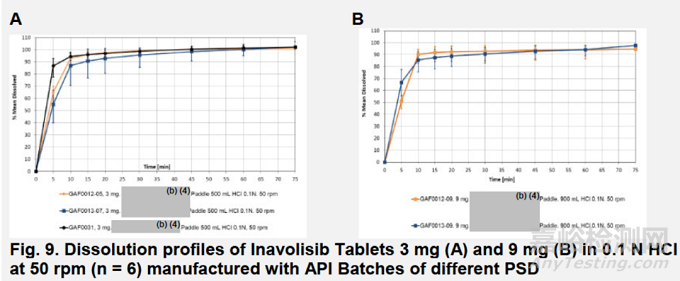
申請(qǐng)人評(píng)估了所擬定的溶出度測(cè)試條件對(duì)單位處方故意變化的區(qū)分能力,并證明原料藥粒度分布(PSD)對(duì)溶出度沒有影響。圖9A展示了分別采用D10為(b)(4)微米、D50為(b)(4)微米、D90為(b)(4)微米的原料藥細(xì)顆粒、標(biāo)準(zhǔn)及粗顆粒處方制備的3 mg片劑的溶出曲線。圖9B展示了分別采用D10為(b)(4)微米、D50為(b)(4)毫米、D90為(b)(4)毫米的原料藥標(biāo)準(zhǔn)及粗顆粒配方制備的9 mg片劑的溶出曲線。
申請(qǐng)人還研究了片劑硬度對(duì)溶出度(b)(4)的影響。(b)(4)溶出數(shù)據(jù)(圖10A和B)表明,所提出的溶出方法能夠區(qū)分不同硬度制備的片劑。

除了PSD和片劑硬度外,申請(qǐng)人還研究并證明了所提出的溶出方法在不同儲(chǔ)存和強(qiáng)力條件(不同溫度和濕度)下的區(qū)分能力。
評(píng)估:根據(jù)申請(qǐng)人提供的整體信息,審評(píng)人員認(rèn)為該藥物制劑擬定的溶出度測(cè)試條件(3mg規(guī)格采用500 mL 0.1N HCl介質(zhì)、9mg規(guī)格采用900 mL 0.1N HCl介質(zhì),USP第二法裝置,50轉(zhuǎn)/分鐘,37#5°C)經(jīng)以下支持性信息驗(yàn)證具有可接受性:
1. 擬定產(chǎn)品為速釋劑型,旨在胃滯留時(shí)間及pH范圍內(nèi)實(shí)現(xiàn)快速藥物釋放。
2. 根據(jù)BCS分類系統(tǒng),活性成分Inavolisib在胃液pH范圍內(nèi)屬于高溶解性藥物。
3. 被確定為關(guān)鍵物料屬性(CMA)的API粒度分布對(duì)藥物釋放無顯著影響。原料藥粒度已得到充分控制(b)(4)。
4. 擬定溶出方法對(duì)片劑硬度、貯存條件及強(qiáng)力條件具有區(qū)分力。
5. 由于Inavolisib在生理pH條件下具有高溶解性,被確定為制劑關(guān)鍵質(zhì)量屬性(CQA)的溶出度具有極低的初始生物藥劑學(xué)風(fēng)險(xiǎn),因此對(duì)擬定藥物的生物利用度影響可忽略。
6. 擬定溶出方法及測(cè)試條件(USP第二法裝置,50轉(zhuǎn)/分鐘,0.1N HCl介質(zhì)500 mL/900 mL)符合2018年《溶出度指導(dǎo)原則》對(duì)含高溶解性藥物制劑的要求,且符合2021年《M9基于生物藥劑學(xué)分類系統(tǒng)的生物等效性豁免指導(dǎo)原則》相關(guān)規(guī)定。
7. 溶出度接受標(biāo)準(zhǔn)Q=30分鐘內(nèi)釋放(%)(b)(4)具有合理性。
8. 溶出度標(biāo)準(zhǔn)可確保藥物完全釋放(b)(4)。
解讀:化合物溶解度呈pH依賴性,Inavolisib制劑屬速釋制劑,在生理pH條件下可快速釋放,因此其對(duì)藥物的生物利用度影響風(fēng)險(xiǎn)極低。將產(chǎn)品體外釋放的快慢與體內(nèi)生物利用度區(qū)分開,釋放速度對(duì)生物用利度的影響很小。
開發(fā)的溶出方法介質(zhì)雖采用了較強(qiáng)酸性介質(zhì),仍對(duì)壓片硬度和強(qiáng)力條件下的樣品有適度的區(qū)分力,對(duì)原料藥粒度沒有區(qū)分力,說明溶出方法可以較好的區(qū)分不同條件的產(chǎn)品,表現(xiàn)較好的質(zhì)量控制能力。

來源:蒲公英OurYao


