您當前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2025-06-26 08:41
摘要
化學(xué)仿制藥(注冊分類3,4,5.2)的申請及質(zhì)量與療效一致性評價所選用的參比制劑均應(yīng)在國家藥品監(jiān)督管理局發(fā)布的參比制劑目錄中,我國仿制藥參比制劑目錄收載的品種有多種來源,其中相當一部分未在我國上市。對于收錄的參比制劑,目錄中也僅提供有限信息。參比制劑的整個產(chǎn)品生命周期中受到各種因素影響導(dǎo)致不可避免地發(fā)生各種變更,但無法在目錄中及時體現(xiàn)。本文通過調(diào)查國內(nèi)外參比制劑相關(guān)信息和數(shù)據(jù)庫,針對存在的問題進行分析和歸類,探索性提出構(gòu)建參比制劑數(shù)據(jù)庫的設(shè)想,進而使我國的參比制劑目錄與來源國信息實現(xiàn)動態(tài)關(guān)聯(lián),提高使用效率和質(zhì)量,更好地為仿制藥研發(fā)、檢驗、審評和監(jiān)管提供服務(wù)與支持。
【關(guān)鍵詞】仿制藥;參比制劑;動態(tài)管理;國家藥品監(jiān)督管理局;治療等效性;藥品生產(chǎn)質(zhì)量管理規(guī)范
化學(xué)仿制藥(generic drugs)參比制劑(reference listed drugs,RLD)的選擇和確定是順利開展仿制藥研究的首要工作,RLD遴選應(yīng)以為公眾提供高質(zhì)量的仿制藥品為目標。2019年3月25日,我國國家藥品監(jiān)督管理局藥品審評中心《關(guān)于發(fā)布化學(xué)仿制藥參比制劑遴選與確定程序的公告(2019年第25號)》以及2019年8月5日《關(guān)于在審化學(xué)仿制藥參比制劑有關(guān)事宜的通知》中[1-2],明確將RLD的應(yīng)用范圍擴大到仿制藥(注冊分類3,4,5.2)的申請和審評過程中。但是,不同于美國、日本或歐盟等管理規(guī)范的國家/地區(qū)的RLD管理,我國仿制藥RLD目錄收載的品種中有相當一部分來自其他國家或地區(qū)(歐洲、美國、日本等),并未在我國上市。對于收錄的RLD,目錄中也僅提供有限信息,在其整個產(chǎn)品生命周期中,由于受到各種因素影響導(dǎo)致不可避免地發(fā)生各種變更,但無法在目錄中全面體現(xiàn)。本文通過探討分析現(xiàn)行化學(xué)仿制藥RLD目錄中可能存在的問題,研究如何合理動態(tài)管理我國的RLD,為構(gòu)建我國RLD數(shù)據(jù)庫提供思路和依據(jù)。
1.背景介紹
RLD是在臨床應(yīng)用中可與仿制藥互換使用的藥品,一般是質(zhì)量、安全性和有效性均已確立的原研藥品(innovator product)。當原研藥品已經(jīng)撤市或者并不總是容易購買獲得時,市場上使用最廣泛的同品種仿制藥(market leader)或者某個國家/地區(qū)最早上市的品種也可以被用作對照藥品[3]。國外通常會建立穩(wěn)定的RLD制度,在藥品監(jiān)管體系內(nèi)對RLD進行動態(tài)管理。例如,美國主要通過《經(jīng)過治療等同性評價批準的藥品(橙皮書)》[Approved Drug Products with Therapeutic Equivalence Evaluations(Orange Book),以下簡稱“橙皮書”]對美國FDA批準上市的化學(xué)藥品進行管理[4],明確指定每個品種、規(guī)格的RLD。美國橙皮書每年發(fā)布一版,同時根據(jù)變化情況每個月發(fā)布增補版,也可以利用每月更新的電子版橙皮書數(shù)據(jù)庫(orange book database)體現(xiàn)RLD的變化情況[5],實現(xiàn)對RLD的動態(tài)管理,其中相當一部分RLD并未在我國批準上市。例如,第1~57批已發(fā)RLD目錄中,國內(nèi)上市藥品RLD總計1370個,占比26%;未進口藥品RLD總計3859個,占比約74%[6]。這些國外上市品種被收錄到RLD目錄后,在持證商發(fā)生變更、藥品通用名稱更新等情況下,我國采取滾動更新方式在后續(xù)發(fā)布的目錄批次中予以更新,但在來源國其他可能影響產(chǎn)品可及性和質(zhì)量的信息以及監(jiān)管狀態(tài)的變化,卻無法在我國的RLD目錄中及時體現(xiàn)。
同時,對于國內(nèi)已批準上市的RLD(國內(nèi)已上市的原研藥品和經(jīng)審核確定的國外原研制藥企業(yè)在中國境內(nèi)生產(chǎn)或經(jīng)技術(shù)轉(zhuǎn)移生產(chǎn)的藥品),在生命周期中受到我國各種監(jiān)管手段的制約可能會影響其市場可及性和質(zhì)量,也未能在現(xiàn)行目錄中有效體現(xiàn)。
2.我國化學(xué)仿制藥RLD問題分析
自2017年3月17日第1批目錄發(fā)布以來[7],截至2024年6月17日,我國已發(fā)布了81批RLD目錄。雖然每批目錄都要經(jīng)歷嚴格的論證和公示程序,但在實際應(yīng)用過程中還是會不可避免地出現(xiàn)各種問題。為了便于相關(guān)人員更好地使用目錄,本文將目前發(fā)布的RLD中存在的問題進行分析和歸類,具體情況可分為以下幾個方面。
2.1 RLD的名稱
2.1.1 英文名稱
由于不同國家/地區(qū)對于產(chǎn)品命名的習(xí)慣和要求不同,RLD的英文名稱也會有所差異。我國仿制藥RLD目錄中的英文名稱多數(shù)為該品種在我國同類產(chǎn)品中的英文翻譯,所以可能與來源國的產(chǎn)品名稱不同,從而造成檢索的不便。例如,頭孢氨芐在我國RLD目錄中的翻譯為cefalexin,而美國橙皮書為cephalexin;阿昔洛韋在我國RLD目錄中的翻譯為aciclovir,而美國橙皮書為acyclovir;維生素K1在我國RLD目錄中的翻譯為vitamin K1,而美國橙皮書為phytonadione。還有些屬于名稱翻譯錯誤,例如硫酸長春新堿翻譯為vincriscristine(見表1)。
▲表1-我國仿制藥 RLD 目錄中的英文名稱錯誤示例
2.1.2 同一名稱對應(yīng)多個RLD
我國RLD目錄中收錄的品種,每1個條目序號對應(yīng)1種規(guī)格的RLD,有助于企業(yè)準確查找對應(yīng)的RLD。但對于某些原研產(chǎn)品,上市后可能會開發(fā)新的臨床適應(yīng)證,從而導(dǎo)致新的制劑品種批準上市,如果2個品種在工藝處方上有所差別,則視為不同的品種。例如,我國RLD目錄中序號為67?45的度他雄胺軟膠囊(0.5mg),持證商為葛蘭素·史克株式會社(グラクソ·スミスクライン株式會社),但是該持證商對于這一規(guī)格擁有2種產(chǎn)品,商品名、處方工藝、產(chǎn)品包裝和臨床適應(yīng)證均有所差異(見表2和圖1),不利于企業(yè)選擇合適的RLD。
▲表2-度他雄胺軟膠囊(0.5 mg)的2種RLD

▲圖1-度他雄胺軟膠囊上市內(nèi)包裝圖
2.2 RLD的多種包裝銷售形式
商品名和持證商是我國仿制藥RLD目錄中提供的重要參考信息,但對來源于美國橙皮書的RLD,除了持證商自身的銷售形式,還可能采用其他多種包裝形式進行銷售。例如授權(quán)仿制藥、重包裝、重貼標和自有品牌經(jīng)銷商等,其形式的差別僅在內(nèi)、外包裝上,且均在美國FDA的法規(guī)監(jiān)管體系之內(nèi),因此符合我國《已發(fā)布參比制劑有關(guān)事宜說明》中對于RLD的相關(guān)要求,可以作為RLD用于藥學(xué)研究和生物等效性研究(bioequivalency,BE)。美國橙皮書也明確指出:“橙皮書中僅列出持證商名稱,如果持證商的名稱未出現(xiàn)在包裝標簽上,則可通過國家藥品編碼(national drug code,NDC)目錄將該產(chǎn)品與橙皮書中的持證商關(guān)聯(lián)起來”,關(guān)于NDC目錄、授權(quán)仿制藥、重包裝、重貼標和自有品牌經(jīng)銷商的內(nèi)容已在相關(guān)論文中介紹[8-10]。對于我國RLD目錄中收錄的來源于美國橙皮書的品種,持證商可能不銷售自身的包裝形式,市場上RLD也以其他幾種形式出現(xiàn),包裝上并不能看到商品名和持證商名稱。例如,我國RLD目錄中序號為10?25的單硝酸異山梨酯片(10mg),其持證商和商品名分別為Kremers urban Pharmaceuticals公司/ECI Pharma?ceuticals公司和Monoket,檢索NDC目錄,當前在美國上市銷售的形式僅有授權(quán)仿制藥的形式(見表3),以相應(yīng)的NDC號“81665?102?10”和“62175?106?01”為關(guān)鍵詞,在DailyMed產(chǎn)品標簽庫進行檢索,可得到授權(quán)仿制藥的上市包裝,持證商和商品名均未能在銷售包裝上體現(xiàn)(見圖3和圖4)。檢索美國已批準藥品庫(Drugs@FDA:FDA approved drug products)可知,持證商自身包裝的NDC號為62175?3610?1[11],目前在DailyMed產(chǎn)品標簽庫中并無備案。
▲表3-單硝酸異山梨酯片(10mg)RLD的NDC目錄檢索結(jié)果

▲圖2-Omnivium Pharmaceuticals 公司授權(quán)仿制藥單硝酸異山梨酯片的上市包裝圖

▲圖3-Lannett Company 公司授權(quán)仿制藥單硝酸異山梨酯片的上市包裝圖
2.3 治療等效性(therapeutic equivalence,TE)評價代碼的影響
美國橙皮書中的多源性處方藥會被分配相應(yīng)的TE評價代碼作為臨床藥品選擇的公共信息[4]。TE代碼具有2種基本類型,分別用首字母A和B表示,以區(qū)別不同的TE類別。首字母A表示美國FDA認為該產(chǎn)品與其他藥學(xué)等效的產(chǎn)品治療等效,如果不存在已知或可疑的生物等效性問題,根據(jù)劑型的不同,分別被指定為AA,AN,AO,AP或AT等;如果存在實際或可能的生物等效性問題,但已經(jīng)被充分的體內(nèi)(in vivo)或體外(in vitro)研究證明生物等效,則被指定為AB。首字母B表示美國FDA認為該產(chǎn)品與其他藥學(xué)等效的產(chǎn)品并非治療等效,這些產(chǎn)品一般存在實際或可能的生物等效性問題,尚未經(jīng)充分研究證明生物等效,根據(jù)劑型的不同,分別被指定為BC,BD,BE,BN,BP,BR,BS,BT,BX或B∗等。我國在遴選RLD時,并未要求對TE評價代碼進行考察。因此,目錄中某些RLD的代碼為B,可能影響生物等效性臨床試驗的成功率,引發(fā)仿制藥開發(fā)的風(fēng)險。我國RLD目錄中部分TE評價代碼為B的品種見表4。
表4-我國仿制藥 RLD 目錄中 T 評價代碼為 B的品種示例
2.4 風(fēng)險評估與減輕策略(risk evaluation and mitigation strategy,REMS)的影響
REMS是根據(jù)2007年美國《食品藥品管理法修正案》(Food and Drug Administration Amendments Act,F(xiàn)DAAA)引入的一項藥品制約機制。根據(jù)FDAAA的要求,美國FDA在必要的情況下,可以要求制劑生產(chǎn)商通過REMS管理藥品和生物制品相關(guān)已知或潛在風(fēng)險,確保其效益大于風(fēng)險[12]。REMS涉及RLD,一般無法通過常規(guī)的銷售渠道獲得,RLD公司認為向仿制藥申請人提供充足的已上市RLD將違反REMS,從而限制其獲得足夠數(shù)量的RLD開展相關(guān)研究。因此,在REMS的執(zhí)行過程中會不同程度地影響到相關(guān)產(chǎn)品的市場可及性。2020年8月14日之前,REMS中共有15個品種(26個規(guī)格)已收載于我國仿制藥RLD目錄且僅有美國橙皮書來源,目前仍有12個品種(21個規(guī)格)僅有美國橙皮書來源(見表5)。
▲表5-收載于我國仿制藥RLD目錄且僅有美國橙皮書來源的REMS品種列表

2.5 藥品生產(chǎn)質(zhì)量管理規(guī)范(good manufacture practice,GMP)合規(guī)性的影響
GMP是從事藥品生產(chǎn)和質(zhì)量管理的基本準則,只有在符合GMP的條件下生產(chǎn)的藥品才可以上市銷售。RLD生產(chǎn)企業(yè)的GMP符合狀態(tài)是判斷和確定其產(chǎn)品質(zhì)量和可及性的重要依據(jù)和保證[13]。我國仿制藥RLD目錄中收錄的RLD也可能由于生產(chǎn)企業(yè)違反GMP的要求而被停止銷售,從而影響其市場可及性。根據(jù)2017年以來我國發(fā)布的不符合c檢查公告的情況,對可能受到影響的RLD進行了匯總,見表6。
▲表6-我國仿制藥RLD目錄中受GMP合規(guī)性影響的品種示例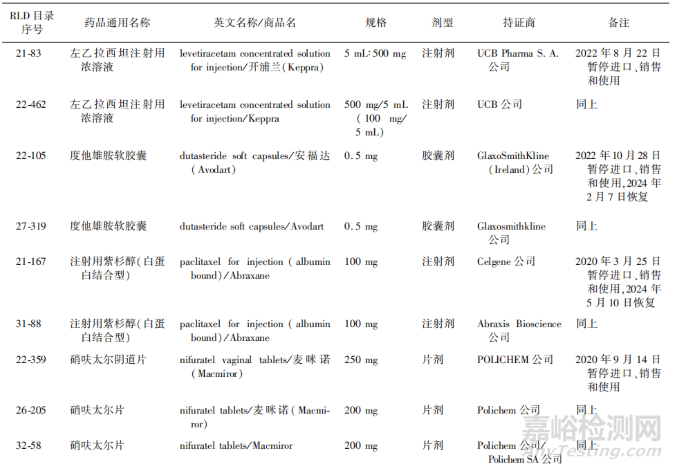

2.6 亞硝胺類雜質(zhì)事件的影響
RLD的可及性也會受到某些突發(fā)事件的影響,如亞硝胺類雜質(zhì)事件。2018年6月,某些藥品被報道可能出現(xiàn)亞硝胺類雜質(zhì),受到影響的品種共有5類:沙坦類、含二甲雙胍類、雷尼替丁類、利福平類和酒石酸伐尼克蘭片[14]。美國FDA和歐洲EMA均采取了相應(yīng)的控制策略,受到影響的品種可能面臨召回或撤市的風(fēng)險,從而在一定程度上影響了我國RLD的可及性。我國RLD目錄中可能受影響的品種匯總見表7。
▲表7-我國仿制藥RLD目錄中受亞硝胺類雜質(zhì)事件影響的品種匯總
2.7 RLD撤市的影響
RLD批準上市后,在其產(chǎn)品生命周期中,基于各種非安全性原因也會出現(xiàn)停售和撤市的情況,從而影響產(chǎn)品的可及性。我國RLD目錄中收錄的某些品種為國內(nèi)上市的原研藥品,但是這些藥品之后申請注銷藥品批準文號,在我國市場上不再可及,從而影響RLD的可及性。自2017年以來,我國共發(fā)布26批藥品注冊證書注銷的公告[15],受到影響的RLD共計63個。部分受到影響的RLD見表8。
▲表8-我國仿制藥RLD目錄中受藥品注冊證書注銷影響的品種示例

3.我國化學(xué)仿制藥RLD數(shù)據(jù)庫構(gòu)建的探討
藥品經(jīng)審批上市后,在其全生命周期內(nèi)會經(jīng)歷各種變更,RLD作為仿制藥開發(fā)的對照藥物也不可避免地會產(chǎn)生各種變化。截至2023年底,我國已發(fā)布2516個品種(6714個規(guī)格)的RLD,構(gòu)建我國的化學(xué)仿制藥RLD數(shù)據(jù)庫是對這些RLD進行動態(tài)管理的有效解決方案[16]。數(shù)據(jù)庫以每個RLD規(guī)格作為基本單元,在國家藥品監(jiān)督管理局發(fā)布RLD信息的基礎(chǔ)上,對后期發(fā)生的各種變化,根據(jù)收集到的信息及其影響大小進行分類管理,可包括關(guān)聯(lián)信息、支持信息、警示信息和警告信息等,設(shè)計的具體示例見表9。其中,第1~8項為基礎(chǔ)信息;第9項為關(guān)聯(lián)信息,如增加持證商、商品名或英文名稱更正等滾動信息以及《化學(xué)仿制藥參比制劑目錄(征求意見稿)》的信息等;第10項為支持信息,如RLD產(chǎn)品市場可及信息、GMP合規(guī)信息用于對比;第11項為警示信息,主要為可能存在問題但影響較小,如名稱、TE評價代碼、REMS品種等;第12項為警示信息,主要為存在問題且影響較大,如亞硝胺雜質(zhì)、GMP不合規(guī)、產(chǎn)品撤市等。
▲表9-我國仿制藥RLD數(shù)據(jù)庫品規(guī)單元內(nèi)容設(shè)計示例
4.討論
我國化學(xué)仿制藥RLD的遴選工作經(jīng)歷了從無到有、不斷完善的發(fā)展過程。我國RLD的遴選有其獨有的時代特點和要求,在發(fā)展過程中會不可避免地產(chǎn)生各種問題,應(yīng)該通過對這些問題的研究,針對性地提出綜合性解決方案。目前我國主要采用每批滾動更新的方式進行勘誤,但是隨著修訂、更新或調(diào)整需求的增加,這種方法很難及時反映出RLD的動態(tài)變化。RLD數(shù)據(jù)庫是解決這個問題的理想選擇,通過構(gòu)建RLD數(shù)據(jù)庫可以使我國的RLD目錄與來源國信息實現(xiàn)動態(tài)關(guān)聯(lián),提高使用效率和質(zhì)量,使其更好地為仿制藥研發(fā)、檢驗、審評和監(jiān)管提供服務(wù)和支持。
參考文獻
[1]國家藥品監(jiān)督管理局藥品審評中心,關(guān)于發(fā)布化學(xué)仿制藥參比制劑遵選與確定程序的公告(2019 年第25 號)[EB/0L].12019-03-25].hip://www.cde. og.cn/news. do? method= viewlnfoCommon&id= 314893.
[2]國家藥品監(jiān)督管理局藥品審評中心,關(guān)于在審化學(xué)仿制藥參比制劑有關(guān)事宜的通知[EB/0L].[2019-08-05].htp://www.cde.org.cnnews.do? method =viewInfoCommon&id =314915.
[3]World Health 0iganization. WHO Technical Report Series , No.992,Anex 8 :Guidance on the selection of comparator pharma-ceutical products for equivalenee assessment of interchangeablemultisource ( generie )products [ EBOL ].( 2015 ). http://www.who.intmedicines/areas/quality_safety/quality . assur-ance/Annex8-TRS992.pdf? ua = 1.
[4]US FDA. Apprved Dug Produets with Therapeutie EquivalenceEvaluations(Orange Book)[EB/0L].[2024-01-31 ]. ht-tps ://www.fda. gov/media/71474/download? attachment.
[5]US FDA. Orange Book : Appmved Drug Products with Therapeu-tic Equivalence Evaluations[EB/0L].[2024 -07 -01]. https ://www. aocessdata. fda.gov/scripts/oder/ob/index. cfm.
[6] 游正坤,孫春萌,劉意林,等,中美化學(xué)仿制藥參比制劑選擇與管理的對比及啟示[J],中國新藥雜志,2022,31(24):2458-2464
[7] 原國家食品藥品監(jiān)督管理總局,總局關(guān)于發(fā)布仿制藥參比制劑目錄(第一批)的通告(2017年第45號)[EB/OL].[2017 -03-171.hitps ://www. nmpa. gov.cnxxgk/ggig/ypggtg/ypqggg/20170317174801983.huml.
[8] 牛劍釗,楊東升,許鳴鏑.美國國家藥品編碼目錄在參比制劑可及性方面的應(yīng)用簡介[J1,中國新藥雜志,2019,28(3):274-277.
[9] 牛劍釗,楊東升,許鳴鏑.美國授權(quán)仿制藥在參比制劑可及性方面的應(yīng)用簡介[J],中國新藥雜志,2019,28(5):604-607
[10] 楊東升,南楠,馬玲云,等.美國重包裝、重貼標和自有品牌經(jīng)銷藥品的應(yīng)用簡介[J],中國新藥雜志,2019,28(15):1815 -1818.
[11] US FDA. Dgs @ FDA: FDA Approved Drug Produets [ EB/0L].[2024-07-01 ]. https ://www. accessdata. fda. gov/scriptsvcder/dat'index. cfm.
[12] 楊東升,牛劍釗,許鳴鏑.美國風(fēng)險評估與減輕策略對我國仿制藥參比制劑的影響[J].中國新藥雜志,2021,30(9):784 -790.
[13]楊東升,牛劍釗,許鳴鏑.歐美 CMP 數(shù)據(jù)庫在我國仿制藥參比制劑遴選方面的應(yīng)用[J],中國藥事,2021,35(4):406-414.
[14]NIU JZ, YANG DS, FENG YF, et al. The introduction of nitrs-amine impurities in medicinal products . J Chn Pherm Sei,2023.32(3):223.
[15]國家藥品監(jiān)督管理局,國家藥監(jiān)局關(guān)于注銷泛影葡胺注射液等87 個藥品注冊證書的公告(2024 年第43 號)[EB/OL].[2024-04-11].hitps://www.nmpa. gov.cn/xxgk/ggig/ypggig/ypqtggtg/20240417170535188 . himl.
[16]張卓成,李芳,安娜,等,我國化學(xué)仿制藥參比制劑遴選與管理方式淺析[J].中國新藥雜志,2023,32(5):476-480.

來源:新藥述評與論壇


