您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-04-30 20:31
混合均勻度(Blend Uniformity, BU)和含量均勻度(Content Uniformity, CU)在口服固體制劑(片劑和膠囊)的開發過程中一般均作為高風險評估相,二者存在一定的關聯,在實際研發過程中可能有這么一種情況BU不合格,但最終的CU合格,相反CU不合格的話,BU則一定不合格。見下圖:
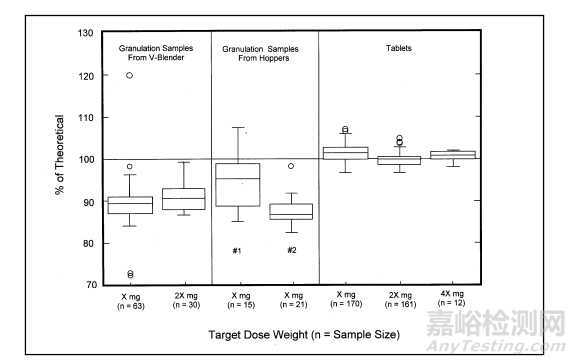
關于BU, CFDA組織編寫的藥品GMP指南口服固體制劑一書中是這么要求的:混合均一度應該控制在85%~115 % 或更嚴格的工藝指標,RSD不大于5% ,而對一般固體制劑,根據不同混合設備取6~10個點,至少應在上、中、下三個水平位置進行多點取樣,取樣量為1~3倍單位劑量,每個點的取樣量為3份。而CU,2015版藥典的通則0941則做了相應的規定。
混合均勻度作為一個重要的中控條件,直接影響最后制劑的質量,如含量、溶出等。影響混合的因素見下表:

混合均勻度中的取樣誤差對最終的結果影響顯著:如混合設備的類型、取樣技術、混合粉末(顆粒)的屬性、取樣的位置和樣本量的大小。
關于混合均勻度,FDA于1999年8月出臺了有關仿制藥混合均勻度的指導原則“ANDAs: Blend Uniformity Analysis”,但在2002年5月該指導原則予以撤銷,FDA的撤銷說明中提及一下兩點:1)當前有充足的混合采樣技術,2)有多種檢測混合均勻度的方法。在2003年10月一項新的指導原則關于粉末混合和制劑完成品取樣和評估“Powder Blends and Finished Dosage Units — Stratified In-Process Dosage Unit Sampling and Assessment”,經歷十年的廣泛應用后,于2013年8月FDA予以撤銷,FDA認為指導原則中的第五部分“Exhibit/Validation Batch Powder Mix Homogeneity”和第七部分“Routine Manufacturing Batch Testing Methods”已經不能滿足cGMP的要求。
雖然指導原則已經撤銷,但是其中提及的一些取樣和分析方法,我們依然可以借鑒,畢竟沒有采用過程在線分析的廠家在國內應該還占大多數。其流程圖如下:
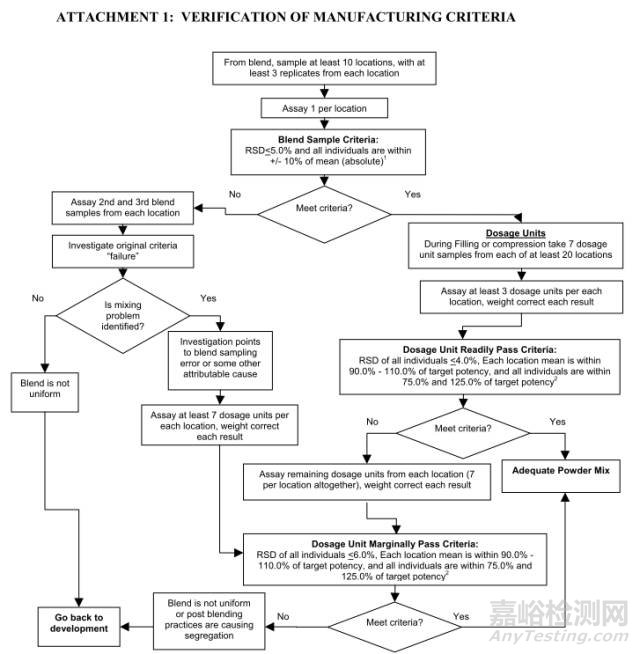
樣本量:單位劑量1~10倍,一般不低于3倍
取樣位置:粉末或顆粒混合一般取上、中、下三層,混合設備出料口處必須取,壓片或者膠囊填充開始和結束兩個時間點需取樣。

2013年ISPE(International Society for Pharmaceutical Engineering)年會上,多名FDA、知名藥企及USP相關專家提出對同年8月份撤銷的指導原則結合USP<905>提出修改意見,旨在提供一種適用于傳統和現代(PAT)都適用的取樣和分析方法。其具體流程圖如下:

Fig. 1 Process flow diagram for assessment of blend and content uniformity for process design and process qualification batches
CVA:Variance Component Analysis
ISPE對取樣點的分布沒有做特殊要求,但個人理解取樣點的設計要結合混合設備的性狀和原理,原則上就是要考慮到每一個可能含量導致不一致的代表性位置,如設備有強制混合部件的,比如螺桿和切割刀等位置也需取樣。

Fig. 2 Process flow diagram for assessment of blend and content uniformity for continued process verification (stage 3b) batches
參考文獻:
1. Guidance for Industry Powder Blends and Finished Dosage Units—Stratified In-Process Dosage Unit Sampling and Assessment
2. Trudy Yin.”A Guide to Blend Uniformity”. Journal of GXP Compliance, October 2007, Volume 12, Number 1, 46-51.
3. Jonathan Berman. The Compliance and Science of Blend Uniformity Analysis. PDA J Pharm Sci and Tech 2001, 55 209-221.
4. Current Events in Blend and Content Uniformity. 2013 ISPE Annual Meeting.
5. Thomas Garci, et al. Recommendations for the Assessment of Blend and Content Uniformity: Modifications to Withdrawn FDA Draft Stratified Sampling Guidance. J Pharm Innov, published online:12 Dec.2014

來源:Internet


