您當前的位置:檢測資訊 > 實驗管理
嘉峪檢測網 2024-11-25 08:36
前置知識
RNA是一種很容易降解的物質,由于RNA是單鏈結構,且生活環境中RNA酶無處不在,因而我們在實驗室提取RNA時要格外小心,應全程無RNase環境中操作,并佩戴好口罩、手套等。
在這里我將介紹兩種實驗室提取RNA的常用方法,并給各位小伙伴們提供一些小tips,歡迎大家一起討論學習。
RNA提取的常用方法
實驗室常用的提取動植物組織、細胞RNA的方法:一是比較傳統的需要添加氯仿的RNA提取試劑,這里以Thermo Fisher 公司的Invitrogen TRIzol試劑為例(后文簡稱“TRIzol法”),由于氯仿是劇毒易揮發的危化品,現在也有許多產品是免除氯仿的RNA提取試劑,這里以Vazyme公司的FreeZol Reagent為例(后文簡稱“FreeZol法”)。
上述的兩種方法的基本原理均是使用單相裂解試劑進行RNA提取,該方法中,生物樣品被異硫氰酸胍和苯酚的單相溶液所破壞而裂解,然后加入氯仿(或溴氯丙烷),混勻后離心,勻漿被分離成水相和有機相,RNA僅存在于上層水相,而DNA處于水相和有機相的分界處,變性蛋白存在于下層有機相。
回收水相后,通過加入異丙醇沉淀RNA。
如果需要提取DNA和蛋白質,可以通過順序沉淀分離:中間相用乙醇沉淀得到DNA,從有機相中用異丙醇沉淀獲得蛋白質;
從中間相回收的DNA為20kb大小,可用做PCR的模板;然而由于暴露于胍鹽,蛋白質是變性的,因此主要用于免疫印跡。
實驗操作實例
接下來我將以果蠅成蟲為例詳細介紹兩種方法的步驟
樣本處理:
A. 組織樣本
1.將新鮮組織用液氮速凍,迅速轉移至液氮預冷的研缽中,用研杵研磨,期間不斷加入液氮,直至研磨成粉末狀(無明顯可見顆粒)。
▲研磨不徹底會影響RNA的得率和質量。
2. 將研磨成粉的樣品轉移至離心管中,大約每50 mg組織加入1mL TRIzol (500μL FreeZol Reagent), 渦旋振蕩至充分裂解,室溫靜置5 min。
▲每500μL FreeZol Reagent最多可裂解50 mg動物/植物組織,過多的樣本量可能會導致裂解不充分,并使產物純度降低。肝臟、脾臟、腎臟等組織DNA/RNA含量豐富,過多樣本量還會導致gDNA殘留或產量降低。
▲若沒有條件用液氮研磨,可將新鮮組織盡量剪碎浸泡在單相裂解試劑中,用電動勻漿器高速勻漿至組織塊徹底裂解(這里我使用手動研杵研碎,手動研磨時應注意避免局部積熱,盡量在冰上進行)。
3. (可選)11,200 rpm(12,000 x g)室溫離心5 min。小心吸取上清至新的1.5 ml離心管,切勿吸取沉淀。
▲若樣本含有較多蛋白質、脂肪、多糖或肌纖維、植物塊莖等,可離心去除不溶物質,離心得到的沉淀包括細胞外膜、多糖、高分子量DNA,RNA存在于上清中。提取脂肪含量較高的組織樣本時,若上層含有大量油脂,應去除。轉移上清進行后續操作。
B. 懸浮細胞樣本
1.離心收集細胞,棄盡上清,每1×105~1×107個細胞加入1mL TRIzol (500μL FreeZol Reagent)。
2.渦旋振蕩或用移液器反復吹打直至充分裂解,室溫靜置5 min。
▲對于凍存細胞,加入FreeZol Reagent應立即進行振蕩,否則會導致裂解不充分。
C. 貼壁細胞樣本
1.棄去細胞培養液,用1×PBS清洗一次,棄盡廢液。
2.常規6孔板每孔或直徑3.5 cm平皿(約10 cm2培養面積)的細胞加入500μL FreeZol Reagent,每100mm平皿加入1mL TRIzol,使之充分覆蓋到細胞表面,然后用移液器反復吹打細胞使其脫落。
▲對于貼壁牢固的細胞(細胞團)可采用細胞刮或者潔凈的槍頭剝離,或增加單相裂解試劑的用量,亦可在加入單相裂解試劑之前采用胰酶將細胞消化下來,然后按照懸浮細胞處理。
3.將裂解液轉移至1.5 ml離心管,渦旋振蕩或用移液器反復吹打直至充分裂解,室溫靜置5 min。
▲浸在TRIzol試劑中的樣本可以在-60~-80°C存放至少一個月

TRIzol法提取RNA
1. 孵育勻漿樣品,室溫5min,以完全裂解核蛋白復合物;
2. 每毫升TRIzol加入0.2mL氯仿;蓋緊管蓋用力搖動15s,并在室溫下孵育2-3min;
▲不要渦旋樣品,因為它會導致DNA污染。
▲注意使溶液充分混勻為均一溶液,混勻不徹底影響RNA提取效率和雜質去除效率。
3. 4°C,12000g 離心15min,混合物分為三相,RNA僅存于上層水相;
4. 小心地將上層水相轉移至新Ep管內,注意不要擾動中間層;
▲每1mL TRIzol可獲得約600μL水相,為防止DNA污染推薦只回收500μL。
5. 每毫升TRIzol加入0.5mL異丙醇沉淀RNA,顛倒混勻,室溫孵育10min;
▲注意使溶液充分混勻為均一溶液,混勻不徹底將無法使RNA沉淀。
▲低濃度樣品中回收RNA時效率很低,可以在此步加入1μL糖原(20mg/mL)。
▲為防止溫度過高使RNA降解,也可以置于冰上、-20°C冰箱中進行沉淀。
6. 12000g離心10min,收集RNA沉淀;
7. 棄上清,并用吸頭完全去除殘留液體;
8. 用75%乙醇洗滌一次RNA沉淀,每毫升TRIzol加入至少1mL 75%乙醇,渦旋混合樣品液,然后在4°C 7500g離心5min;重復清洗一次;
▲沉淀于75%乙醇的RNA可儲存在2~8°C至少一周,-5~-80°C至少一年。
9. 完全去除乙醇,空氣干燥或真空干燥RNA沉淀10min;
▲除去乙醇后,沉淀應該是半透明的,在干燥時,沉淀將變成透明凝膠體狀。不要真空離心干燥的RNA。重要的是不要讓RNA沉淀完全干燥,因為這將大大降低其溶解度。
10. 用20~100μL的RNase free水溶解RNA,反復吹打幾次。
▲部分方案中建議在55-60°C溫育10min,這里我個人不建議進行加熱;若RNA過于干燥,可在40°C溫育直至其完全溶解。
FreeZol法提取RNA
1.向孵育勻漿樣品中加入Dilution Buffer。(動植物組織:每500μL FreeZol Reagent加入100μL Dilution Buffer;細胞:每500μL FreeZol Reagen加入150μL Dilution Buffer。)蓋緊離心管蓋,渦旋振蕩至溶液充分混勻,室溫靜置5 min。
▲振蕩時注意使溶液充分混勻為均一溶液,混勻不徹底影響RNA提取效率和雜質去除效率。
2. 12,000g室溫離心15 min。
3.小心取出離心管。此時樣本中蛋白質、DNA、多糖等雜質沉淀到管底,RNA分布在上層溶液中,小心吸取上清溶液(約500μL)至一個新的離心管中。
▲上層溶液的體積約占總體積的90%,用500μL FreeZol Reagent進行提取,上層溶液約為550μL ;吸到下層沉淀會導致基因組及雜質污染。
▲部分樣本上清輕微渾濁或有顏色,可繼續后續操作,不影響產量和純度。
▲組織投入量為50 mg時,吸取上清溶液體積建議減少至450μL ,防止吸到下層沉淀。
4.在得到的上清溶液中加入等體積異丙醇,上下顛倒充分混勻,室溫靜置10 min。
5. 12,000g室溫離心10 min,離心后在管側和管底可以看見白色凝膠狀沉淀,小心棄去上清,勿丟失沉淀。
▲RNA含量少會導致沉淀不明顯,小心棄去上清,勿丟失沉淀。
▲部分特殊樣本如:水稻葉RNA沉淀會分散在離心管壁上導致白色沉淀不明顯,小心棄去上清,步驟7離心后沉淀可見。
▲為減少雜質殘留,此步驟盡可能將上清棄干凈,勿丟失沉淀。
6.加入1 ml 75%乙醇。輕彈管底,讓沉淀懸浮起來,并上下顛倒數次。
7. 8,000 g室溫離心3 min,棄去上清,勿丟失沉淀。
8.重復步驟6和7一遍,棄盡上清。
▲為減少雜質殘留,應盡可能的將上清液棄干凈。建議棄去大部分上清后,短暫離心將所有液體甩至管底,再用移液器將剩余液體吸掉,注意不要吸到沉淀。
9.室溫放置晾干,加入20- 100μL RNase-free ddH2O溶解沉淀,室溫渦旋3 min(或使用移液器反復吹打),使RNA沉淀充分溶解。提取的RNA產物可以分裝后在-85 ~ -65°C長期保存,在-30 ~-15°C短期保存。
▲通常,RNA沉淀晾干2 - 3 min即可,不要過度晾干,RNA完全干燥后會很難溶解。
▲RNA產物需要充分溶解,否則可能導致濃度定量失準。
RNA質量分析
使用超微量紫外分光光度計,測量提取RNA樣品的A230、A260、A280,用來計算RNA樣品的濃度、估計RNA純度。
計算溶液中RNA濃度的公式:RNA樣品濃度(μg/mL)= A260×40×稀釋倍數
A260不能區分RNA和DNA,因此,建議用無RNase的DNase處理RNA樣品去除DNA污染。
此外,污染物如苯酚和蛋白質會影A260的讀數; 苯酚在波長為260nm處有強烈的吸收,而芳香族氨基酸的吸收在280nm處。
在260nm處吸光度相對于280nm的吸光度比值( A260/A280)可以用來評估RNA樣品中蛋白質的污染水平。純的RNA的A260/A=值接近2.0。
如果有明顯的蛋白質或酚污染,A260/A280 比小于2.0,用紫外分光光度法將不可能準確定量核酸含量。
另一個比值A260/A230可用于評估有機化合物或高離液鹽( chaotropic salt)的污染水平,它們在波長230nm處有強烈吸收,導致低A260/A230。
理想情況下,提取RNA的A260/A230的比例應接近2.0。
▲A260/A280 比值依賴于pH和離子強度。隨著pH的增加,A280 降低, 但A260 不受影響,從而A260/A280的比值增加。因為純水pH為酸性,如果使用它們溶解RNA, A260/A280的比值可能偏低。因此為了準確的可重復的讀數,最好使用緩沖液如TE (pH 8.0)作為稀釋劑和空白對照。
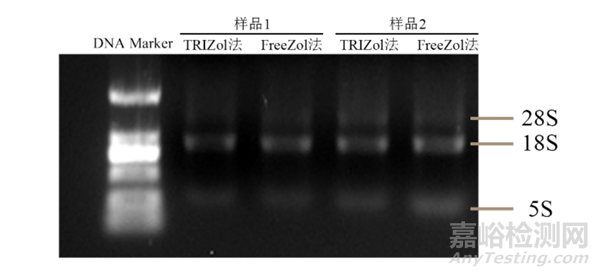
瓊脂糖凝膠電泳分析:
提取的RNA質量優劣可以通過簡單的非變性瓊脂糖凝膠電泳進行檢測,使用MOPS或TBE緩沖液、配制0.8%瓊脂糖凝膠,在4~5V/cm電壓下進行電泳,若RNA純度較好將會有清晰的三(四)條帶(28S、18S、5.8/5S)且亮度均一(上樣質量一樣)。
常見問題&解決方案


來源:實驗老司機


