您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-10-29 13:38
可吸收聚合物支架由生物可降解聚合物構成,其理念是為血管提供特定時期的支持,通常服役結束后可以逐漸降解直至完全吸收, 同時使血管完成自適應重塑,最終使血管愈合并恢復到自然的狀態,這是傳統DES不具備的功能。
由于這類BVS可被人體完全吸收,可有效降低傳統DES晚期再狹窄及血栓形成的風險。理想情況下,BVS在植入早期需保持足夠的徑向支撐強度以防止血管回縮, 同時釋放抗增殖藥物。在愈合期結束后, BVS將降解并完全被吸收,使病變血管逐漸恢復正常的血管收縮功能。也就是說, BVS在短期療效上類似于當前使用的DES , 但能改善DES所導致的長期不良結果。與DES相比, BVS不僅適用于年齡較小的患者, 還適用于DES效果不良的患者。

研究表明, DES的剪切應力模式可影響支架植入后新內膜增生的程度。與DES 相比, 由生物可吸收的聚合物材料制成的BVS更柔順,因此其剪切應力模式的影響程度將更小。而且,BVS的使用可免去血管被永久性禁錮,因而使得血管可以有效響應生理剌激以進行晚期重塑。進一步,隨著DES 的逐漸降解和血管重塑的逐漸完成,患者無須長期雙重抗血小板治療,大大降低了出血風險, 對于年輕患者,BVS的原位吸收允許將來在同一部位進行再次干預并且便于進入被原始支架禁錮的側支。表8.2 中對比了使用BVS 的潛在優勢。
1、VBS的設計原則與階段功能
BVS 植入后大體上需經歷以下三個功能階段:血運重建、血管重構、支架吸收,如圖所示:

1-血管重建
此階段類似于DES的功能,主要是為血管狹窄病變處提供足夠的力學支撐,從而減輕因缺血引起的血管狹窄。與BMS和DES相比, BVS增加了支撐寬度和厚度以提供與金屬材料相媲美的強度。但即使如此,在血管重建期, BVS仍然顯示出比金屬材料更多的優勢,如更大的靈活性與適應性、更少的幾何畸變、更少的血小板沉積。此階段一般發生在術后前3個月內。
2-血管重構
BVS在這個階段逐漸降解,從而使聚合物的分子量逐漸降低,開始失去原有的機械支撐作用。一般情況下,首先觀察到BVS骨架開始逐步喪失機械支撐能力,進一步其表面和內部逐漸開始潛解,其溶解速度主要受溫度和水的影響。隨著聚合物支架的逐步降解過程的發生,其對血管病變處機械支撐和約束力也逐步消失,管腔得以逐步恢復,進而血管的生理脈動功能也開始逐步恢復。此階段一般發生在術后3-12個月內。
3-支架吸收
通過BVS的完全吸收來完成血管結構和功能的重建,根據所使用的材料不同,全部完成可能需要2-4 年。研究表明,在BVS植入豬模型后的12-18個月后,管腔內外彈性區域和管腔面積明顯增加。相似的是,在患者植入可吸收支架1-5年后,連續血管內超聲和光學相干斷層成像(OCT) 也證實了管腔面積的明顯增加。
這與DES是完全不同的, DES會隨著斑塊在金屬框架內聚積,其血管的平均/最小管腔直徑會逐漸減少。而BVS則會隨著聚合物被人體的逐漸吸收變成由膠原和血管平滑肌取代,并隨著時間的推移,其管腔反而會逐漸恢復。進一步,這個過程中擴大的管腔還會對血管內皮功能和動脈粥樣硬化的預防有利。
2、VBS的制備加工技術、種類及優缺點
一,當前的制備技術
1) 管材擠出-激光切割加工成型
國際上大多數公司的研制工作通常都是利用螺桿擠出機將原料熔融擠出制備管材,再對管材進行激光切割以制成最終的支架產品。其中,塑料擠出成型是用加熱的方法使塑料成為流動狀態,然后在一定壓力作用下使其通過塑模,經定型后制得連續的型材。擠出成型具有效率高、投資少、制造簡便、可連續化生產等優點。聚合物血管支架的擠出-切割原理與金屬支架的擠出-切割原理類似,其具體原理和過程如圖所示:
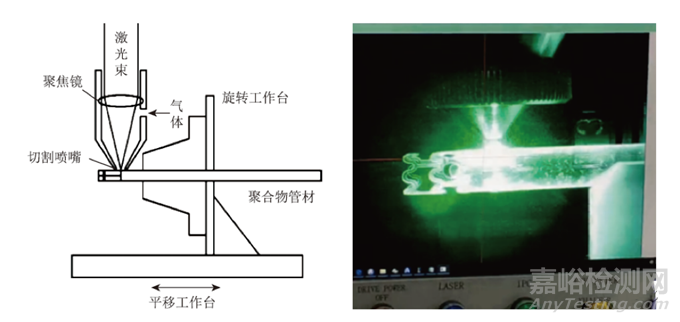
為了制備成最終可壓握在球囊導管上的支架花型,聚乳酸等聚合物材料經擠出加工成一定直徑的管材結構后,需選用合適的激光切割裝置進行進一步的激光切割雕刻出復雜的網狀結構。與其他切割方法相比,飛秒激光切割具有切縫寬度小、切口平行度好、表面粗糙度小、尺寸精度高、工件變形和熱影響區小、無機械應力及表面損傷等特點,可精確切割形狀復雜的精細零件。
2) 編織成型
近年來,受人工小血管制造工藝的啟發,血管支架也出現了采用編織結構的工藝技術。Upma Sharma 等開發了一種采用編織方法制備的基于PLGA 材料制備的新型BVS ,見下圖:

(a) PLGA 編織物的掃描電鏡圖; (b) 涂層后的PLGA 編織物的掃描電鏡圖; (c) 涂層后纖維截面圖,其中黃色的是PLGA 纖維, 藍色的是涂層; (d) 和(e) 支架的實物圖; (f) 涂層的化學反應示意圖
在豬股動脈中體現出良好的生物可吸收性能。在羊體內,支架可以支撐管腔12個月之久,并且18個月可以被完全吸收。據報道,這種新型的BVS可以充分利用編織結構靈活性高的特點,使支架具有較好的縱向柔順性,更易貼合血管內壁,對血管內膜的損傷較小,不易誘發血管內膜的增生。
然而,編織結構的BVS 的力學支撐力較差,編織過密又不易實現支架的擴張。為此,他們在PLGABVS 表面進一步涂敷一層聚乙交醋-己內醋(PGCL)彈性體,并用六亞甲基二異氨酸醋(HDI)原位進一步交聯,結果表明,涂敷此彈性體后,支架的力學強度(如壓縮膨脹和彈性性能)得以顯著提升,可以和作為對比的金屬材料支架的力學性能相媲美。這種改性方法可以通過調節涂層的交聯度、分子量和分子支化結構來調控其力學性能。
3) 3D打印成型
擠出-激光切割和編織成型的支架通常是根據臨床統計數據而篩選出的幾種相對常見的尺寸進行預先批量式生產,因而醫生僅能從中選擇與患者血管尺寸相對較為接近的支架進行植入手術。3D打印則可根據不同患者的尺寸形態進行個性化定制化制備, 不僅如此, 3D打印成型還具有精度高、速度快、用料省等優點,且可實現復雜外形與內部精細結構的一體化制造, 這是傳統支架加工制備方法所無法實現的。
近年來, 隨著3D打印技術的不斷發展, 利用3D打印制備血管支架的報道也開始涌現。其中,光固化立體印刷(SLA) 是最早,也是現今應用最廣泛的3D打印技術。SLA具有精度高、性能穩定、材料力學性能可調等優點,因而成為制備個性化心血管支架的一種新型加工成型方法。在此基礎上,來自美國西北大學的科學家通過對SLA 進一步改良,開發了一種被稱為投影微立體光刻(PμSL)的3D打印技術(下圖),結合實驗室自主研發的擰棱酸醋類聚合物,成功研制出新型3D打印血管支架。

*PμSL 工作原理示意圖
此外,北京阿邁特醫療器械有限公司采用熔融沉積成型(FDM) 制備了PLA 和PCL血管支架。因此, 開發適用于全降解聚合物支架的新型3D 打印技術將是未來的發展方向之一。

二,現有BVS種類
目前用作血管支架的聚合物材料最常見的是聚乳酸(PLA) ,具體包括左旋聚乳酸(PLLA)、右旋聚乳酸(PDLA) 和外消旋聚乳酸(PDLLA) ,另外還有聚己內酯(PCL)、聚乙交酯(PGA) 以及由這幾種高分子組成的嵌段聚合物,如聚乳酸·羥基乙酸共聚物(PLGA) 。嵌段共聚物可以改善單一組分聚合物的力學性能和降解性能,是一種常見的改性方式。可降解聚合物支架相較于可降解金屬支架的優勢在于可以通過合成及加工的手段改變聚合物的各組分配比來改善聚合物的各種性能,例如,通過引入PGA 來提高聚乳酸的降解速率,或通過引入PCL 來提高聚乳酸的柔韌性,降低脆性斷裂的風險。這幾種高分子在體內最終的降解產物都為水和二氧化碳,不會對人體產生毒副作用。


來源:醫休神介說


