您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-09-21 22:04
摘 要 / Abstract
特應性皮炎在成人和多個年齡段兒科人群中均有發生。度普利尤單抗注射液是首個靶向白介素-4 受體亞基α(IL-4Rα) 的全人源化的免疫球蛋白G4(IgG4)亞類單克隆抗體,用于治療成人和兒童人群不同程度的特應性皮炎。本文詳細梳理了度普利尤單抗注射液兒科人群特應性皮炎適應癥的研發歷程和臨床藥理學研究內容。該產品采用年齡順序從大到小、分階段交錯、逐步遞進的研發策略,開展多個兒科臨床研究,同時充分利用兒科人群暴露量數據與成人暴露量進行匹配,并結合暴露- 效應分析進行兒科人群的劑量選擇。本文還深入分析了當前我國兒科特應性皮炎適應癥研發的進展和現狀,以期為我國兒童用藥研發提供參考。
Atopic dermatitis occurs in adults and pediatric populations of all ages. Dupilumab injection is the first fully humanized immunoglobulin G4 (IgG4) subtype monoclonal antibody against targeting the interleukin-4 receptor subunit α(IL-4Rα), used to treat varying degrees of atopic dermatitis in both adults and children. This article reviews the development process and clinical pharmacology studies of dupilumab injection for pediatric atopic dermatitis indications. The product development strategy involved a stepwise, age-sequential approach, starting from older children to younger age groups. Multiple pediatric clinical studies were carried out progressively, utilizing pediatric exposure data to match adult exposure and combining exposure-effect analyses for dose selection in pediatric patients. The current progress and status of the development of pediatric atopic dermatitis indications in China were also analyzed, aiming to provide references for domestic pediatric drug development.
關 鍵 詞 / Key words
度普利尤單抗;特應性皮炎;兒童用藥;臨床藥理
dupilumab; atopic dermatitis; children's medication; clinical pharmacology
特應性皮炎(atopic dermatitis)是一種慢性、復發性、炎癥性皮膚病,以皮膚干燥、慢性濕疹樣皮損和明顯瘙癢為基本特征,嚴重影響患者精神狀態和生活質量。發達國家和地區兒童患病率約10%~25%, 青少年患病率約5%~20%, 成人患病率約2%~8%。兒科人群特應性皮炎患病率高于成人[1-2],臨床用藥需求迫切。
為鼓勵兒科人群用藥特應性皮炎適應癥的研發,2018 年美國食品藥品監督管理局(Food and Drug Administration ,FDA)發布指南[3],對藥物研發過程中兒科研究的時機予以明確,建議在成人早期研究中獲得有效性和安全性的初步證據之后,就開展兒科人群特應性皮炎患者的臨床研究。此外,對于研究人群,FDA 建議采用年齡順序策略,即在開展年齡較大的兒科亞群研究之后,再開展年齡較小的兒科亞群。國家藥品監督管理局藥品審評中心發布《成人用藥數據外推至兒科人群的定量方法學指導原則(試行)》(以下簡稱《指導原則》),針對采用成人用藥數據進行兒科人群的安全有效性外推進行了整體的指導[4],其中對于兒科外推的整體策略以及外推過程中采用的定量方法進行了較為詳細和系統的介紹。《指導原則》強調“對于創新藥,在首次制定兒科藥物研發策略或外推計劃時,通常尚無藥物在成人中安全性和有效性的充分數據(例如,成人藥物研發僅進行到II 期研究),在成人中的治療窗數據往往也不夠充分,無法評價暴露- 效應關系在兒科人群和成人中的相似性,因此面臨更多的不確定性和知識缺口。此時的外推計劃通常需收集較全面的兒科人群數據”。此外,對于劑量選擇《指導原則》提出“在選擇兒科人群研究中的初始劑量時,可通過匹配成人中的目標暴露量為兒科人群選擇科學合理的初始劑量提供依據” 。雖然《指導原則》給予了一些針對性建議,但對于如何設計開展臨床藥理學研究支持兒科人群的劑量選擇等暫未具體建議。
度普利尤單抗(dupilumab)是一種靶向白介素-4 受體亞基α(IL-4Rα)的全人源化的免疫球蛋白G4(IgG4) 亞類單克隆抗體, 通過與IL-4Rα 亞基結合, 抑制IL-4 和IL-13 信號傳導, 從而抑制輔助型T 細胞2 介導的炎癥反應,有效地阻斷2 型炎癥引起的皮膚屏障破壞和瘙癢,從而達到治療作用。度普利尤單抗注射液是全球范圍內首個靶向用于治療12 歲及以上中重度特應性皮炎的靶向生物制品[5],此前皮質類固醇(topical corticosteroids,TCS) 是唯一被批準用于兒科人群的系統性用藥。度普利尤單抗注射液首先于美國獲批上市,目前已批準用于6 月齡以上嬰幼兒中重度特應性皮炎患者,適用人群涵蓋了嬰幼兒至青少年的全年齡段兒科人群[6]。
本文以度普利尤單抗注射液兒科人群特應性皮炎適應癥的研發為例,重點介紹了該類產品的整體研發策略以及不同年齡段劑量選擇的關鍵考慮,并深入分析我國兒科人群特應性皮炎適應癥的研發進展,以期為我國兒科人群藥物研發提供參考。
1、度普利尤單抗注射液特應性皮炎兒科人群開發整體策略
在全球范圍內,度普利尤單抗注射液首先在美國獲批上市。本文以FDA 批準時間線為引導,梳理了度普利尤單抗注射液特應性皮炎適應癥的獲批情況(表1),并結合支持目標年齡段人群上市的臨床試驗開展情況,分析度普利尤單抗注射液兒科人群特應性皮炎適應癥的整體研發策略。
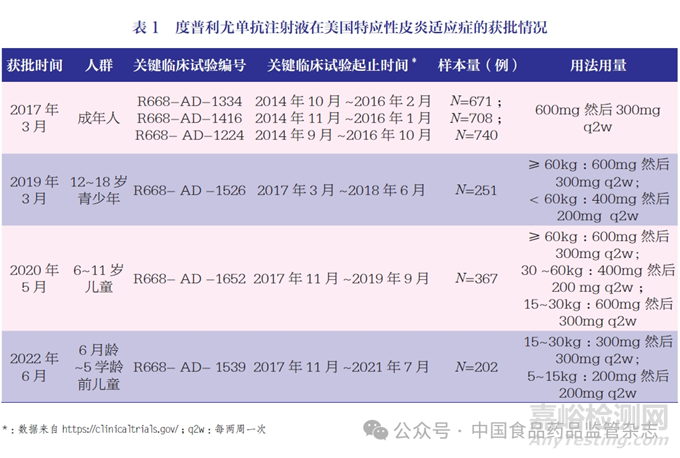
通過梳理FDA 審評報告[7-10],并結合臨床試驗的起止時間,筆者梳理了度普利尤單抗注射液特應性皮炎適應癥的研發過程,主要情況如下。
早在2010 年5 月, 針對度普利尤單抗注射液成人特應性皮炎適應癥的新藥臨床試驗申請前會議(Pre-IND),首次對兒科人群的研發提出建議。FDA 建議申請人開始在兒科人群中的研究之前,需要確定度普利尤單抗注射液在成人(18 歲及以上)中的安全性和有效性。
2014~2016 年,申請人開展了3 項成人特應性皮炎適應癥的關鍵臨床試驗。2015 年11 月,在成人臨床試驗期間FDA 與申請人就初步兒科人群用藥研究計劃(initial pediatric study plan,iPSP) 達成一致。根據商定的iPSP,申請人將在特應性皮炎兒科人群中進行以下臨床研究:①一項隨機、雙盲、安慰劑對照的Ⅲ期臨床研究,旨在研究度普利尤單抗注射液在12~18 歲中度至重度特應性皮炎患者中的療效和安全性。②一項隨機、雙盲、安慰劑對照的Ⅲ期臨床研究,旨在研究度普利尤單抗注射液在6~11歲嚴重特應性皮炎患者中的療效和安全性。③一項Ⅱ / Ⅲ期臨床研究,旨在評估度普利尤單抗注射液在6 月齡~5 歲嚴重特應性皮炎患者中的安全性、藥動學(pharmacokinetics,PK) 和療效。④一項開放標簽擴展臨床研究,評估度普利尤單抗注射液在6 月齡~18 歲以下特應性皮炎患者中的長期安全性和有效性。
此外,根據商定的iPSP,由于度普利尤單抗注射液正在研發用于治療未充分控制或對局部外用TCS 藥物不耐受的中度至重度特應性皮炎[ 例如,研究者總體評估(investigator's global assessment , IGA)≥ 3],在6月齡以下嬰幼兒進行研究是不可能的或非常不切實際的,因此擬定的開發計劃不包括6 月齡以下的嬰幼兒。
申請人基于3 項成人Ⅲ 期臨床研究結果,于2016 年7 月提交成人特應性皮炎適應癥上市申請, 于2017 年3 月獲批成人適應癥。2017 年, 同期開展12~18 歲青少年關鍵臨床試驗(R668-AD-1526), 半年后又開展了6~11 歲兒童關鍵臨床試驗(R668- AD -1652),以及6月齡~5 歲關鍵臨床試驗(R668-AD 1539)。由于試驗進度不同,以上3 項兒科人群關鍵研究分別為2018 年6 月,2019 年9 月以及2021 年7 月完成。度普利尤單抗注射液于2019 年3 月獲批12~18 歲青少年人群,2020年5 月獲批6~11 歲兒童,2022年后獲批6月齡~5歲學齡前兒童。
需要注意的是, 早在2015年3 月, 即成人特應性皮炎適應癥關鍵臨床研究進行過程中,申請人同步啟動了兒科人群的R668-AD-1412 臨床試驗, 以期了解特應性皮炎兒科人群的安全耐受性和PK 等特征。R668-AD-1412 臨床試驗于2016 年3月結束,早于12~18 歲青少年關鍵臨床試驗的開始時間。
基于以上整體兒科人群的研究策略,可以看出兒科人群特應性皮炎的臨床表現和治療方法與成人有一定的相似性, 并基于ICH《E11A :兒科外推》,采用部分外推的策略進行兒科人群的研發。同時,綜合以上關鍵臨床試驗和支持性臨床試驗的研究進程可知,度普利尤單抗注射液兒科人群特應性皮炎適應癥的研發具體采用了基于年齡從大到小的順序、交錯和逐步遞進的方式開展兒科人群臨床研究。
2、12~18 歲青少年給藥方案
2.1 12~18 歲青少年的PK 數據
支持12~18 歲青少年人群的PK、安全性有效性度普利尤單抗注射液數據來自以下臨床試驗,見表2。

在開展目標人群關鍵臨床試驗前, 需先開展R668-AD-1412 臨床試驗, 以獲得12~18 歲青少年較全面的PK 特征。該研究中PK 采血點包括半密集的采血以支持采用非房室模型獲得藥物峰濃度(Cmax)和藥時曲線下面積(AUC)等PK 參數,以及多次給藥的第71 天和第85天給藥前進行采血,即第三、第四次重復給藥劑量以獲得谷濃度(Ctrough)。通過整合補充采樣時間,以構建每個組完整的平均濃度-時間曲線。結果顯示,12~18 歲青少年2mg/kg 和4mg/kg qw給藥劑量方案下的平均穩態濃度分別與成人中300mg q2w 和300mg qw 給藥劑量方案結果相似,300mg q2w 和300mg qw兩個劑量是成人Ⅲ期關鍵臨床試驗中探索的劑量[11]。2mg/kg qw和4mg/kg qw 方案之間的Ctrough呈線性劑量比例趨勢,為Ⅲ期臨床試驗劑量水平和暴露的選擇提供了支持,并表明靶點介導途徑飽和(即達到最佳療效所需的最低條件)。
基于成年健康人群和特應性皮炎患者的PK 數據建立了群體PK 模型[12]。群體PK 模型顯示,體重對度普利尤單抗暴露具有顯著影響并具有臨床意義。為了進一步支持12~18 歲青少年人群的劑量選擇,解釋與成人的體型差異,確定了接受體重分級給藥劑量方案的青少年的度普利尤單抗注射液穩態暴露情況與批準的成人給藥劑量方案的暴露情況進行比較。12~18 歲青少年人群在關鍵臨床試驗R668-AD-1526 的給藥劑量設置如下:①基于固定體重分層的度普利尤單抗注射液q2w 給藥劑量治療,患者基線體重60kg 以下, 皮下注射(SC)度普利尤單抗,第1 天給予負荷劑量400mg, 然后從第2 周~第14 周200mg q2w 給藥劑量;患者基線體重60kg 及以上, SC度普利尤單抗,第1 天給予負荷劑量600mg, 然后從第2 周~第14 周300mg q2w 給藥劑量;患者基線體重60kg 以上12~18歲的青少年給藥劑量劑量同成人獲批劑量一致。②未基于體重分層的度普利尤單抗注射液 q4w 治療:SC 度普利尤單抗,第1 天給予負荷劑量600mg,然后從第4周~ 第12 周300mg q4w 給藥劑量。
同時在關鍵臨床試驗R668-AD-1526 中在基線( 第1 天給藥劑量前), 第2、4、8、12 和16 周給藥劑量前,第28 周研究結束時持續采集藥物濃度獲得PK數據,結果顯示:各給藥劑量方案在第12 周達到了穩態。在第16 周,200mg/300mg q2w 和300mg q4w 給藥劑量方案的度普利尤單抗Ctrough 的x¯±s分別為(54.5±27.0)mg/ml和(19.8±15.9)mg/ml。
2.2 基于暴露匹配的兒科外推過程
在外推過程中收集兒科人群的PK 信息,一方面要表征兒科人群的PK 特征,另一個非常重要的方面是將兒科人群的暴露與成人進行比較。在青少年中,體重60kg 以下患者200mgq2w (51.3mg/L) 給藥劑量和體重60kg 及以上患者300mgq2w(57.9mg/L) 給藥劑量的Ctrough 中位值低于成人300mg q2w(74.6mg/L)給藥劑量。體重60kg 以下患者300mg q4w(27.2mg/L) 給藥劑量和體重60kg 及以上患者300mg q4w(12.7mg/L) 給藥劑量的平均Ctrough 分別為成人300mg q4w給藥劑量的37% 和17%(圖1)。同時,基于模型模擬表明,在青少年中總體暴露量略低于成人。

2.3 暴露- 效應關系
除了對青少年人群的PK 特征進行探索和比較外,申請人也對度普利尤單抗注射液青少年人群的暴露- 效應關系進行了分析。使用度普利尤單抗暴露與藥物效應的散點圖[ 濕疹面積和嚴重程度指數(eczema area andseverity index,EASI) 評分和每日峰值瘙癢(numeric ratingscale,NRS) 評分中基線的百分比變化] 或二元療效終點的邏輯回歸( 達到IGA 0 或1 和EASI-75 的比例)進行暴露- 有效性的關系研究。采用第16 周時度普利尤單抗的Ctrough 作為主要暴露指標;有效性終點的非線性logistic 回歸分析采用非線性Emax函數表征E-R 曲線[13],如圖2所示。結果顯示,在度普利尤單抗注射液治療的青少年特應性皮炎患者中,觀察到暴露與有效性呈正相關。同時, 根據青少年200/300mg q2w 的體重分級給藥劑量方案表明,對于有效性指標IGA 得分為0 或1,模型預測的穩態濃度谷值接近其各自E-R曲線的平臺值。在第16 周時,EASI-75 的E-R 關系、EASI與基線的百分比變化以及NRS與基線的百分比變化在各年齡組中都觀察到了類似的結果。
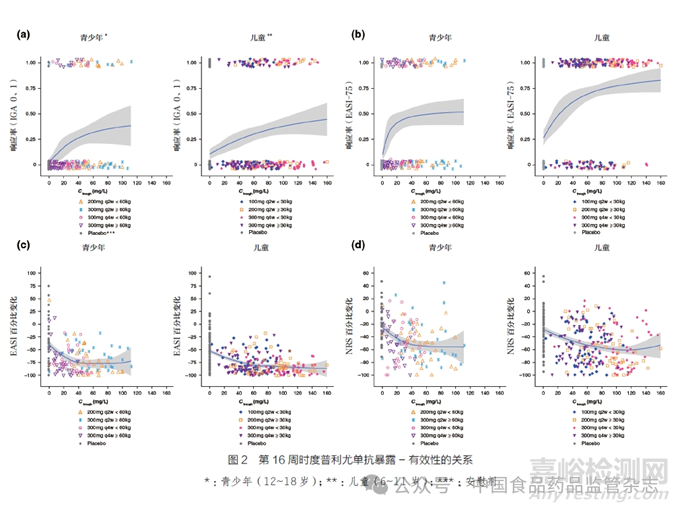
在成人和青少年特應性皮炎Ⅲ期臨床試驗中,度普利尤單抗組患者的結膜炎發病率高于安慰劑組患者,因此對第16 周度普利尤單抗Ctrough 與結膜炎發生概率之間的潛在關系進行了評估。線性邏輯回歸分析顯示:①結膜炎的發生率與度普利尤單抗的濃度之間沒有關系;②缺乏劑量限制性不良事件和暴露- 安全關系。
2.4 給藥劑量方案合理性評估
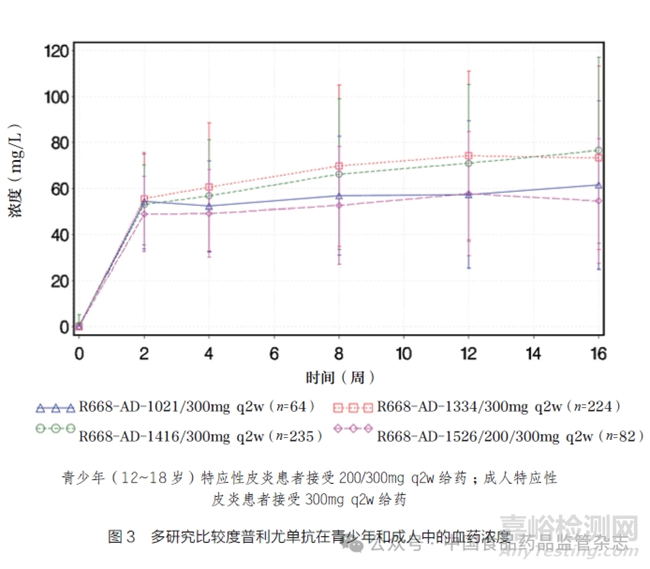
度普利尤單抗注射液的獲批青少年劑量為體重60kg 以下:400mg 然后 200mg q2w ;體重60kg 及以上:600mg 然后 300mg q2w。Ⅲ 期臨床試驗R668-AD-1526 的有效性和安全性數據全面支持體重分級給藥劑量方案的合理性,具體評估流程包括:① Ⅲ 期臨床試驗R668-AD-1526 中, 體重60kg以下接受200mg q2w 方案的青少年和體重60kg 及以上接受300mg q2w 方案的青少年在第16 周時獲得了相似的度普利尤單抗血清濃度。群體PK 分析還表明,體重分級的200mg/300mg q2w方案在兩個體重組之間度普利尤單抗-x、峰值和Ctrough 的穩態下暴露相似。②整個給藥劑量期間,接受200/300mg q2w 給藥劑量方案的青少年特應性皮炎患者的度普利尤單抗濃度與接受批準的300mg q2w 給藥劑量方案的成人特應性皮炎患者的濃度相似,如圖3 所示。③在度普利尤單抗注射液治療的青少年特應性皮炎患者中,觀察到療效與E-R 呈正相關。④在青少年關鍵臨床試驗R668-AD-1526 中觀察到的最常見的不良事件是結膜炎。發生結膜炎的患者百分比與度普利尤單抗濃度四分位數的增加順序相似,也能夠表明結膜炎缺乏E-R關系 。
3、6~11 歲兒童的給藥方案
3.1 6~11 歲兒童的PK數據
度普利尤單抗注射液支持6~11 歲兒童的PK、安全性有效性數據來自以下研究:①關鍵臨床試驗R668-AD-1652 是一項隨機、雙盲、安慰劑對照研究,納入367 名(6~11 歲)患有嚴重特應性皮炎的兒童,評價度普利尤單抗聯用外用TCS 的療效和安全性。② 2 項支持性臨床試驗的PK 結果,分別來自臨床試驗R668-AD-1412 和R668-AD-1434。
在開展目標人群Ⅲ 期關鍵臨床試驗前, 需先開展臨床試驗R668-AD-1412, 以獲得6~11 歲兒童的PK 結果。在度普利尤單抗注射液兒科項目的早期階段,Ⅱa 期臨床試驗R668-AD-1412 被用于預測Ⅲ期臨床試驗的血藥濃度。Ⅲ期臨床試驗的劑量選擇、劑量調整和體重臨界值的選擇是基于Ⅱa 期臨床試驗設計期間進行的模擬, 目的是確保青少年的Ctrough 與成人300mg q2w 的數據相似, 且不超過成人的Cmax。因此,Ⅲ期臨床試驗的劑量設置為,①基于固定體重分層的度普利尤單抗q2w治療組:基線體重在15~30kg 以下的患者:第1 天給予200mg負荷劑量,之后在第2~14 周進行度普利尤單抗100mg q2w SC給藥。基線體重在30kg 及以上的患者:第1 天給予400mg 負荷劑量,之后在第2~14 周進行度普利尤單抗200mg q2w SC 給藥。②未基于體重分層的度普利尤單抗q4w 治療組:在不考慮體重的情況下,第1 天給予600mg負荷劑量,之后在第4~12 周進行度普利尤單抗300mg q4w SC給藥;將所有基線體重15kg 及以上的患者隨機分配至q4w 組接受該方案(注:按照體重30kg以下和30kg 及以上對該治療組患者進行分層)。
同時在關鍵臨床試驗中持續收集PK 數據,即在第0、4、8、12、16 周(治療結束)給藥前收集血清樣本,然后在第24 周和48 周(研究結束)隨訪時收集血清樣本。結果顯示, 在主要臨床試驗終點評估之前( 即第16 周), 藥物已達到穩定狀態;q2w 給藥方案在第8 周達到穩定狀態,q4w 給藥方案在第12 周達到穩定狀態。在第16 周時,300mg q4w、200mg q2w和100mg q2w 給藥方案中度普利尤單抗的血藥濃度x¯±s 分別為(76.3±37.2)、(84.5±36.2)mg/L 和(61.5±33.1)mg/L。
3.2 基于暴露匹配的兒科外推
通過對6~11 歲兒童PK 結果與12~18 歲青少年以及成人比較可知, 體重30kg 以下組300mg q4w(98.7mg/L)和體重30kg 及以上組200mg q2w(86.0mg/L)的第16 周Ctrough 都超過成人的300mg q2w 給藥組,而體重30kg 以下組100mg q2w給藥劑量(62.6mg/ L) 和體重30kg 及以上組300mg q4w 給藥劑量(53.9mg/L)的第16 周Ctrough 較低,但與成人和12~18歲青少年患者q2w 給藥劑量方案在一個相似的范圍內。
基于模型分析表明,在體重30kg 及以上接受200mg q2w 給藥劑量的6~11 歲兒童和體重30kg 以下接受300mg q4w 給藥劑量的6~11 歲兒童,穩定狀態下Ctrough與接受300mg q2w 給藥劑量的成人相似或更高。所選給藥方案在兒童中的暴露量通常高于接受300mg q2w 給藥劑量的成人,但在體重30kg 及以上接受200mg q2w 給藥劑量的6~11歲兒童和體重30kg 以下接受300mg q4w 給藥劑量的6~11歲兒童中,穩態下最大濃度的第95 百分位數低于接受300mg qw給藥劑量的成人(成人測試的最大暴露量)。
3.3 暴露- 效應關系
暴露- 有效性關系顯示,在第16 周達到IGA 0、1 和EASI-75 的概率表明,與100mg q2w給藥方案相比,300mg q4w 給藥方案在體重30kg 以下6~11歲兒童中的平均Ctrough 暴露更接近各自E-R 關系的平臺期,100mg q2w 給藥劑量在穩態下Ctrough 較低。暴露- 安全性關系顯示,6~11 歲兒童使用度普利尤單抗至第16 周發生結膜炎的logistic 回歸相關概率顯示,較低藥物濃度下發生結膜炎的概率最高,較高藥物濃度下發生結膜炎的概率最低,呈E-R 負相關趨勢。該觀察結果與安全性研究結果一致,表明100mg q2w 給藥劑量方案(低劑量暴露)的結膜炎不良事件發生率較高。
3.4 給藥劑量方案合理性評估
6~11 歲兒童度普利尤單抗注射液上市獲批劑量為30~60kg:400mg然后 200mg q2w ;15~30kg :600mg 然后 300mg q4w。Ⅲ期臨床試驗R668-AD-1652 的有效性和安全性數據全面支持體重分級給藥劑量方案的合理性,PK和E-R 分析結果進一步支持劑量合理性,具體給藥劑量方案如下:①在Ⅲ期臨床試驗R668-AD-1652 中, 體重15~30kg的6~11 歲兒童接受300mgq4w 給藥方案;體重30kg 及以上的6~11 歲兒童接受200mgq2w 給藥方案,在第16 周獲得相似的度普利尤單抗血藥濃度。②基于群體PK 模型模擬的度普利尤單抗暴露比較表明,在體重30kg 以下的6~11 歲兒童中,給藥劑量方案為300mg q4w 的度普利尤單抗暴露(Ctrough, Cmax和AUC) 高于12~18 歲青少年(200/300mg q2w) 和成人(300mg q2w),而在體重30kg以下的6~11 歲兒童中, 給藥劑量方案為100mg q2w 的度普利尤單抗暴露與批準劑量下12~18 歲青少年和成人的預測暴露更具可比性。③ 暴露- 有效性關系以及暴露- 安全性關系均證明,給藥劑量方案為:體重30kg 以下6~11 歲的兒童中300mg q4w,有更多患者達到有效性平臺,且發生結膜炎的概率較低。
4、6 月齡~5 歲學齡前兒童給藥方案
4.1 6 月齡~5 歲學齡前兒童的PK 數據
6 月齡~5 歲學齡前兒童特應性皮炎患者的PK、安全性、有效性數據來自一項單隨機、多中心、安慰劑對照的Ⅱ / Ⅲ期臨床試驗R668-AD-1539[14]。臨床試驗R668-AD-1539 A 部分是一項開放標簽、多中心、Ⅱ期序貫、兩年齡隊列、雙劑量水平的研究。首先入組的是年齡較大的患者(2~5 歲),其次是年齡較小的患者(6 月齡~1 歲)。每個隊列中有10 名患者的亞組接受較低體重劑量(3mg/kg)治療,然后另一個亞組接受較高劑量(6mg/kg)治療。在單次SC 度普利尤單抗后的4 周內,給藥后第1、 3、8、18 以及29 天進行PK 采樣,同時進行安全性監測和療效評估。預計6 月齡~5 歲學齡前兒童6mg/kg 給藥劑量與成人患者單次給藥度普利尤單抗 300mg的藥物暴露相當。Part A 在2017 年12 月20 日~2019 年7 月22 日期間進行,共入組了40 例患者(20 例/ 年齡隊列,10 例/ 劑量水平)。
臨床試驗R668-AD-1539B 部分:主要目的是證明在16周的治療中,6 月齡~5 歲患有中到重度特應性皮炎的學齡前兒童受試者中,同時使用局部外用TCS 時,多劑量度普利尤單抗的療效。162 名患者隨機分配接受度普利尤單抗(n=83)或安慰劑(n=79)加局部外用TCS。患者被隨機(1 ∶ 1)分配到皮下安慰劑或度普利尤單抗組(給藥劑量:體重5~15kg :200mg ;體重15~30kg :300mg)4w, 加低效外用TCS(1% 醋酸氫化可的松乳膏),共給藥16 周。同時臨床試驗R668-AD-1539 B 部分需持續收集PK 樣本:在基線和第4、8、12 和16 周采集血樣檢測度普利尤單抗血藥濃度。
臨床試驗R668-AD-1539A 部分研究結果顯示,在每個年齡隊列中,單次SC 度普利尤單抗后的PK 暴露以大于給藥劑量比例增加的方式。在每個年齡隊列中,較高的6mg/kg 度普利尤單抗給藥劑量比較低的3mg/kg給藥劑量血清中濃度高,持續時間長。在各個劑量水平下,年齡隊列之間的血清中度普利尤單抗的最大濃度相似,并且大部分患者在SC 度普利尤單抗后2 天觀察到最大濃度。
臨床試驗R668-AD-1539B 部分結果顯示,體重5~15kg接受度普利尤單抗 200mg q4w給藥和體重15~30kg 接受度普利尤單抗 300mg q4w 給藥的受試者中,度普利尤單抗隨時間變化的平均濃度表現出相似的特征。300mg q4w 給藥方案度普利尤單抗的全身濃度約在第12 周達到穩定狀態,而200mg q4w 給藥方案的最高平均濃度在第16 周觀察到。在6 月齡~5 歲患有特應性皮炎的學齡兒童受試者中,給藥300mg q4w ( 體重15~30kg)或200mg q4w ( 體重5~15kg)后,度普利尤單抗穩態濃度的x¯±s分別為(110±42.8)mg/L 和(109±50.8)mg/L。
合并既往度普利尤單抗開展的22 項臨床研究(包括健康人和特應性皮炎患者,成人和兒科人群)的全部暴露數據進行群體PK 建模和分析。結果顯示,在所有研究人群中,體重是最終綜合群體藥動學(PopPK) 模型中線性清除率和中央分布體積的重要協變量。雖然年齡不是影響6 歲以上患者PK 的因素,但6月齡~5 歲學齡前兒童受試者經歷一個影響度普利尤單抗清除的成熟過程。因此,在該兒童亞組中,度普利尤單抗清除率受到年齡和體重的影響,清除率隨著年齡的增長而增長,估計在大約6歲時達到最終成熟。值得注意的是,PopPK 分析中納入小于2歲學齡前兒童受試者數量有限,預測2 歲以下學齡前兒童受試者暴露的能力可能會受到限制,因為該亞年齡組的成熟過程以及評估的受試者數量有限。
4.2 基于暴露匹配的兒科外推
6 月齡~5 歲的學齡前兒童在體重5~15kg 的受試者中使用度普利尤單抗 200mg q4w 給藥劑量, 在體重15~30kg 的受試者中使用300mg q4w 給藥劑量后,其平均度普利尤單抗Ctrough高于已批準方案的成人和12~18 歲青少年,但6 月齡~5 歲的學齡前兒童受試者的總體度普利尤單抗Ctrough 與已批準方案的6~11 歲兒童的總體度普利尤單抗Ctrough大致相似。同時,6 月齡~5 歲學齡前兒童受試者的平均度普利尤單抗Ctrough 低于先前研究的成人300mg qw 的給藥方案,如圖4所示。

鑒于PopPK 分析表明, 在考慮體重差異后,6 月齡~5 歲學齡前兒童受試者中, 年齡的增加與清除率的增加有關, 因此,進一步分析了年齡較小亞組(即2 歲以下)的度普利尤單抗Ctrough,并與2~5 歲學齡前兒童特應性皮炎患者的Ctrough 進行了比較。結果顯示,在第16 周時,2 歲以下受試者的平均度普利尤單抗Ctrough 高于2~5 歲受試者的200mg q4w 給藥劑量的度普利尤單抗Ctrough,但兩個年齡亞組的度普利尤單抗平均Ctrough 均低于成人300mg qw 給藥劑量的平均Ctrough。
4.3 暴露- 效應關系
暴露- 有效性的關系:暴露指標為第16 周度普利尤單抗Ctrough,有效性指標為在第16 周達到IGA 評分0、1 和EASI-75。結果顯示,隨著血清中度普利尤單抗Ctrough的增加, 有效性增加。暴露- 安全性的關系:未發現度普利尤單抗第16 周時Ctrough 與結膜炎發生率之間的關系。
4.4 給藥劑量方案合理性評估
6 月齡~5 歲學齡前兒童人群的上市獲批劑量為體重5~15kg :200mg,然后200mg q4w SC ;15~30kg :300mg,然后300mgq4w SC。Ⅲ期臨床試驗R668-AD-1539 的有效性和安全性支持給藥劑量方案是合理的,PK 和E-R 分析結果進一步支持了給藥劑量合理性,分析結果為:①兩個主要臨床試驗終點的統計分析表明,與接受安慰劑的患者相比,接受度普利尤單抗治療的患者在第16 周達到IGA 0、1 的受試者比例和在第16 周達到EASI-75 的受試者比例均較高。②Ⅲ期臨床試驗R668-AD-1539 B部分主要療效終點的暴露- 反應結果表明,隨著血清度普利尤單抗Ctrough的增加, 有效性增加。③根據Ⅲ期臨床試驗R668-AD-1539 B 部分數據,在第16周時未觀察到廣義或狹義結膜炎的E-R 關系。④先前臨床試驗中成人給藥劑量為300mg qw,其安全性數據為6 月齡~5 歲學齡前兒童人群提供了支持性的安全性數據。
5、我國兒科特應性皮炎適應癥臨床研究概況
《中國新藥注冊臨床試驗進展年度報告(2023 年)》[15] 顯示“2023 年僅在兒童人群中開展的臨床試驗數量和在新藥臨床試驗中的占比均增長,且Ⅲ期臨床試驗占比最高”。“在 104 項兒科試驗中,Ⅲ期臨床試驗占比最高,達 34.6%(36 vs 104);在36 項Ⅲ期臨床試驗中,位于前兩位的適應癥分別為預防性疫苗和皮膚及五官科藥物”。因此,為了進一步全面了解我國兒科特應性皮炎適應癥臨床試驗的開展情況,筆者通過藥物臨床試驗登記與信息公示平臺檢索關鍵詞“特應性皮炎”,截至2024 年6 月19 日,共檢索201 條相關臨床試驗,排除“生物等效性研究”、僅成人受試者的研究、局部用藥、中藥以及細胞治療等條件,共得到22 項臨床試驗涉及兒科人群。其中Ⅲ期臨床試驗共13 項,上市后/ 真實世界研究共4 項,5 項Ⅰ / Ⅱ期臨床試驗。
登記的13 項Ⅲ期臨床試驗中,9 項研究同時納入青少年和成人患者;4 項Ⅲ臨床試驗僅納入12 歲以上的青少年。4 項上市后/ 真實世界研究中,2 項研究僅納入6~18 歲(不含18 歲)兒科患者,另2 項研究同時納入12 歲以上青少年和成人患者。
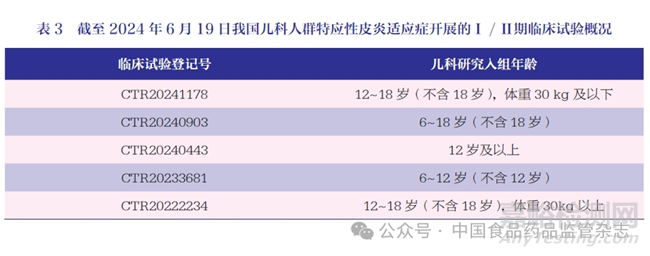
5 項Ⅰ / Ⅱ期臨床試驗均僅納入兒科人群,具體入組人群特征,見表3,僅1 項研究試驗狀態顯示已完成,其他4 項研究正在進行中。
4 項上市后/ 真實世界研究的藥物為烏帕替尼緩釋片和度普利尤單抗注射液,其中2 項研究僅納入6~18 歲(不含18 歲)患者,均為在境外已完成較充分的兒科臨床研究,在我國繼續收集我國兒科人群的安全性數據。
此外,目前提交至監管機構的溝通交流問題,在臨床藥理學方面多與PK 采樣點設置、PK樣本量以及兒科人群給藥劑量有關。表明我國研發機構已經切實考慮兒科人群特應性皮炎臨床研究的試驗設計,前瞻性的收集相應數據。
綜上,根據我國相關企業登記的兒科人群臨床研究顯示,我國創新藥臨床研究入組人群最低年齡6 歲,體重30kg 以上均處于Ⅰ / Ⅱ期臨床試驗階段,6~12歲(不含12 歲)兒科人群尚未進入Ⅲ期臨床試驗階段。同時與度普利尤單抗臨床試驗兒科人群相比,尚未開展6 歲以下的更小年齡段人群的臨床研究,表明未來我國對整體兒科特應性皮炎的研發還有待進一步深入。同時,兒科人群的PK 采樣點設置較稀疏,樣本量較小可能對后續表征兒科人群PK 特征以及后續進行暴露-效應分析有一定的局限性。
6、總 結
本文通過以度普利尤單抗注射液兒科人群特應性皮炎適應癥的研發過程為例,全面梳理了該產品的整體研發策略以及不同年齡階段的臨床試驗開展和給藥劑量選擇。通常情況下,成人用藥數據外推至兒科人群,將不同年齡段兒科人群的暴露量,與成人暴露量進行匹配,進而對兒科人群的暴露- 效應關系進行分析,獲得兒科人群給藥劑量,再利用成人數據外推支持兒科人群的安全有效性[16]。度普利尤單抗兒科人群與成人暴露量匹配原則是兒科人群中度普利尤單抗劑量選擇重要依據,但由于度普利尤單抗是首個在兒科特應性皮炎患者中具有新的作用機制的全身治療藥物,研發之初兒科人群的暴露-效應關系數據有限,因此與完全外推的情況不同,在利用成人數據外推兒科人群安全有效性時,仍需考慮兒科人群的暴露- 效應關系。
在度普利尤單抗兒科特應性皮炎適應癥臨床試驗研發過程中,一般遵循在兒科人群研發早期階段首先獲得相應年齡人群的PK特征,研究結果用于預測Ⅲ期臨床試驗的兒科人群暴露,通過暴露量匹配,在Ⅲ期臨床試驗中設置了2 個劑量組并在Ⅲ期臨床試驗中同時收集兒科PK 數據,以充分支持不同年齡段人群中的暴露- 效應關系,進而支持給藥劑量選擇。此外,隨著數據的不斷豐富,模型也不斷更新,表明模型具有“學習- 確認”循環過程。文獻以及FDA 審評報告顯示,描述度普利尤單抗注射液6 月齡以上兒科人群PK 特征并支持暴露量比較的最終群體PK 模型納入了度普利尤單抗特應性皮炎適應癥研發的全部PK 數據。同時,還需注意到,度普利尤單抗相應兒科人群暴露- 效應分析是充分的。筆者認為有幾點值得我國研發人員參考,包括:①制定科學合理的研發策略。對于兒科特應性皮炎適應癥,可充分考慮成人安全有效性的數據后再開展兒科人群的臨床研究,采用年齡從大到小、分階段交錯、逐步遞進的方式開展多個兒科臨床研究。②充分評價兒科人群的安全有效性,兒科人群的數據充分性是關鍵。數據包括但不限于不同年齡段和體重范圍的兒科人群的暴露范圍,這種設計可以保證劑量組設計較為合理,且樣本量足夠,同時PK樣本采樣點設置科學合理,為后續群體PK 模型的建立和暴露-效應分析提供了較充分的數據支持。③進行暴露- 效應分析時,暴露指標選擇應進行論證并具有合理性,有效性指標可為臨床試驗終點指標等,此外還需分析兒科人群中特別關注的不良事件。
度普利尤單抗注射液兒科特應性皮炎適應癥的高效成功研發,離不開制定了科學合理的總體研發策略,執行過程中充分的數據收集,持續的數據分析并采用模型引導的研發理念。相關經驗值得我國研發機構借鑒,以加速我國兒科人群藥物研發,早日惠及我國兒科患者。

來源:中國食品藥品監管雜志


