您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-09-09 17:47
近期,東南大學白晶副教授和新加坡國立大學李俊教授在科愛創辦的期刊Bioactive Materials上聯合發表綜述文章:“結構-功能”一體化的可降解Mg/聚合物復合材料:設計、制造、性能及生物醫學應用的最新進展。該文詳細總結了高強韌可降解的Mg/聚合物復合材料的設計思路,加工策略,構效關系,降解速率的影響因素和生物學功能及其機制,并針對可降解材料提出了實時且全面的評價方法;同時,展望了Mg/聚合物復合材料在將來臨床轉化方向面臨的機遇與挑戰。
一、可降解Mg/聚合物研究趨勢及熱點方向
隨著科技的進步和生活水平的提升,傳統的生物惰性金屬材料往往存在組織修復速率慢、需要二次手術取出等棘手問題,無法滿足人們的對先進醫療技術的需求。與之不同的是,生物可降解金屬具有生物活性,降解產物有利于加速局部組織的愈合過程,且代謝終產物可以被排出體外,這緩和了患者與落后的醫療水平的矛盾。目前,可降解金屬材料主要為Mg、Zn、Fe及其合金。可生物降解金屬被認為是革命性的醫用材料,因為它們具有如下兩個顯著的優勢:(i)它們無需二次手術移除,減輕了患者的多重負擔。(ii)它們的綜合力學性能比聚合物、陶瓷和生物玻璃等其他可降解材料更優越,也比其他不可降解金屬更接近天然骨,從而減少了應力屏蔽效應的產生。在這三種可降解金屬中,Mg金屬的力學性能相對較弱但是具有最接近天然皮質骨模量的性質。通過合金化或變形加工等方式可以獲得楊氏模量在37.5?65.0GPa、極限抗拉強度在190?250MPa的Mg合金(圖1(A))。
除了可降解金屬材料外,可降解聚合物材料因其原材料來源廣泛,加工性強也被廣泛應用于醫療領域。可生物降解聚合物的定義是“需要微生物酶水解或氧化降解的聚合物”。與可降解金屬材料不同的是,一方面其降解產物常會導致局部酸性環境,刺激周圍組織。另一方面,其力學性能相對較差,遠遠不能達到部分對力學性能需求較強的組織(如骨組織)修復的需求。因此,有必要對其進行改進處理。
為了克服各自的缺點,復合材料的概念應運而生,使可降解金屬和聚合物材料各自揚長避短,實現了可降解復合材料功能的最大化(圖1(B))。正因為可降解復合材料因其結合了復合材料中金屬和聚合物雙組元的優勢,故其吸引了世界范圍內許多研究人員的關注。如圖1(C)所示,據Web of Science數據庫的記錄顯示,近10年來,與可降解Mg/聚合物復合材料相關的出版物數量在整體呈現逐年攀升之勢。因此,可降解Mg/聚合物復合材料相關的研究話題是較新的。從圖1(D)中關于Mg/聚合物復合材料領域的研究熱點方向的網絡可視化圖中來看,大多數研究方向圍繞復合材料的界面結合、力學性能、腐蝕、降解、離子釋放、生物相容性及組織工程應用展開,這也說明了這些研究方向在未來較長一段時間內可能仍是可降解Mg/聚合物復合材料研究的熱點趨勢。

圖1:(A) 生物可降解金屬和聚合物與天然松質骨和皮質骨的力學性能比較;(B) 可生物降解金屬/聚合物復合材料的設計理念;(C) 2013年以來Web of Science數據庫中檢索到的關于生物可降解金屬/聚合物復合材料的年出版物數目;(D) 復合材料領域研究熱點詞匯的網絡可視化圖
雖然目前可降解Mg/聚合物復合材料在組織工程中的應用越來越廣泛,然而,在該領域所開展的大多數工作中,材料復合策略及用于組織工程時材料性能評價體系尚不完善,導致可降解材料在植入后與細胞/組織的相互作用及其機制尚無系統分析。因此,重新建立對可降解Mg/聚合物復合材料從加工到生物學應用各個階段性能影響要素的全面認識十分必要。
在這項工作中,基于研究團隊關于復合材料設計的堅實基礎,首先介紹了具有代表性的可降解Mg/復合材料增強方式及加工成型手段,并闡述了復合材料強韌化的機制。隨后,討論了影響復合材料降解速率的內/外源性因素及力學性能衰減規律,并揭示了復合材料各組元在降解時的相互作用過程。特別地,考慮到目前多數體外搭建的降解平臺和細胞培養條件,其在評價可降解材料降解速率和生物學性能時表現出與體內實驗結果的較大差異性,本文還介紹了一種能夠較好模擬體內生理環境因素的體外降解實時研究平臺。緊接著,本文綜述了可降解Mg/聚合物復合材料在修復組織(包括骨、軟骨、血管、神經或其他軟組織等)或攻克細菌、腫瘤/癌癥時的潛在分子機制。最后,本文還在這些可降解復合材料已有生物學活性的基礎上,討論了復合材料利用其環境響應性進一步增強組織修復能力的智能平臺及其作用機制。
二、高強韌復合材料的加工工藝和強化機制
從復合材料組成之一的增強相角度考慮,不同于其他無機材料具有加工或合成便捷的特點,具有密排六方結構特征的Mg金屬滑移系較少,難以獲得高品質、微尺度的增強相材料。此外,Mg金屬的化學性質極為活潑,極難通過“自上而下”的方法獲得高精密的微納米增強相。目前研究團隊攻克了Mg金屬微型材加工瓶頸,獲得的Mg增強相形態主要包括顆粒態、纖維態、編織態、棒狀、板狀、混合形態等(圖2)。
從復合材料組成之一的基體相角度考慮,盡管提高聚合物的相對分子質量可以使得復合材料的力學性能得到顯著提高,但聚合物的分子量與其綜合成本成正相關關系;因此,依賴分子量的提高獲得高強度的復合材料顯然是不經濟的。為了克服這一難題,在金屬-聚合物材料復合的基礎上,利用物理方法進一步對其進行加工以獲得高強韌的復合材料無疑是一種更為便捷和經濟的方法。秉承這一理念,研究團隊借鑒了金屬劇烈塑性變形的加工理念,針對復合材料二次開發出了極具特色的注塑成型法、等通道轉角擠壓法、熱壓法、熱拉拔法、拉伸法、軋制法和增材制造法等,實現了可降解Mg/聚合物復合材料的強韌化制備(圖2)。
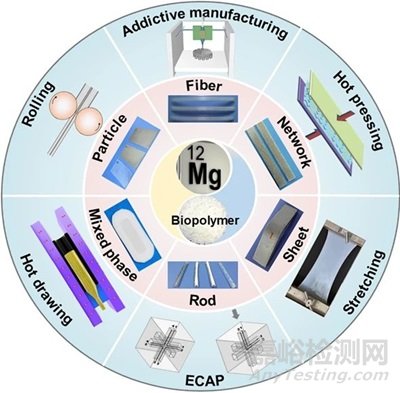
圖2:團隊開發的高強韌可吸收復合材料及其加工方法
盡管通過Mg金屬對聚合物基體的強化作用可以提升復合材料的力學性能,但是應用于力學性能要求較高的場景時(例如骨固定器械),由于可降解金屬未經過表面處理,降解時聚合物基體的酸性水解產物可能會加速金屬的腐蝕,造成復合材料力學性能的快速衰減。因此,有必要對復合材料表界面進行修飾(圖3),達到在提高力學性能的同時延緩其衰減速率的目的。

圖3:可降解Mg/聚合物復合材料界面修飾策略:(A) 拉伸實驗后不同表面改性Mg纖維的表面光學顯微鏡形貌和SEM形貌;(B) 分子動力學模擬前后的鍵長、鍵角以及PLA層到修飾表面的距離變化;(C) 動態模擬5萬步后PLA結構和Mg、MgO、MgF2表面的半徑旋轉(Rg)變化;(D) PLA分子鏈徑向分布函數與Mg、MgO和MgF2表面徑向距離的關系;(E) 剪切試驗后不同表面改性(未經處理、MAO、MgF2)處理后及Mg與PLA復合前后的表面形貌SEM圖像;(F) MAO處理后Mg纖維與PLA基體界面結合機理;(G) PEI和CTAB修飾后Mg顆粒懸浮液Zeta電位的變化以及PEI和CTAB在Mg顆粒表面的吸附示意圖;(H) pH為9和pH為11時懸浮液中Mg顆粒的表面和截面圖像;(I) MgPEI/PLA薄膜(左)和Mg添加量為10 wt.%的支架(右)的表面和截面形貌
三、復合材料降解速率影響因素及降解機制
降解性能是可降解復合材料發揮其組織修復作用所必須考慮的因素之一。以骨組織修復為例,降解過程所導致的力學衰減和活性金屬離子的釋放及遞送過程都將影響骨組織的愈合。如何合理構建“力-化學”耦合降解服役環境,正確評價復合材料降解失效和生物力學衰減過程一直是多年來研究人員們追求重點解決的核心問題。
影響復合材料的降解速率因素頗多,根據這些因素的來源,可以分為內源性成分(圖4)和外源性環境因素(圖5)兩種。其在降解過程中內部組元的交互作用機理如下所示:

圖4:影響復合材料降解速率的內源因素及降解過程中復合組元的相互作用:(A) 不規則片狀和球形Mg顆粒的SEM圖像;(B) PLDA/Mg?IRR和PLDA/Mg?SPH柱狀物在PBS溶液中浸泡7天和28天后的照片;(C) 氫氣累計釋放量與浸泡時間的關系;(D) 浸泡7天和28天后干燥樣品質量變化百分比;(E) X ray?CT法檢測熱壓和熱拉拔態Mg/PLA復合棒在不同降解時間點的降解差異示意圖;不同環境下PLA的降解機理及Mg與PLA的相互作用:(F)在中性介質中的水解機制;(G) 在H+催化PLA水解機制;(H) 在OH?催化PLA水解機制;(I) Mg/PLA中雙組元協同降解效果示意圖;(J) PLGA微纖維和Mg/PLGA微纖維中的PLGA凝膠滲透色譜曲線;(K) lnMn隨降解時間的擬合曲線

圖5:影響復合材料降解速率的外源因素及基于微流控和器官芯片技術的新型降解平臺示意圖:(A) 胃腸環境圖;(B) 鎂絲浸沒在不同介質中的Nyquist圖;(C) 鎂絲樣品在不同降解介質中浸泡24h后的SEM圖像;(D) 純PLA和Mg/PLA試樣的降解行為與壓應力、溫度和時間的關系;(E) 25℃或37℃下不同Mg樣品在HBSS浸泡1h后局部pH值的分布圖;(F) 耦合多因素的Mg/聚合物降解試驗綜合裝置示意圖;(G) 模塊化、多組織平臺組件、組裝和集成多器官芯片用于新型降解平臺的示意圖;(H) 進口流量為10µL/min時,Mg絲上的流動剪切應力和微流控通道內的流速分布云圖;(I) 用于動態降解觀察的微流控芯片模型;(J) 微流體中不同樣品的表面和截面光學顯微鏡圖像;(K) 培養12h后植入不同樣品的芯片中凋亡的內皮細胞(紅色)圖像
四、復合材料的生理功能及分子機制
由可降解Mg/聚合物組成的復合材料在人體多個部位具有廣闊的應用前景。它們在腦、骨科、肌腱、牙科、皮膚、心血管、神經、泌尿、胃腸、消化道等生理部位有著廣泛的應用,這是因為這些生理部位同時需要“結構支撐”和“生理修復”的功能。復合材料中Mg釋放的活性Mg2+離子是其細胞/組織活性的主要來源。此外,介質中pH值的變化也會顯著影響細胞/組織的活力。例如,pH值高于8.5或低于6.0會顯著影響多種細胞的活性。圖6總結了以Mg金屬為增強相的復合材料的應用領域、適宜的微環境培養基條件、通過誘導間充質干細胞分化實現組織修復過程中涉及的關鍵基因、蛋白和信號通路。

圖6:可降解Mg/聚合物復合材料的潛在應用場景和影響間充質干細胞分化和多組織再生過程的重要信號通路示意圖
五、基于復合材料的環境響應性平臺
一般認為,可降解Mg/聚合物復合材料的生理功能依賴于其內部金Mg降解所釋放的活性產物。實際上,除此之外,復合材料平臺本身也可以被合理設計使其具有環境響應功能,以強化復合材料的生物學性能。復合材料在降解過程中可釋放多種物質誘發自身響應,或在外部(如超聲、光、微波、磁場、應力等)作用下,應激觸發自身發生物理或化學變化,從而按需啟動組織修復功能。可降解復合材料搭配環境響應治療平臺可以最大限度地提高復合材料的治療效果,并減少不必要的副作用。由于這些優點,這類環境響應性治療平臺越來越受到研究者的關注。在此,本節總結了部分具有環境響應性的復合材料的設計和應用場景,如圖7所示。

圖7:刺激響應型復合材料設計及應用場景:(A) 用于軟組織修復的pH響應Mg/PLGA微纖維的設計與應用:(a1)兩種微纖維在PBS中降解后的典型微觀結構;(a2) PLGA和Mg/PLGA微纖維降解后介質的pH變化;(a3) Mg/PLGA微纖維中殘留聚合物基體的1H?NMR譜隨時間變化曲線;(a4) PLGA分子鏈在中性和堿性降解介質中的斷裂機理;(B) 3D打印NIR響應性SMPU/Mg支架的設計與應用;(b1) 3D打印SMPU/Mg支架形態;(b2) 808nm激光照射下SMPU/Mg支架在空氣中的形狀恢復過程圖像;(b3) 植入體內后,壓縮后的支架在NIR刺激下恢復,并在支架與組織界面處發揮支撐作用;(C) 由Mg和PLGA、PVA、PCL、PHB/V等聚合物組成的可生物降解TENG (BD?TENG)的設計與應用:(c1) BD?TENG結構原理圖;(c2) 不同摩擦聚合物層的BD?TENG的電輸出性能;(c3) 有/無電場刺激下,在電極上培養的神經細胞的取向和分布情況;(c4) SD大鼠背部皮下植入的BD?TENG在術后即刻和9周后的圖像;(D) 磁響應器件的設計與應用:(d1) 磁響應系統的組成部分包括無線接收器、電感、射頻二極管、Mg/SiO2/Mg電容器和通過濺射沉積Mg互連的PLGA襯底(左);(d2) 在無線磁場下通過發射線圈激活的電刺激作用;(d3) 刺激器的射頻特性;(d4) 輸出波形示例:刺激器施加到傳輸線圈產生的交流電流譜圖;(d5?d6) 神經套與坐骨神經金屬電極界面處的H&E染色切片和甲苯胺藍染色切片圖像
六、總結與展望
目前,盡管Mg/聚合物復合材料在實驗室規模上顯示良好的治療效果,但針對臨床應用的復合材料的開發和評估仍然面臨嚴峻的挑戰。未來的研究可包括但不限于以下方向:
(1) 盡管有機表面改性劑增強了復合材料的界面結合和力學性能,但也引入了潛在的安全隱患。未來的發展應更多地關注安全且高效的表面改性策略。
(2) 在降解早期,復合材料可以通過界面修飾和處理有效控制降解速率。然而,后期的風險,如過早脫離、解體或降解碎片進入體液或腔內,可引起繼發性損傷或腔內阻塞。因此,在今后的臨床前研究中,有必要進一步跟蹤材料在全降解階段的變化。
(3) 生理環境是一個復雜的多因子耦合系統。為了準確預測可降解材料在這種環境下的真實降解性能,建立基于“微流控芯片”和“器官芯片”的多場耦合體外降解平臺,對于全面實時評價可降解材料的功效具有重要意義。
(4) 復合材料介導的組織再生過程是復雜的,涉及止血、炎癥(免疫反應)、增殖、重塑以及與周圍組織的相互作用。然而,目前在這方面的研究仍然十分有限,需要進一步深入研究。
(5) “刺激-響應”性賦予復合材料超越自身材料本質的強大功能。然而,這是以對周圍正常組織產生不利的或潛在的不可逆影響為代價的。因此,開發多功能復合材料和溫且有效的智能治療平臺至關重要。
原文信息
Xianli Wang, Chen Wang, Chenglin Chu, Feng Xue, Jun Li*, Jing Bai*. Structure-Function Integrated Biodegradable Mg/Polymer Composites: Design, Manufacturing, Properties, and Biomedical Applications. Bioactive Materials, 39 (2024) 74-105.
DOI: 10.1016/j.bioactmat.2024.05.024

來源:Internet


