您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-08-29 08:38
了解藥品研發中的質量源于設計(QBD)理念,首先需要了解幾個概念:目標質量概況(QTTP),關鍵質量屬性(CQAs),過程控制(PAT),試驗設計(DOE)。這幾個因素相互關聯,環環相扣于整個藥品研發中。
由最初的質量源于檢測,到質量源于控制,再到質量源于設計,體現了藥品研發對各方向把握及對產品質量的了解的深入。
質量源于設計,體現在整個研發系統中,從原輔料的質量及關鍵性質控制到工藝輸入物料性質及工藝參數的控制及放大生產。與傳統單一定點研發思路相比,QbD調控的空間較大,產品質量發生偏差時,能及時知道原因并修正,通過小試篩選的工藝范圍,能有效為放大提供依據。
QBD在藥物中研發思路如下:
一、 研發初始立項調研影響QTTP要素分析
了解產品的QTTP,其中除了傳統的制劑一般質量屬性外,還應該特別關注其給藥劑量及方式與藥代動力學方面的文獻資料數據。充分了解哪些性質可能影響藥物吸收,該藥物吸收情況如何。吸收部位是胃,還是腸道,作用是局部還是全身。這些因素可能都會影響BE試驗結果。
與此相關,除了藥物本身藥代動力學性質外,還應該調研影響藥物吸收的輔料可能的作用方式,這里不僅限于調查輔料本身對吸收是否有影響,還應該注意輔料中某些殘留物或分解物可能對吸收造成影響,在此應列入QBD考察的輔料CQAs范圍,特別是一些用量大的輔料,應該尤為注意。
以某軟膠囊仿制藥開發為例,藥物開發中QTTP要素分析如下:
表1 QTTP要素分析
| QTTP要素 | 目標 | 依據 |
| 劑型 | 軟膠囊 | 藥學等效性要求:相同劑型;XX藥品在水中溶解度低,在油相中溶解度高。且單劑量給藥小,制備成固體制劑難分散均勻 |
| 給藥途徑 | 口服 | 藥學等效性要求:相同的給藥途徑;XX胃腸吸收,迅速起效;加上單劑量小等原因,選擇口服給藥比較合適。 |
| 劑量 | 1mg | 藥學等效性要求:相同劑量 |
| 藥代動力學 | 在進食情況下,PK參數(AUC0-t,Tmax,Cmax)90%置信區間應該落在生物等效性限度之內 | 生物等效性要求 |
| 穩定性 | 室溫下儲存36個月 | 等于或優于參照藥品儲存期 |
| 藥品質量屬性 | 物理性質 | 藥學等效性要求:符合相同藥典標準或其他適用的(質量)標準(鑒別、含量、純度及質量) |
| 鑒別 | ||
| 含量 | ||
| 降解物 | ||
| 殘留溶劑 | ||
| 藥物釋放(溶出) | ||
| 微生物限度 | ||
| 水分 | ||
| 包裝系統 | 適宜包裝系統以實現既定的貯存期并確保運輸期間膠囊的完整性 | 容器材質:高密度聚乙烯瓶裝 |
| 給藥途徑與說明書一致 | 進食后服藥,飯前服藥影響未知,原研廠家只做飯后服用藥物臨床 | 參照說明書已經提供給的信息 |
| 可替代的給藥方法 | 無 | 參比藥品在說明書中沒有列出 |
依據QTTP要素分析找出影響QTTP的產品關鍵質量屬性CQAs,如含量,含量均一度,溶出,有關物質等。以此為考察目標,接下來對處方篩選及工藝開發進行風險評估。
二、 處方開發中的風險評估
(1)、原輔料初始風險評估
結合實際情況,原輔料準備涉及的風險評估因素如下:
第一、原輔料本身的理化性質,除了一般特性外,這里應該了解API化合物的結構特征,是否有些官能團對酸堿,氧或光照不穩定,或者能與輔料發生化學反應,還可能與輔料中某些殘留物發生化學反應。這些因素在原輔料準備過程中應該注意的。涉及到不同廠家來源的輔料,即使滿足的質量標準一樣,但由于制備工藝不一樣,一些物理性質,如比表面積,微觀表征,這些特性可能影響藥物的釋放與工藝順利度。
第二、有些涉及到關聯審評的輔料,在此應該列入初始風險評估,主要考慮到廠家有無關聯審評意向及廠家供貨穩定性。
(2)、處方篩選中的QbD概括
初始風險評估確定CQAs及因變量→通過DOE試驗或者單因素試驗考察→結果分析,確定范圍及最佳處方參數→風險評估更新(通過試驗降低該項風險的說明)
三、工藝篩選中的QbD概括
工藝中初始風險評估包括兩大項:輸入物料屬性及工藝參數(包括設備型號評估),確定影響產品質量的CQAs→DOE試驗或單因素試驗→結果分析,確定范圍及最佳處方參數→風險評估更新(通過試驗降低該項風險的說明)。這里需要注意的是,初始風險評估并不一定完全涵蓋各過程的CQAs,當試驗過程中出現影響產品CQAs的關鍵參數時,因及時列入風險評估范疇,并展開系統試驗。
在此以干法制粒工藝為例
干法制粒步驟影響片劑含量均勻度和溶出度的風險被確定為高風險,整粒步驟影響片劑的含量均一度的風險也被確定為高風險。薄片密度、顆粒粒度分布、和顆粒流動性被確定為干法制粒和整粒步驟得到的中間體CQAs。工藝風險評估前都應該對輸入物料進行風險評估。
在干法制粒工序中,不同干法制粒機型號及廠家有區別。主要分為橫向螺桿下料及縱向螺桿下料。在此僅對橫向螺桿下料干法制粒工藝風險評估進行說明。

圖a 縱向螺桿下料(圖片來源:百度圖庫)
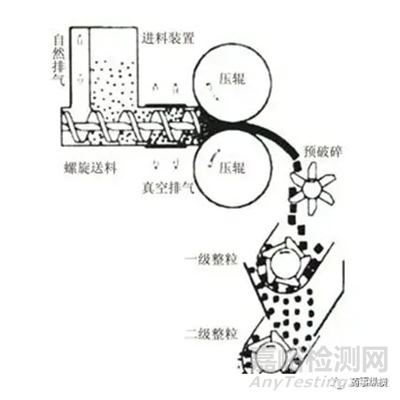
圖b 橫向螺桿下料(圖片來源:百度圖庫)
(1)首先對干法制粒輸入物料及工序進行風險評估,確定高風險影響因素:
表2 干法制粒和整粒工藝變量初始風險評估
| 工藝步驟:干法制粒和整粒 | |||
| 輸出物料CQAs:薄片密度、顆粒粒度分布、顆粒流動性、含量均一度 | |||
| 變量 | 輸出物料CQAs | 風險評估 | 合理性說明和初始策略 |
| 輸入物料屬性 | |||
| 粉體學性質(如流動性,可壓性,堆密度) | 薄片密度 | 中 | 物料可壓性決定了是否可壓成薄片,從而影響整粒及顆粒粒度分布,但薄片密度可控范圍廣,對成品質量影響小,風險中 |
| 顆粒粒度分布 | 低 | 顆粒力度分布主要在于整粒工序,混粉均一度對其影響小,風險低 | |
| 含量均一度 | 高 | 流動性不好,可能會影響含量均一度 | |
| 顆粒流動性 | 低 | 顆粒流動性主要看制備成粒子粒度分布,混粉均一度對其影響小,風險低 | |
| 混粉含量均勻度 | 薄片密度 | 中 | 當原料比例大時,含量不均一可能影響薄片密度,風險中 |
| 顆粒粒度分布 | 低 | 顆粒力度分布主要在于整粒工序,混粉均一度對其影響小,風險低 | |
| 含量均一度 | 高 | 物料含量不均,可能導致干法制備成的粒子含量不均,應該在預混工序中考察,風險高 | |
| 顆粒流動性 | 低 | 顆粒流動性主要看制備成粒子粒度分布,混粉均一度對其影響小,風險低 | |
| 工藝參數 | |||
| 壓輪面設計 | 薄片密度 | 低 | 壓輪面設計上增加摩擦力,增加進料。被視為一個固定因素。風險低。但是不同壓輪面對粘壓輪效果影響不同,如原料較粘的物料用平面輪比網紋合適 |
| 顆粒粒度分布 | 低 | 顆粒力度分布于整粒相關,風險低 | |
| 含量均一度 | 低 | 含量均勻度于輸入物料均勻度及流動性相關,壓輪面對其影響不大。風險低 | |
| 顆粒流動性 | 低 | 顆粒流動性與整粒后力度分布相關,壓輪面對其影響小,風險低 | |
| 壓輪壓力 | 薄片密度 | 高 | 薄片密度與壓輪壓直接相關。風險高 |
| 顆粒粒度分布 | 高 | 薄片密度與壓輪壓相關,進而影響整粒后顆粒均勻度。風險高 | |
| 含量均一度 | 高 | 同上說明 | |
| 顆粒流動性 | 高 | 同上說明 | |
| 壓輪間隙 | 薄片密度 | 高 | 與薄片密度成反比,風險高 |
| 顆粒粒度分布 | 高 | 凡是影響薄片密度,都對其影響 | |
| 含量均一度 | 高 | 凡是影響薄片密度,都對其影響 | |
| 顆粒流動性 | 高 | 凡是影響薄片密度,都對其影響 | |
| 整粒速度 | 薄片密度 | NA | NA |
| 顆粒粒度分布 | 高 | 整粒速度快慢,導致整粒槳對薄片剪切力不一樣,出來的粒子粗細不一樣,影響粒度風險高 | |
| 顆粒均一度 | 高 | 影響粒度分布,進而影響混合均一度 | |
| 顆粒流動性 | 高 | 影響粒度分布,進而影響流動性 | |
| 整粒篩網孔徑 | 薄片密度 | NA | NA |
| 顆粒粒度分布 | 高 | 篩網孔徑粗細,影響顆粒大小,對粒度分布影響風險高 | |
| 含量均一度 | 高 | 影響顆粒粒度分布,從而對其影響 | |
| 顆粒流動性 | 高 | 影響顆粒粒度分布,從而對其影響 | |
(2)對壓輪壓力、壓輪間隙、整粒速度及篩網孔徑等影響成品CQAs的高風險因素進行實驗考察:
從初始風險評估中提取高度風險,進行重點實驗設計評估,確認合適的參數范圍,所用部分析因DOE設計。
表3 研究干法制粒和整粒工藝變量的24-1部分析因DOE
|
因子 |
工藝變量 |
水平 |
||
|
-1 |
0 |
+1 |
||
|
A |
壓輪壓力 |
|||
|
B |
壓輪間隙 |
|||
|
C |
整粒速度 |
|||
|
D |
篩網孔徑 |
|||
|
因變量 |
考察指標 |
目標 |
可接受范圍 |
|
|
Y1 |
薄片密度 |
適中 |
||
|
Y2 |
粒度分布 |
均一 |
不能細分含量太多,有粘沖風險 |
|
|
Y3 |
顆粒含量均一度 |
RSD最小化 |
||
|
Y4 |
顆粒流動性 |
休止角最小 |
休止角<40° |
|
|
Y5 |
中間體可壓性 |
硬度最大化 |
||
|
Y6 |
與參比溶出相似度(F2) |
與參比最相似 |
最終目標是溶出曲線與參比制劑最相似 |
|
備注:此表僅提供實驗設計思路,具體參數不列出。
運用minitab軟件進行分析,實驗結果顯示合理可控制的工藝參數范圍
(3)風險評估更新
表4 干法制粒和整粒工藝變量風險評估更新
|
工藝步驟:干法制粒和整粒 |
|||
|
輸出物料CQA:薄片密度,顆粒粒度分布,含量均勻度和顆粒流動性 |
|||
|
工藝變量 |
輸出物料CQA |
風險評估 |
風險降低合理性說明 |
|
壓輪壓力 |
薄片密度 |
低 |
確定了壓輪壓力可接受范圍,使工藝過程可控及溶出與參比最相似且可控,風險降低 |
|
顆粒粒度分布 |
低 |
||
|
含量勻一度 |
低 |
||
|
顆粒流動性 |
低 |
||
|
壓輪隙 |
薄片密度 |
低 |
確定壓輪間隙范圍,到達CQAs可接受標準,使工藝過程可控及溶出與參比最相似且可控,風險降低 |
|
顆粒粒度分布 |
低 |
||
|
含量均一度 |
低 |
||
|
顆粒流動性 |
低 |
||
|
整粒速度 |
薄片密度 |
低 |
確定整粒速度范圍,使其在范圍內對CQAs無明顯影響,使工藝過程可控及溶出與參比最相似且可控。因此,風險降至低 |
|
顆粒粒度分布 |
低 |
||
|
含量均一度 |
低 |
||
|
顆粒流動性 |
低 |
||
|
整粒篩目孔徑 |
薄片密度 |
低 |
整粒篩目孔徑確定,使得壓輪壓力和壓輪間隙可接受范圍更強,使CQAs達預定標準,使工藝過程可控及溶出與參比最相似且可控,風險降至低 |
|
顆粒粒度分布 |
低 |
||
|
含量均一度 |
低 |
||
|
顆粒流動性 |
低 |
||
風險評估策略:初始風險評估提出高風險因素→這些因素影響的CQAs指標→通過試驗篩選得到合適范圍→風險更新評估降至低級
四、工藝放大中的QbD概括
工藝放大中,應該評估哪些參數可能影響工藝放大后產品CQAs,如篩網孔徑,過篩轉速,粉碎整粒機型號,混合料斗裝量體積,轉速/數等。能否等比放大,或者按照一定運算公式放大。
五、總結
QbB就是在研發階段,試驗開始前,充分評估各參數對產品CQAs的影響,然后再通過試驗確認合理的范圍以降低其風險的過程。
【參考文獻】
《QBD與藥品研發概念與實例》一書

來源:Internet


