您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2024-06-24 17:39
導(dǎo)讀
“魔法子彈”抗體偶聯(lián)藥物(Antibody-drug conjugate, ADC)無疑是近幾年新藥研發(fā)領(lǐng)域的熱點(diǎn),根據(jù)Evaluate Pharma和BCG的預(yù)測,到2024年,全球ADC市場預(yù)計(jì)將達(dá)到129億美元,到2026年有望超過160億美元[1]。隨著ADC藥物的大放異彩,一股“萬物皆可偶聯(lián)的浪潮”席卷而來,研究人員試圖通過借鑒ADC的設(shè)計(jì)原理,將同樣備受矚目的新分子—蛋白降解靶向嵌合體(Proteolysis Targeting Chimera, 簡稱PROTAC)與單抗進(jìn)行連接,以提高PROTAC的體內(nèi)遞送效率,從而產(chǎn)生一種新的分子模式——抗體偶聯(lián)降解劑(Degrader-antibody conjugates, DAC)。
DAC藥物的作用機(jī)制和臨床進(jìn)展
靶向蛋白質(zhì)降解(Targeted Protein Degradation,TPD)主要是通過降解目標(biāo)蛋白來實(shí)現(xiàn)疾病的治療。其中近年來發(fā)展最迅速的兩種TPD技術(shù)分別是蛋白降解靶向嵌合體(Proteolysis Targeting Chimeras, PROTACs)和分子膠(Molecular Glues),兩種技術(shù)通過不同的作用機(jī)制降解目標(biāo)蛋白。
PROTAC主要是由靶蛋白配體(Target Protein Ligand)、E3蛋白連接酶配體(E3 Ligase Ligand)和連接子(Linker)3個(gè)部分組成,其作用機(jī)制是,一端靶向配體與目標(biāo)蛋白結(jié)合,另一端E3連接酶配體與細(xì)胞內(nèi)的E3泛素連接酶結(jié)合,形成復(fù)合物,從而使目標(biāo)蛋白被泛素化和蛋白酶體識(shí)別,最終被特異性降解[2](圖1)。與傳統(tǒng)藥物相比,PROTAC是事件驅(qū)動(dòng),而非占位驅(qū)動(dòng),能夠針對(duì)不可成藥靶點(diǎn),用量小,且細(xì)胞內(nèi)可再循環(huán),可以克服靶蛋白突變/過表達(dá)引起的耐藥。然而,PROTAC并非完美,PROTAC的分子較大,因此會(huì)造成細(xì)胞透膜性及生物利用度的挑戰(zhàn),同時(shí)可能會(huì)發(fā)生脫靶毒性和體內(nèi)代謝不穩(wěn)定的問題。

圖1. PROTACs的作用機(jī)制[2]
那么,能否參考ADC的設(shè)計(jì)原理,將抗體引入到PROTAC中,既保持PROTAC的優(yōu)勢,又同時(shí)改善PROTAC的問題?這就是DAC設(shè)計(jì)的初衷。DAC的作用機(jī)制與ADC相似,同樣利用抗體靶向特定的細(xì)胞表面抗原,抗原-抗體結(jié)合后,抗體介導(dǎo)內(nèi)吞至溶酶體中,增加PROTAC的生物利用度,在溶酶體中,DAC被降解后,釋放PROTAC,從而發(fā)揮作用[3](圖2)。

圖2. DAC的作用機(jī)制[3]
相較于ADC藥物,DAC藥物還處于未經(jīng)充分驗(yàn)證的初步開發(fā)階段,近年來才進(jìn)入到人們的視野中。目前DAC藥物在臨床研究及合作的進(jìn)展相對(duì)較少,Orum Therapeutics、百時(shí)美施貴寶(BMS)、C4 Therapeutics、默沙東(MSD)、Nurix和Seagen正在針對(duì)HER2、CD33、CLL1等多靶點(diǎn)進(jìn)行DAC藥物的研發(fā)(圖3)[3]。

圖3. DAC的臨床研究進(jìn)展及合作交易[3]
DAC藥物的非臨床藥理藥效評(píng)價(jià)
2022年10月31日,Orum Therapeutics的抗體-GSPT1(G1期至S期轉(zhuǎn)變蛋白1, G1 to S phase transition 1)降解劑偶聯(lián)物ORM-5029針對(duì)HER2陽性的晚期實(shí)體瘤,啟動(dòng)了I期臨床試驗(yàn)。這也使得ORM-5029成為了首個(gè)進(jìn)入臨床階段的DAC藥物[4]。下文將以O(shè)RM-5029已經(jīng)披露的數(shù)據(jù)為例,介紹DAC藥物早期的非臨床藥理藥效評(píng)價(jià)。
ORM-5029選擇的靶點(diǎn)是GSPT1,GSPT1不僅在腫瘤細(xì)胞中發(fā)揮重要的生物學(xué)功能,在正常細(xì)胞的轉(zhuǎn)錄和調(diào)控中也發(fā)揮著重要的功能,所以如果是單純靶向GSPT1的分子膠原料藥CC-885可能會(huì)引起一些脫靶毒性,因此選用GSPT1靶點(diǎn)有助于驗(yàn)證DAC的概念。整個(gè)ORM-5029的研發(fā)流程可以主要分為以下四個(gè)步驟[5](圖4):
1. 降解劑的修飾和篩選:因?yàn)镃C-885并沒有和連接子連接的位點(diǎn),所以需要對(duì)CC-885做一些修飾和篩選,篩選以對(duì)GSPT1的最大降解效率為標(biāo)準(zhǔn),同時(shí)也會(huì)考慮在中性條件下的水溶性及與CRBN的結(jié)合能力,篩選出一類化合物,并通過HiBiT系統(tǒng)在體外進(jìn)行降解動(dòng)力學(xué)的研究,根據(jù)其降解動(dòng)力學(xué)、水溶性及與CRBN/GSPT1形成三元復(fù)合物的穩(wěn)定性,最終選擇性能優(yōu)越的SMol006作為候選目標(biāo)化合物。
2. 抗體的選擇和表征:為了選擇作用靶點(diǎn)和適應(yīng)癥,用候選目標(biāo)化合物對(duì)200多種細(xì)胞株進(jìn)行敏感性測試,發(fā)現(xiàn)在HER-2陽性的乳腺癌和急性髓系白血病(Acute Myeloid Leukemia, AML)上都有明顯抑制效果,針對(duì)HER-2陽性乳腺癌,抗體部分選擇了帕妥珠單抗,最終DAC藥物由SMol006通過臨床驗(yàn)證的Val-Cit-PABc連接子與帕妥珠單抗結(jié)合。
3. 概念驗(yàn)證:偶聯(lián)形成DAC之后,檢測DAC與CC-885和ADC藥物T-DXd在不同HER-2表達(dá)水平的細(xì)胞株上的細(xì)胞毒性和體內(nèi)抑瘤能力,在HCC1569動(dòng)物模型上發(fā)現(xiàn)該DAC與SMoI006和載體對(duì)照組相比,能夠顯著抑制腫瘤生長并延長小鼠生存時(shí)間。
4. 藥效學(xué)研究:進(jìn)一步對(duì)候選DAC進(jìn)行體內(nèi)體外的藥效學(xué)研究,包括瘤內(nèi)降解水平、量效關(guān)系。
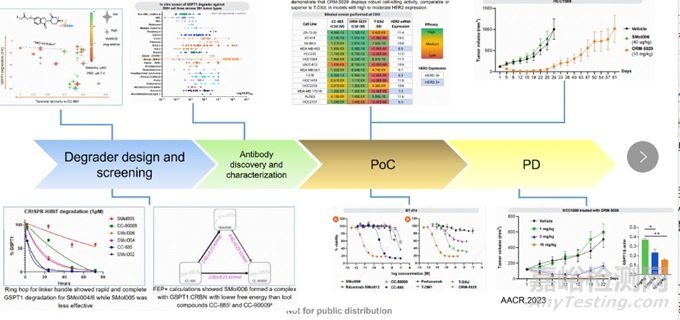
圖4. ORM-5029的研發(fā)流程[5]
DAC藥物藥理藥效評(píng)價(jià)的關(guān)注點(diǎn)
根據(jù)DAC藥物研發(fā)的經(jīng)驗(yàn),藥明康德生物學(xué)業(yè)務(wù)平臺(tái)總結(jié)了DAC藥物藥理藥效評(píng)價(jià)過程中4個(gè)階段的主要關(guān)注點(diǎn)(圖5):

圖5. DAC藥物藥理藥效評(píng)價(jià)的關(guān)注點(diǎn)
1、降解劑的篩選和評(píng)價(jià)
· 二元/三元復(fù)合物的形成:即便已有現(xiàn)成的degrader如CC-885,同樣需要對(duì)它們進(jìn)行一些修飾和優(yōu)化來增加連接子的連接位點(diǎn),修飾后的degrader既帶有連接子代謝的產(chǎn)物也會(huì)影響對(duì)目標(biāo)蛋白、E3連接酶的親和力,這些親和力會(huì)影響二元/三元復(fù)合物的形成。其中,三元復(fù)合物的形成更受關(guān)注,它是蛋白降解劑發(fā)揮功能的主要作用形式,可以通過蛋白和細(xì)胞層面進(jìn)行評(píng)價(jià),要注意可能出現(xiàn)的鉤狀效應(yīng)及鉤狀效應(yīng)點(diǎn),而在細(xì)胞層面不僅可以反應(yīng)三元復(fù)合物形成,同時(shí)也可以側(cè)面反饋出蛋白降解劑的透膜性[6]。
· 目標(biāo)蛋白的降解:在細(xì)胞層面通常通過In Cell Western、Western Blot、或HiBiT等實(shí)驗(yàn)技術(shù)進(jìn)行評(píng)價(jià)。
· 透膜性:有效的降解劑應(yīng)具有良好的細(xì)胞透膜性,良好透膜性也是DS-8201能在臨床上脫穎而出的很重要的因素,與傳統(tǒng)的“魔法子彈“設(shè)想選用不可降解的連接子不同,選用能夠降解的連接子并優(yōu)化小分子藥物的透膜性能夠帶來旁觀者效應(yīng),從而帶來更好的治療窗口 。透膜性不僅可以通過前文細(xì)胞層面的試驗(yàn)反饋,也可以通過經(jīng)典的Caco2 細(xì)胞模型和PAMPA方法等生物膜方法檢測[7]。

圖6. 降解劑的設(shè)計(jì)和篩選[6, 7]
2、抗體的選擇和表征
· 抗體和抗原的相互作用:抗原抗體的親和力會(huì)影響內(nèi)吞的效率,可以通過基于蛋白層面的測試(如ELISA/SPR)和基于細(xì)胞層面的測試(如FACS)進(jìn)行評(píng)價(jià)。
· Fc介導(dǎo)的活性:不僅與抗體依賴性細(xì)胞毒性(Antibody-Dependent Cell-mediated Cytotoxicity, ADCC)、補(bǔ)體依賴性細(xì)胞毒性(Complement-Dependent Cytotoxicity, CDC)及抗體依賴性細(xì)胞吞噬(Antibody-Dependent Cellular Phagocytosis, ADCP)有關(guān),還與Fc受體介導(dǎo)的內(nèi)吞有關(guān), 內(nèi)吞并不僅僅帶來更多的抗腫瘤活性,同時(shí),抗體偶聯(lián)藥物被腫瘤內(nèi)巨噬細(xì)胞吞噬后,還可以在巨噬細(xì)胞富含蛋白酶的溶酶體中充分降解,并釋放小分子藥物,產(chǎn)生旁觀者殺傷效應(yīng)。
· 內(nèi)化和定位:內(nèi)化的效率和內(nèi)化后的定位非常重要,內(nèi)化后需要定位在溶酶體中,并且停留足夠長的時(shí)間才能夠發(fā)揮作用。內(nèi)化效率可以通過FACS,Incucyte進(jìn)行動(dòng)力學(xué)的檢測,而Confocal則可以用于亞器官的定位。

圖7. 抗體的選擇和表征
3、概念驗(yàn)證
在DAC的概念驗(yàn)證階段,非常重要的一點(diǎn)是檢測目標(biāo)蛋白的降解是否是抗原依賴的,這一點(diǎn)能夠驗(yàn)證DAC的作用機(jī)制。如圖8A所示,對(duì)BRD4 DAC藥物進(jìn)行了檢測,可以觀察到其在HER2+的細(xì)胞中HER-2依賴性的降解,而在HER2-的細(xì)胞中降解較低。通過流式細(xì)胞術(shù)和CTG等常規(guī)方法可以進(jìn)一步檢測到細(xì)胞的凋亡(圖8B, C)。另外,也可以通過體外的一些方法進(jìn)行旁觀者效應(yīng)的檢測(圖8D)。在體內(nèi)層面,需要驗(yàn)證DAC藥物的作用機(jī)制,如DAC相比于等量的degrader,在體內(nèi)具有更好的抑瘤活性及DAC藥物量效關(guān)系(圖9)[5]。

圖8. DAC的體外概念驗(yàn)證

圖9. DAC的體內(nèi)概念驗(yàn)證[5]
4、藥效學(xué)/藥物動(dòng)力學(xué)
包括對(duì)DAC進(jìn)行體內(nèi)外的藥效學(xué)、藥物動(dòng)力學(xué)研究、量效比的研究等。
結(jié) 語
作為一個(gè)新興治療模式,DAC藥物展示出了與傳統(tǒng)的ADC相比獨(dú)特的作用機(jī)制和顯著的靶向性。與常規(guī)的降解劑相比,DAC具有更強(qiáng)的遞送能力、優(yōu)秀的靶向性、獨(dú)特的體內(nèi)代謝機(jī)制以及更廣闊的治療窗口。相比較于ADC, DAC藥物通過變更了payload端的作用機(jī)制,為抗體偶聯(lián)藥物的適應(yīng)癥拓展帶來更多的可能性;同時(shí)payload端具有更強(qiáng)的選擇性,也為抗體偶聯(lián)藥物帶來更強(qiáng)的靶向性。隨著研究的不斷深入,我們相信在未來,DAC藥物會(huì)在更多的疾病領(lǐng)域和適應(yīng)癥中發(fā)揮更大的作用,造福更多病患。
參考資料:
醫(yī)藥生物:從ADC到XDC,靶向化療邁入新時(shí)代-ByDrug-一站式醫(yī)藥資源共享中心-醫(yī)藥魔方, www. pharmcube.com
J Med Chem, 2018
Ki Bum Hong, 2023
34.6億美元:Seagen與Nurix合作開發(fā)降解劑偶聯(lián)抗體藥物, www.xueqiu.com
AACR 2023
Pettersson M, 2019
Promega Corporation

來源:Internet


