您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2024-06-06 08:36
歐盟MDR法規要求制造商在整個產品生命周期內證明其醫療器械的安全性、性能和受益,作為臨床評價的一部分。這一證據還需要臨床數據。因此,制造商必須在整個產品生命周期內收集和評估這些臨床數據。這種不斷更新臨床評價的過程被稱為上市后臨床跟蹤,即PMCF。
【PMCF定義】
MDR附錄XIV Part B關于PMCF的定義如下:
“PMCF應被理解為更新MDR附錄第61條和附錄XIV Part A中提及的臨床評價的連續過程,并應在制造商的上市后監督計劃中加以解決。”
也就是說,PMCF是臨床評價持續更新過程,而PMCF計劃應作為PMS計劃的一部分。
【PMCF評價對象】
進行PMCF時,制造商應主動收集和評價帶有CE標志的器械按其預期用途投放市場或投入使用,在人體內或人體上使用的臨床數據。
【PMCF目的】
確認器械預期壽命內的安全性和性能,
識別先前未知的副作用并監測所識別的副作用和禁忌癥,
在事實證據的基礎上識別和分析突發風險,
確保受益風險比的持續可接受性,以及
識別器械可能的系統性誤用或標簽外使用,以驗證預期用途的正確性。
【PMCF和PMS的差異】
PMCF是上市后監督(PMS)的一個子集。
PMS涉及從現場收集所有類型的信息,如服務報告、熱線電話、客戶投訴等。PMS的目標比PMCF的目標更廣泛。
PMCF旨在更新臨床評價,而PMS的目標是確定是否需要采取必要措施以確保患者和從業人員安全。該決定考慮了臨床評價的結果。因此,PMCF是PMS的一個子集。

【公告機構對PMCF文檔審核重點】
PMS計劃中是否包括PMCF計劃?
PMCF計劃是否充分?
PMCF活動是否記錄在PMCF報告中?
如不進行PMCF,是否有合理的解釋?
是否建立了PMCF相關程序文件?
注1:PMCF計劃模板,請參考MDCG 2020-7指南;PMCF報告模板,請參考MDCG 2020-8指南。
注2:證明為什么不需要PMCF活動時,可以從以下兩點考慮:
從MDCG 2020-6來描述成熟的技術,
基于風險管理,并考慮器械與人體之間相互作用的具體特征、預期臨床性能和器械的聲明。
【PMCF活動包括哪些?】
在MDR, Annex XIV, Part B,6.2的 (a)和(b)小項中明確PMCF活動包括兩類,即:一般的PMCF方法和程序、特定的PMCF方法與程序。
一般的PMCF方法和程序,包括:收集獲得的臨床經驗、用戶的反饋、科學文獻和其他來源臨床數據的篩選;
特定的PMCF方法與程序,包括合適的登記數據或PMCF研究的評價。
其他PMCF活動:
來自衛生保健專業人員的調查
來自患者/用戶的調查
審查可能顯示濫用或標簽外使用的病例報告
真實世界的證據分析
PMCF活動的要求:
至少,必須進行特定產品的文獻搜索,以從同行評審的科學文獻中發表的報告中獲得所謂的關鍵數據。
對于根據第61(4)條未進行臨床研究的植入類器械和III類器械,PMCF計劃應包括上市后研究,以確認器械的安全性和性能。
【PMCF文檔更新頻率】
我們需要先了解下PMSR、PSUR和CER更新的頻率,因為PMCF報告的數據需要根據器械分類相應更新到PMS報告或PSUR報告,和CER中。
PMSR適用于I類器械,PSUR適用于IIa, IIb, 和III類器械。
PMSR是對所有PMS活動(包括PMCF)以及任何糾正和預防措施的結果的總結。PMSR應根據需要進行更新,并應要求提供給主管當局。
PSUR是高風險器械所必需的,是PMSR的一個更穩健的版本。PSUR總結了PMS數據的結果和結論,包括PMCF的主要發現,以及所采取的任何預防和糾正措施的理由和描述。也包括其他結論,如估計的銷售額、更新的風險受益決定和用戶群體特征。
在CER的更新時應包括PMCF結果的摘要,以及是否需要額外的PMCF或停止PMCF活動的理由。可以根據PMCF數據對器械安全性和性能的闡明以及對受益風險比的持續接受程度,評估CER中應包含哪些PMCF數據以及應包含多少PMCF數據。
PMSR、PSUR和CER更新的頻率如下:
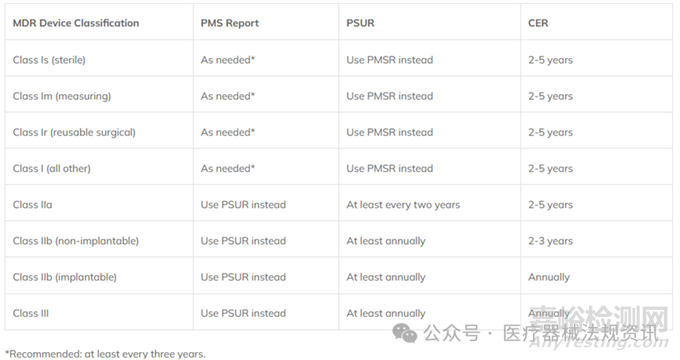
MDR雖然規定了PMSR、PSUR和CER以上更新頻率,PMSR、PSUR和CER這三份文件必須包括PMCF過程的關鍵輸出。然而,這并不意味著PMCF報告的更新頻率必須與這三份文件的更新頻率一致。
有些活動應該更頻繁地進行,例如文獻綜述。此外,PMCF研究或用戶調查的中期分析提供了信息,以得出適當的措施或對研究方案或設計進行調整,例如,在患者或研究中心數量發生變化的情況下。
對于III類器械和植入類器械,PMCF報告應至少每年更新一次。
在PSUR準備的兩年期內,可能會準備多份PMCF報告,因為可能有多個活動具有不同的間隔。建議在PSUR中包含每個PMCF報告的簡要摘要。
在任何情況下,在準備每個PSUR之前,都應該查看評估期間發生的所有PMCF分析和評估報告,看看是否所有內容都已完成。如果PMCF活動尚未完成,PSUR必須解釋為什么可能與計劃存在偏差,或者為什么沒有足夠的PMCF輸出。

來源:醫療器械法規資訊


