您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-06-05 11:41
醫用導管固定裝置根據《醫療器械分類目錄》,申報產品屬于子目錄14-注輸、護理和防護器械,一級產品類別16-其他器械,二級產品類別08-體表器械固定裝置,管理類別為Ⅱ類。
一、醫用導管固定裝置的工作原理和結構組成
1、工作原理
醫用導管固定裝置工作原理是利用涂膠基材或固定帶將導管固定裝置固定于創口部位,通過固定卡扣或可調節粘扣產生的壓力固定引流管或導管,起到固定防脫作用。
2、結構組成
產品通常由體表固定件和導管固定件兩部分組成。體表固定件通常為涂膠基材或固定帶,涂膠基材可由涂有醫用壓敏膠的無紡布或薄膜、吸收墊、離型層組成;固定帶可由綁帶、海綿墊、粘扣組成。導管固定件通常為固定座、塑料卡扣或硅膠扣。典型產品結構示意圖如下:
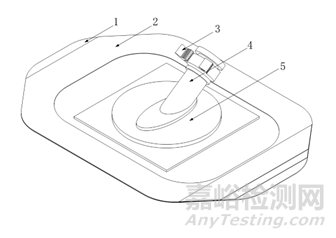
1.離型層 2.薄膜 3.塑料卡扣 4.固定座 5.吸收墊
圖1 粘貼式產品結構示意圖
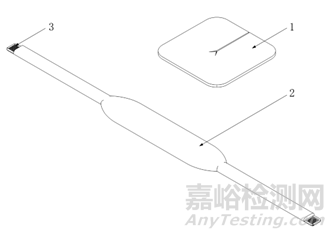
1.吸收墊 2.固定帶 3.粘扣
圖2 綁帶式產品結構示意圖
二、醫用導管固定裝置的主要風險
產品主要危險見表
表 產品主要危險
|
危險類型 |
事件和情形示例 |
可能發生的傷害 |
|
|---|---|---|---|
|
生物學和化學危險 |
生物污染 |
(1)生產環境控制不達標。 (2)滅菌操作不規范。 (3)包裝材料選擇不適當。 (4)包裝封口缺陷。 |
引起患者感染。 |
|
化學污染 |
清潔劑、消毒劑和滅菌劑的殘留物可能造成化學性能不符合要求、環氧乙烷及其衍生物輸入人體。 |
損害使用人員及患者健康。 |
|
|
生物不相容性 |
產品材料的選擇未經生物學評價或使用生物不相容的材料;滅菌劑殘留于高吸附的敷貼中。 |
毒性或刺激。 |
|
|
環境危險 |
儲存或運行偏離預期的環境條件(如溫度、濕度) |
(1)產品非正常老化。 (2)產品使用有效期縮短,產品帶菌。 |
功能性、使用性喪失。 引起患者感染。 |
|
由于廢物和(或)醫療器械處置的污染 |
產品使用后,未按醫療垃圾處理。 |
環境污染。 交叉感染。 |
|
|
意外的機械破壞 |
固定卡扣破裂或可調節粘扣不牢固。 |
功能性、使用性喪失。 |
|
|
與醫療器械使用有關的危險 |
不適當的標記 |
標記不清晰、錯誤、沒有按照要求進行標記導致錯誤使用、儲存錯誤或產品辨別錯誤。 |
引起患者感染。 操作失效。 |
|
由不熟練/未經培訓的人員使用 |
操作不熟練、操作失誤;規格型號選用錯誤無法保證產品固定效果。 |
功能性、使用性喪失。 |
|
|
與醫療器械使用有關的危險 |
對產品可能再次使用的危害警告不適當 |
對一次性使用醫療器械很可能再次使用的危害警告不適當,重復使用。 |
交叉感染。 |
|
功能性失效和老化引起的危險 |
對產品使用期限缺少適當的規定,對產品更換要求未提示 |
不當的說明書。 產品使用處置不當。 產品超期使用。 未及時更換導致壓瘡和滲液風險。 |
功能性、使用性喪失。 人員感染。 破壞環境。 |
|
不適當的包裝 |
沒有進行包裝確認造成產品污染,從而導致出現細菌感染。 |
交叉感染。 |
|
三、醫用導管固定裝置性能研究實驗要求
1、原材料控制
應明確產品生產過程中由原材料至終產品所需全部材料(包括添加劑、助劑等)的基本信息,如名稱、供應商、符合的標準等。
關鍵原材料應具有穩定的供貨渠道以保證產品質量,應明確原材料質量控制指標及要求。
對于首次用于醫療器械方面的新材料,應開展該材料適合用于符合預期用途的相關研究。
2、產品性能研究
應明確產品技術要求中主要性能指標及檢驗方法的確定依據。可參考行業標準YY/T 1627,制定適合產品部分的技術指標,另結合實際臨床使用情況及臨床需求,開展產品使用性能、使用時間或者特殊設計等研究。
3、聯合使用
醫用導管固定裝置與各類導管配合使用,應明確配套使用產品的情況。
4、生物學特性研究
應明確產品與人體接觸的材料,以及接觸的性質和時間,按照GB/T 16886.1和《醫療器械生物學評價和審查指南》的要求對其進行生物相容性評價。
若開展申報產品與已上市產品等同性比較的生物相容性評價,應按照《醫療器械生物學評價和審查指南》要求進行評價,證明申報產品與已上市產品具有等同性。
若無法證明申報產品與已上市產品的等同性,應按照GB/T 16886.1的要求開展申報產品生物相容性試驗。
5、滅菌工藝研究
可參考GB 18279系列標準、GB 18280系列標準和GB/T 16886.7等標準的要求,明確產品包裝及滅菌方法選擇的依據,經過確認并進行常規控制,并應開展以下方面的確認:
5.1產品與滅菌過程的適應性:應考察滅菌方式、滅菌工藝過程對于醫用導管固定裝置的影響。
5.2包裝與滅菌過程的適應性。
5.3應明確滅菌工藝(方法和參數)和無菌保證水平(SAL),并開展滅菌確認。無菌保證水平(SAL)應達到1×10-6。
5.4殘留毒性:若滅菌使用的方法容易出現殘留,如環氧乙烷滅菌,應當明確殘留物信息及采取的處理方法,并開展環氧乙烷解析的研究。
6、穩定性研究
6.1貨架有效期
應開展貨架有效期研究,證明在貨架有效期內,產品可保持性能功能滿足使用要求。
產品貨架有效期驗證可采用實時穩定性試驗或加速穩定性試驗。加速穩定性試驗的具體要求可參考YY/T 0681系列標準、YY/T 0698系列標準、GB/T 19633系列標準。無論加速穩定性試驗還是實時穩定性試驗,開發人需在試驗方案中設定檢測項目、檢測方法及判定標準。檢測項目包括產品自身性能檢測和包裝系統性能檢測兩方面。前者需選擇與醫療器械貨架有效期密切相關的物理、化學檢測項目,后者包括包裝完整性、包裝強度和微生物屏障性能等驗證項目。當加速穩定性試驗與實時穩定性試驗結果不一致時,應以實時穩定性試驗結果為準。
6.2運輸穩定性
應當開展運輸穩定性和包裝研究,證明在生產企業規定的運輸貯存條件下,運輸和貯存過程中的環境條件(例如:震動、振動、溫度和濕度的波動)不會對產品的性能,包括完整性,造成不利影響,并能夠保持無菌狀態。可依據GB/T 19633、GB/T 4857系列標準對包裝進行分析研究和評價。
7、其他
醫用導管固定裝置已經列入《免于臨床評價醫療器械目錄》(以下簡稱《目錄》)。開發人應當按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》,從基本原理、結構組成、產品制造材料或與人體接觸部分的制造材料、性能要求、滅菌方式、適用范圍、使用方法等方面,證明產品的安全有效性。

來源:嘉峪檢測網


