眾所周知,因為口服制劑易于管理、穩定性好、生產工藝成熟、商品成本低,口服給藥仍是藥物給藥途徑的首要選擇。對于口服給藥藥物遞送策略來說,藥物需要滿足一定的口服生物利用度才能達到應有的藥效,而藥物在吸收部位溶解,將是決定藥物吸收的重要因素。難溶性藥物猶如雨后春筍般涌現,限制了藥物在胃腸道吸收部位的溶解,限制了口服藥物的吸收,最終影響了新藥開發的體內暴露問題,可能造成項目正常的往前推進受到影響。一個比較嚴峻的現實是,已上市品種中大約75%藥物為難溶性藥物,而處于研發產線中難溶性的占比更加突出,甚至在90%以上(圖1)。
圖1 基于BCS分類系統已上市品種藥物的分類占比[1]
為了解決限制藥物吸收的溶解度問題,提高藥物的體內暴露,制劑科學家們探究了眾多的增溶策略(圖2),如原料粉碎,微粉甚至納米化,環糊精包合技術以及在處方中加入助溶劑,潛溶劑,增溶劑,藥物固態開發策略(包括多晶型篩選,鹽型/共晶研究,無定形固體分散體制備)以及脂質制劑(如微乳,納米乳等)。
圖2 常見的難溶性藥物增溶策略[2]
增溶策略眾多,為了更好的有針對性的選擇增溶策略,我們不妨從化合物的溶解過程去探究藥物溶解的限速步驟。俗話說,知其然,知其所以然。了解化合物的溶解的原理(圖3),針對其“癥結”,“因病施治”,或許更容易“藥到病除”。圖3a描述了溶劑-溶劑,溶質-溶質分子間的分離狀態以及其與其他類型的分子的相互作用;圖3b描述了溶質分子轉移到溶液的過程,首先溶質分子需要從晶格中脫離,即要打破晶格能,脫離溶質分子之間的作用力,然后溶劑分子要空出容納溶質分子的空間,即離解溶劑分子之間的相互作用(空化能);圖3c溶質分子進入溶劑后,溶劑分子與溶質分子將發生穩定的相互作用,這個過程需要的能量稱之為溶劑化能(溶劑通常為水性溶劑)。
圖3 化合物的溶解過程[3]
總結來說,一個晶體藥物的溶解過程,涉及三種能量,即需要打破的晶格能,溶劑間空出空隙的空化能,溶質分子溶劑化的溶劑化能。一般認為,晶格能和溶劑化能能量要大于空化能,所以一個晶體化合物的溶解度較差通常認為與晶體藥物溶解過程所涉及的晶格能和溶劑化能較強有關。
溶質分子間具有強的晶格能,限制了溶質分子的解離,這類化合物稱之為“brickdust”,如石頭般“頑固不化”。通常,使用化合物的熔點來顯示其對于藥物溶解度的限制,即熔點越高,晶格能越強,溶解度越低。熔點的臨界值一般為200℃。
圖4 LogP對于化合物口服生物利用度的影響[5]
溶質分子需要與溶劑分子相互作用,“水乳交融”,但是一般疏水化合物與溶劑分子作用有限,此類高疏水性的難溶性藥物稱之為“greaseball”,通常描述水化作用的參數為油水分配系數LogP,有建議將LogP2-3作為溶劑化能是否會限制晶體化合物溶解的臨界值,看更多的資料發現,很多科學家更會把LogP在5以上作為臨界值(圖4,5),Lonza對于logP值低于5,而熔點過高,晶格結構限制化合物溶解度的化合物,推薦采用固體分散體技術,使穩固的晶體結構土崩瓦解,呈現無定形狀態;當LogP高于5,水合能力較差,疏水性強,可以通過脂質制劑,助力形成亞微米乳穿過未攪拌的水層,提高疏水藥物體內吸收。一個基本的認識就是LogP數值越大,化合物疏水性越強。對于可電離的化合物分子,可能使用LogD會更加的準確。
圖5 Lonza基本化合物的熔點和LogP作為增溶策略的選擇依據[6]
比較現實的問題,有些化合物可能兼具熔點高和LogP大的特點,大概可以推測出此化合物可開發性極差,很難通過增溶的技術達到目標的生物利用度,當然,藥物分子在胃腸道吸收的過程和機制極其的復雜,尚需進行全面的研究。從上可知,化合物結構導致藥物分子用于口服給藥具有挑戰性的物理化學特性,從藥物溶解度的角度提煉出了化合物兩個最基本的理化性質參數熔點和LogP,可用于表征化合物的溶解度限制因素,從而可以有針對性的選擇增溶策略。
舉例:特拉匹韋具有高度結晶性,熔點246°C且具有比較強的疏水性,logP為4.0,導致結晶藥物水溶性極差(4.7μg/ml),其溶解度實際上低于大理石(14μg/ml)。初步制劑研究,表明溶液、混懸劑甚至納米晶混懸劑導致特拉匹韋的口服暴露量非常低。特拉匹韋配制成無定形噴霧干燥分散體,顯著提高了在水性介質中的動力學溶解度,最終提高了生物利用度。
難溶性藥物越來越多,溶解度的下限不斷地刷新,正如特拉匹韋的案例所示,有些化合物的溶解度甚至要低于大理石。正如圖5所示,對于熔點較高,化合物溶解度極差,僅僅通過固態形式的改變(粒度較小甚至納米晶等手段)很難克服;對于一些酸堿性的化合物來說,成鹽在一定程度上可以提高藥物的飽和溶解度,但是如何篩選合適的反離子以及藥物本身的酸堿性極弱,造成所篩選的鹽型易于發生歧化反應,這個問題遇到的幾率再增加,而且還有可能犧牲藥物的其他的性質。
固體分散體增溶手段從概念的提出到上市產品的應用,已經走過了60年以上的時間,理論逐步的完善,實踐在很多的品種上獲得了成功。無定形固體分散體將穩定的晶態藥物轉變為高能的無定形形態,提高了難溶性藥物的溶解度,是克服藥物難溶性的有效手段之一。當然,在解決問題的同時,同樣也伴隨著新的問題的發生,例如物理穩定性問題。高能態的無定形形式勢必要自發的轉向低能的穩定晶型狀態,猶如水往低處流淌一樣,但是隨著高分子材料的開發與應用,在維持無定形的物理穩定性上,雖然不能阻斷轉晶的發生,但是卻可以延長轉晶發生的時間,以保證藥品的貨架期。
總結:上文我們闡明了目前藥物研發遇到的攔路虎-藥物的難溶性,而且情況很是嚴峻。雖然增溶策略眾多,但是如何進行快速的有效的有針對性的選擇增溶策略呢?為了明晰這個問題,我們又簡單介紹了一個晶體藥物的溶解度過程,明確了可能限制溶解度的化合物理化性質-化合物的熔點及LogP,接著我們引用了Lonza內部的一個增溶策略決策圖,證實了化合物熔點和LogP可用于指導選擇增溶策略,而且對于極其難溶的藥物很難通過一般粒度控制策略去解決,最后我們強調了無定形固體分散體在解決難溶性藥物的機遇與挑戰。本文更是像是一個前言或者引子,表明為什么會選擇固體分散體技術以及它與其他增溶策略的不同點。
前文我們提到難溶性藥物猶如洪水一般奔涌而來,藥物無法溶解,將無法完成吸收,影響化合物的體內生物利用度,影響藥物的療效,除此之外還可能具有食物效應,造成病人體內PK變異性較大,甚至產生毒副作用(圖6)。為了切實的解決難溶性藥物問題,我們引入增溶策略-固體分散體技術。
圖6 口服給藥難溶性抗腫瘤藥物隨著帶來的問題[1]
Sekiguchi和Obi于1961年首次報道了使用固體分散體作為提高水溶性藥物溶出度和口服生物利用度的手段,制劑科學家們并在隨后的60年中進行了廣泛探索,目前已經應用固體分散體技術開發上市40個品種(圖7)。
無定形態具有高能,溶解度要高于穩定晶型形式。制備的固體分散體中藥物要么以相分離的結晶或無定形的形式混懸在聚合物材料中,要么以藥物和聚合物的均勻分子混合物的形式存在。增溶的機制在很大程度上由所形成的固體分散體的結構決定,但在許多情況下,它是由相同材料的晶態和無定形態的溶解度和溶出行為的根本差異所支撐的。考慮到結晶和無定形藥物溶解度通常存在很大差異,不同種類的固體分散體通常會導致溶出速率的顯著差異。含有無定形形式藥物的固體分散體通常比含有結晶藥物的制劑表現出更快的溶出速率,從而顯著改善藥物吸收。
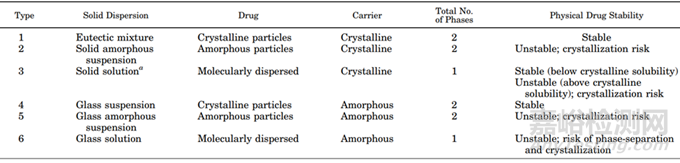
聚合物可以以無定形或結晶形式存在,其中聚合物分子還是以無定形存在居多。據文獻報道固體分散體種類眾多(圖8),比較理想的狀態是固體溶液,藥物以分子的形式均勻分散在無定形的聚合物材料中;比較常見且易于制備的固體分散體更多的是藥物以無定形形式分散體聚合物材料中,即無定形固體分散體。
圖7 已上市以固體分散體技術為制備的產品[2]
圖8 固體分散體的分類[3]
固體分散體通過多種機制增加藥物溶出,包括有效粒徑的減小、潤濕性的改善、表面活性劑的增溶作用,通過將藥物穩定在溶解度更高的無定形狀態來消除晶格能的影響以及維持過飽和的時間。
俗話說,知其然,知其所以然!今天我們不妨去探究為什么在新的歷史時期固體分散體成為難溶性藥物眾多增溶策略中的寵兒,它具有什么獨特的功能以達到增溶的目的?
a.粒徑減小。
眾所周知,原料的處理方式,比較常見的是錘式粉碎,一般原料的粒度可以粉碎到D90在10μm左右;如果想獲得更低粒度的API,就不得不借助耗能更強的微粉,一般可以微粉到2-5μm,查文獻接觸到一個詞,臨界粒度,表明了一個道理,每一種粉碎技術對應一個所粉碎API粒度的下限;固體分散體中藥物以混懸或分子分散在聚合物中的藥物(無論是無定形的還是結晶的)。在大多數情況下,混懸的藥物顆粒具有比傳統固體制劑中通常更小的顆粒尺寸,并且在分子分散體的情況下,理論上,聚合物中藥物的顆粒尺寸被最小化到單個分子的尺寸。顆粒尺寸的減小提供了溶出的有效表面積的增加。在一種比較極端的情況,制備的固體分散體物理不穩定,無定形轉為了結晶型,可能制備的產品溶出依舊大于微粉處理的情況,因為固體分散體即使析晶所產生的聚集體的粒度可能都要小于2μm。根據經典的Noyes-Whitney方程,比表面積的增加,藥物溶出速率增加,進而可以提高藥物吸收部位的藥物濃度,提高藥物吸收與暴露,最終提高藥物的生物利用度。與傳統制劑比較,固體分散體通過降低了API粒度,提高其比表面積,進而增加了藥物的溶出速率(圖9)。
圖9 與傳統的片劑或者膠囊制劑相比,開發的固體分散體在提高藥物溶出速率和生物利用度方面上的優勢。[4]
b.藥物潤濕性和增溶。
高水溶性聚合物材料的使用還促進水性介質快速流入固體分散體,從而增加潤濕性。為了利用這種效果,第一代固體分散體使用低分子量、高度水溶性的聚合物,例如尿素,甘露醇,山梨醇等。在晶體固體分散體中,晶體藥物分散在晶體聚合物內,形成共晶或單晶混合物。增加藥物溶解度和溶出速率的主要方法有減小粒徑、提高潤濕性和改變多晶型。
圖10 開發的固體分散體所用的聚合物材料的迭代發展[5]
聚乙二醇(PEG)是第一種被廣泛開發的第二代聚合物輔料,是第一個商業固體分散產品所采用的聚合物。PEG可以通過熱熔擠出容易地與藥物融合,然而,與藥物和聚合物的簡單物理混合物相比的益處并不總是顯而易見的。在無定形固體溶液中,藥物和無定形聚合物可以完全混溶,形成分子均質的混合物,而無定形固體混懸液是由兩個獨立的相組成。第二代固體分散體主要包含無定形聚合物聚合物,無定形聚合物主要為全合成聚合物包括聚維酮(PVP),聚乙二醇(PEG),交聚維酮(PVP-CL),聚乙烯吡咯烷酮-共乙酸乙烯酯(PVPVA)和聚甲基丙烯酸酯。天然產物的聚合物由纖維素衍生物組成,例如羥丙基甲基纖維素(HPMC),羥丙基纖維素(HPC),羥丙基甲基纖維素鄰苯二甲酸酯(HPMCP),羥丙基甲基纖維素乙酸琥珀酸酯(HPMCAS)等。
API既可溶解并混懸在聚合物中,也可同時以無定形和結晶狀態存在。在無定形固體分散體中,API的尺寸非常小(分子,無定形顆粒或小晶體),而以超飽和狀態存在于無定形聚合物中。當無定形固體分散體溶于水時,無定形聚合物可以提高藥物的潤濕性和分散性,并抑制藥物的沉淀過程。由于無定形聚合物的熱力學穩定性低,溶出速率快,增強了藥物的溶解度和釋放速率。
構建第三代固體分散體在聚合物包括表面活性,可促進制劑的乳化和藥物的增溶。許多表面活性劑已被添加入固體分散體中,包括離子型(如十二烷基硫酸鈉)和非離子型表面活性劑(如Pluronic嵌段共聚物)。具有兩親結構的表面活性劑可增強藥物和聚合物的混溶性,從而降低藥物的重結晶速率。而且,表面活性劑或乳化劑通過吸收到藥物顆粒的外層或形成膠束來封裝藥物,從而提高藥物的潤濕性并防止由于過飽和而引起藥物沉淀。第四代固體分散體是控釋固體分散體,其主要應用于水溶性差,生物半衰期短的藥物。
總結:固體分散體增溶策略充滿著機遇以及挑戰。但是,我們仍然清楚看到其無限的應用前景和生命力。目前已經上市固體分散體品種中,以噴霧干燥和熱熔擠出工藝在固體分散體開發中應用最為廣泛,工藝的選擇和工藝參數的設定都會直接影響所制備的固體分散體的性質,如固體分散體粒度及其粒度分布,物理穩定性,結晶度等。這些固體分散體的關鍵理化性質又會進一步影響藥物在體內外的溶解度和溶出的情況,最終會對體內的生物利用度造成影響。固體分散體的穩定性需要聚合物來提供相互作用力,以保證所制備的固體分散體在體內外水性環境過飽和時間的維持以及或貨架期的儲藏環境的物理穩定性(保持無定形狀態)。當然,無論是固體分散體的粒度,藥物在聚合物中分布狀態及形式以及聚合物材料的種類及處方組成,都在一定程度上助力于難溶性藥物溶解度的提高。后續文章,我們將進一步介紹固體分散體增溶的比較核心的機理。
參考文獻
[1] Di L , Kerns E , Carter G .Drug-Like Property Concepts in Pharmaceutical Design[J].Current Pharmaceutical Design, 2009.DOI:10.2174/138161209788682479.
[2] Patel K , Shah S , Patel J .Solid dispersion technology as a formulation strategy for the fabrication of modified release dosage forms: A comprehensive review[J].Daru : journal of Faculty of Pharmacy, Tehran University of Medical Sciences, 2022, 30(1):165-189.DOI:10.1007/s40199-022-00440-0.
[3] Bhattachar S N , Deschenes L A , Wesley J A .Solubility: it's not just for physical chemists[J].Drug Discovery Today, 2006, 11(21-22):1012-1018.DOI:10.1016/j.drudis.2006.09.002.
[4] Bergstrom,Christel,A,et al.Computational prediction of drug solubility in water-based systems: Qualitative and quantitative approaches used in the current drug discovery and development setting[J].International Journal of Pharmaceutics, 2018.
[5] Kerns E H , Di L .Drug-Like Properties: Concepts, Structure Design and Methods[M].Elsevier LTD, Oxford,2008.
[6].Lonza:Technology Selection for Bioavailability Enhancement(https://www.lonza.com/knowledge-center/smallmolecules/es/oral-bioavailability-enhancement-programs)
[7] Anane-Adjei A B , Jacobs E , Nash S C ,et al.Amorphous solid dispersions: Utilization and challenges in preclinical drug development within AstraZeneca[J].International journal of pharmaceutics, 2022, 614:121387.DOI:10.1016/j.ijpharm.2021.121387.
[8] Kwong A D , Kauffman R S , Hurter P ,et al.Discovery and development of telaprevir: an NS3-4A protease inhibitor for treating genotype 1 chronic hepatitis C virus.[J].Nature Biotechnology, 2011, 29(11):993-1003.DOI:10.1038/nbt.2020.
[9] Vasanthavada M , Tong W , Serajuddin A T M .Development of Solid Dispersion for Poorly Water-Soluble Drugs[M]. 2008.
[10]Williams, Hywel D ,Trevaskis,et al.Strategies to Address Low Drug Solubility in Discovery and Development[J].[2023-11-13].
[1] Gala U H , Miller D A , Williams R O .Harnessing the therapeutic potential of anticancer drugs through amorphous solid dispersions[J].Biochim Biophys Acta Rev Cancer, 2020(1).DOI:10.1016/j.bbcan.2019.188319.
[2] Patel K , Shah S , Patel J .Solid dispersion technology as a formulation strategy for the fabrication of modified release dosage forms: A comprehensive review[J].Daru : journal of Faculty of Pharmacy, Tehran University of Medical Sciences, 2022, 30(1):165-189.DOI:10.1007/s40199-022-00440-0.3..Development of Solid Dispersion for Poorly Water-Soluble Drugs
[3] Williams, Hywel D ,Trevaskis,et al.Strategies to Address Low Drug Solubility in Discovery and Development[J].[2023-11-13].
[4] Liu, R. (Ed.). (2017). Water-Insoluble Drug Formulation (3rd ed.). CRC Press. https://doi.org/10.1201/9781315120492
[5] Vo L N , Park C , Lee B J .Current trends and future perspectives of solid dispersions containing poorly water-soluble drugs[J].European Journal of Pharmaceutics & Biopharmaceutics, 2013, 85(3):799-813.DOI:10.1016/j.ejpb.2013.09.007.