摘要
目的:探討化學藥口服固體制劑變更原料藥供應商的研究流程。
方法:以苯磺酸氨氯地平片變更原料藥供應商為例,考察變更后原料藥的晶型、粒度分布、有機雜質、殘留溶劑、致突變雜質、元素雜質;利用變更后的原料藥制備3批小試樣品,考察在0.01mol/L鹽酸溶液、pH4.0醋酸鹽緩沖液、pH5.5磷酸鹽緩沖液、pH6.8磷酸鹽緩沖液中的溶出曲線;進行3批工藝驗證,比較原料藥供應商變更前后樣品中有關物質、含量均勻度、溶出度、含量等制劑關鍵質量指標的差異,并考察溶出曲線。
結果:供應商變更后,原料藥粒度D50為9~10μm,D90為20~23μm;晶型、有機雜質基本一致;均未檢出殘留溶劑、致突變雜質;元素雜質含量測定結果均符合規定。3批小試樣品在4種溶出介質中的溶出曲線與參比制劑和生物等效(BE)批制劑的溶出曲線均一致。3批工藝驗證樣品的含量、含量均勻度、溶出度分別為99.7%~99.9%、5.8%~5.9%、97%~100%,均不低于變更前的98.3%~99.5%、5.3%~5.8%、97%~99%;有關物質中,雜質D含量均為0.04%,低于變更前的0.06%~0.10%。
結論:基于苯磺酸氨氯地平片變更原料藥供應商質量研究,初步建立了化學藥口服固體制劑變更原料藥供應商研究的基本流程。
關鍵詞
苯磺酸氨氯地平片;化學藥;口服固體制劑;藥物活性成分;供應商變更;藥品監管
正文
苯磺酸氨氯地平片控制血壓效果較好,主要適應證為高血壓、冠狀動脈粥樣硬化性心臟病等。由于人們不良的飲食及作息習慣,高血壓患病人數呈上升趨勢,且患者多為中老年人,一旦確診需長期用藥,故苯磺酸氨氯地平片等降血壓類藥物在國內有較大市場[1-7]。變更管理是藥品生產企業質量管理的重要部分[8-12],《藥品生產質量管理規范(2010年修訂)》(衛生部令第79號)、美國食品和藥物管理局(FDA)的《藥品生產質量管理規范》(GMP)法規及歐盟GMP法規均對變更管理作了具體要求。原料藥供應商變更是藥品生產企業變更管理中常見的一項變更事項,原因包括原料壟斷、成本考慮、原料供貨及時性和可控性等,且原料藥質量對制劑的安全性、有效性和質量可控性影響較大,故需對變更后原料藥供應商生產的原料藥進行充分研究和驗證[13-17]。本研究中以苯磺酸氨氯地平片為例,探討了化學藥口服固體制劑變更原料藥供應商研究的基本流程。現報道如下。
1、儀器與試藥
1.1 儀器
LC-20AT型高效液相色譜儀(日本Shimadzu公司);7890B型氣相色譜儀(美國Agilent公司);Bettersize 2600型激光粒度分布儀(丹東百特儀器有限公司);D8Advance型X射線衍射儀(德國Bruker公司);UDT-818A-12型溶出試驗儀(祿根儀器<鎮江>有限公司)。
1.2 試藥
苯磺酸氨氯地平原料藥(供應商A,批號分別為20AD219,20AD230,20AD241);供應商B,批號分別為C-032007004,C-032103015,C-032103016,C-032104007);苯磺酸氨氯地平片[輝瑞制藥有限公司,批號為R93379(參比制劑);國藥集團容生制藥有限公司,批號分別為171004(生物等效批)和180401,180402,180403(供應商A),20102711,20102911,20102912(供應商B)]。
2、方法與結果
2.1 原料藥
整體情況:本公司生產的苯磺酸氨氯地平片于2019年通過一致性評價,同年集中采購中標,因變更前原料藥供應商為國外企業,考慮到原料藥的可及性,尤其是目前全球疫情形勢下境外生產原料藥的風險,故原料藥增加已獲批的國內供應商,以保證藥品安全性、有效性、質量可控性及供貨穩定性。同時,依據國家藥品監督管理局審評中心發布的《已上市化學藥品藥學變更研究技術指導原則(試行)》中第六項“變更制劑所用原料藥的供應商”中所需研究驗證工作及人用藥品技術要求國際協調理事會(ICH)Q3中相應指導原則,選定原料藥的粒度分布、晶型、有機雜質、殘留溶劑、致突變雜質、元素雜質進行研究,并對制劑進行小試研究、工藝驗證。供應商變更前后,合成工藝、殘留溶劑、元素雜質不同,有機雜質、致突變雜質相同。詳見表1。
粒度分布:溶出度是影響口服固體制劑在體內溶解、吸收的關鍵指標,藥品溶出度與原料藥的粒度聯系緊密,故采用粒度分布儀對變更前后不同供應商原料藥的粒徑進行檢測。結果見表2,其中D50和D90分別為顆粒累積分布50%和90%的粒徑,供應商A和供應商B的原料藥顆粒的D50和D90基本一致。
晶型:藥物的晶型對制劑的溶解度和溶解速率、藥物的吸收速率、藥物的臨床療效及安全性等均有影響,故原料藥供應商發生變更時,晶型也是需要考慮的因素之一。對苯磺酸氨氯地平原料藥進行X射線衍射(XRD)分析,結果供應商變更前后原料藥晶型一致。詳見圖1。
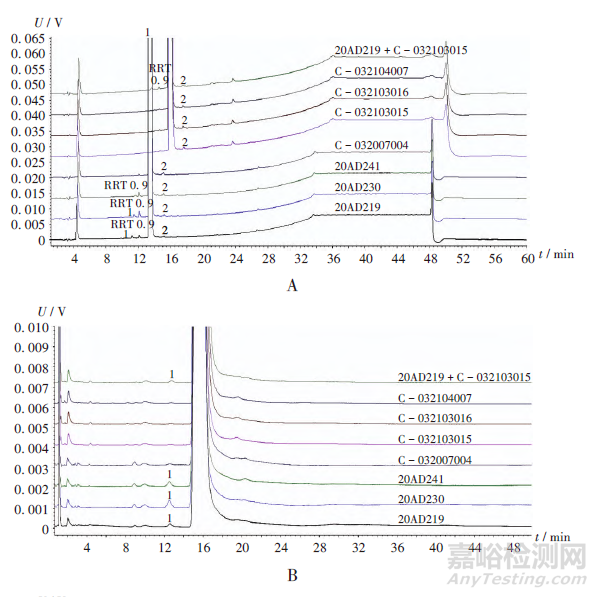
有機雜質:對生產工藝路線進行對比研究,確定供應商變更前后原料藥中有機雜質類別;采用苯磺酸氨氯地平各國藥典標準中收載的有關物質方法,對供應商變更前后的原料藥進行有機雜質譜對比確認。結果變更前后有機雜質一致(表3),并按藥典標準對各雜質進行了確認(圖2和圖3)。其中,供應商變更前,3批(批號分別為20AD219,20AD230,20AD241)原料藥有關物質I于254nm和365nm波長處檢測均符合規定。
殘留溶劑:根據供應商變更后原料藥的工藝流程,確定可能引入的殘留溶劑,并對原料藥中殘留溶劑及供應商B生產的多批次原料藥進行研究。結果供應商變更后,4批(批號分別為C-032007004,C-032103015,C-032103016,C-032104007)原料藥中均未檢出殘留溶劑乙醇、乙酸乙酯、苯、甲苯、N,N-二甲基甲酰胺、冰醋酸,表明其生產過程中殘留溶劑控制較好。
致突變雜質:根據ICH M7指南及供應商原料藥的工藝流程,變更供應商后對致突變雜質進行研究。依據ICH M7(R1)指南,按毒理學的關注閾值(TTC)的可攝入量為1.5g/d進行計算,苯磺酸氨氯地平片每日最大劑量為10mg,苯磺酸甲酯、苯磺酸乙酯、3-氨基巴豆酸甲酯的限度分別為75×10-6,75×10-6,50×10-6。結果供應商變更后,4批(批號分別為C-032007004,C-032103015,C-032103016,C-032104007)原料藥中均未檢出苯磺酸甲酯、苯磺酸乙酯、3-氨基巴豆酸甲酯,表明原料藥中致突變雜質控制較好。
元素雜質:根據ICH Q3D指導原則及原料藥合成路線,對供應商B提供的原料藥進行元素雜質研究,因供應商B在原料藥生產過程中未使用金屬催化劑,故僅檢測1類及2A類元素雜質。按ICH Q3D(R)元素雜質指導原則,釩(V)、鈷(Co)、鎳(Ni)、砷(As)、鎘(Cd)、汞(Hg)、鉛(Pb)的限度分別為不超過10000×10-6,5000×10-6,20000×10-6,1500×10-6,500×10-6,3000×10-6,500×10-6。苯磺酸氨氯地平片每日最大劑量為10mg,計算原料藥中上述元素雜質的限度。結果供應商變更后,原料藥中元素雜質含量均符合標準。詳見表4。
2.2 制劑
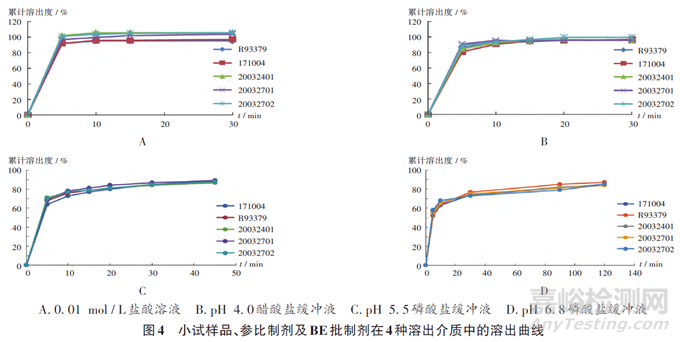
小試研究:采用供應商B提供的原料藥進行小試研究,按原處方工藝制備3批(批號分別為20032401,20032701,20032702)小試樣品。同時,依據《已上市化學藥品藥學變更研究技術指導原則(試行)》中第六項“變更制劑所用原料藥的供應商”中所需研究驗證工作中“變更前后樣品的溶出曲線、關鍵理化性質應保持一致”等規定進行體外釋放研究。參考原國家食品藥品監督管理總局發布的《普通口服固體制劑溶出度試驗技術指導原則》(2015年第3號)、《普通口服固體參比制劑選擇和確定指導原則》(2016年第61號),比較3批小試樣品、參比制劑(批號為R93379)及BE批(批號為171004)樣品在0.01mol/L鹽酸溶液、pH4.0醋酸鹽緩沖液、pH5.5磷酸鹽緩沖液、pH6.8磷酸鹽緩沖液中的溶出曲線。結果供應商變更后,小試樣品在4種溶出介質中的溶出與參比制劑及BE批制劑一致,表明原料藥供應商變更后,生產的小試樣品檢測結果均符合質量標準。詳見圖4。
A. 0. 01 mol / L hydrochloric acid solution B. pH 4. 0 acetate buffer C. pH 5. 5 phosphate buffer D. pH 6. 8 phosphate buffer
Fig. 4 Dissolution profiles of small test sample,reference preparation,and BE batch preparation in four dissolution media
工藝驗證:原料藥供應商變更前后,制劑的生產信息(生產商、批量、批處方、生產工藝、工藝流程圖、生產設備、關鍵工藝步驟、關鍵工藝參數、中間體控制等)一致,考察變更前后制劑的關鍵理化性質和溶出曲線。參考國家藥品監督管理局標準YBH06412019,考察有關物質、含量均勻度、溶出度、含量。其中,有關物質雜質D、其他單個雜質、其他總雜質的含量分別應不超過0.2%,0.2%,0.5%;含量均勻度應不超過15.0%;溶出度應不低于標示量的80%;按氨氯地平(C20H25ClN2O5)計算,含量應為標示量的95.0%~105.0%。結果見圖5和圖6,表明原料藥供應商變更后,生產的制劑質量標準不低于變更前。
3、討論
由粒度及晶型XRD圖譜可知,供應商變更前后的原料藥關鍵理化性質一致;對變更前后原料藥的合成路線及雜質譜進行對比分析可知,變更前后雜質譜一致,且采用各國藥典標準中收載的有關物質檢測方法進行檢測,結果顯示,變更后的雜質檢出個數及雜質檢出量均低于變更前;對供應商B提供的原料藥殘留溶劑、致突變雜質、元素雜質進行研究可知,因合成工藝不同,其殘留溶劑及元素雜質與供應商A提供的原料藥有所不同,但可通過相應研究進行控制,致突變雜質均未檢出,初步表明變更后供應商B提供的原料藥優于或等同于變更前的原料藥。采用供應商B提供的原料藥進行小試研究,小試樣品各項檢測結果均符合質量標準規定,在不同介質中的溶出曲線與BE批及參比制劑均基本一致,表明原料藥供應商可替換。同時,進行3批工藝驗證,并進行質量檢測及溶出曲線研究,結果顯示,原料藥供應商變更前后,制劑的性狀、含量、含量均勻度、溶出度、有關物質均一致,在4種溶出介質(0.01mol/L鹽酸溶液、pH4.0醋酸鹽緩沖液、pH5.5磷酸鹽緩沖液、pH6.8磷酸鹽緩沖液)中的溶出曲線均一致,表明用供應商B提供的原料藥生產的苯磺酸氨氯地平片與變更前質量一致。
以苯磺酸氨氯地平片變更原料藥供應商為例,初步建立了固體口服制劑改變制劑藥物活性成分供應商的基本流程。第一步,進行原料藥質量研究(如粒度、晶型、有機雜質、殘留溶劑、致突變雜質、元素雜質),并保證原料藥質量基本一致;第二步,進行制劑小試研究,并進行體外釋放試驗,保證變更前后小試樣品與參比制劑及BE批相似;第三步,制備3批樣品進行制劑工藝驗證,按相關質量標準進行檢測,保證變更后制劑質量不低于變更前,并通過原料藥質量研究及成品檢測研究過程證明流程的科學性與合理性。
參考文獻:詳見《中國藥業》2023年11月5日 第32卷第21期