摘 要 Abstract
藥品監(jiān)管質(zhì)量管理規(guī)范(GRP)體系標(biāo)準(zhǔn)和流程建設(shè)研究,對(duì)推進(jìn)監(jiān)管業(yè)務(wù)流程優(yōu)化,實(shí)現(xiàn)全生命周期管理,對(duì)標(biāo)國(guó)際、對(duì)標(biāo)產(chǎn)業(yè)、對(duì)標(biāo)監(jiān)管,實(shí)現(xiàn)中國(guó)式藥品監(jiān)管現(xiàn)代化發(fā)展具有重要意義。通過(guò)對(duì)GRP 體系標(biāo)準(zhǔn)和流程建設(shè)的相關(guān)問(wèn)題進(jìn)行研究,并采用社會(huì)網(wǎng)絡(luò)分析方法(SNA)對(duì)省級(jí)“十四五”規(guī)劃的重點(diǎn)任務(wù)進(jìn)行管理體系分析,本文提出國(guó)家、省和市縣3 級(jí)崗位編制GRP 體系標(biāo)準(zhǔn)(8 項(xiàng)管理體系)的建設(shè)框架,以及提出數(shù)字化監(jiān)管、屬地責(zé)任考評(píng)、國(guó)際互認(rèn)協(xié)議相融合和試點(diǎn)實(shí)踐等政策性建議。
The construction standards and processes of the Good Regulatory Practice (GRP) are effective in promoting the optimization of regulatory business processes, achieving full life cycle management, benchmarking international practices,industry standards and regulatory resources. It plays a crucial role in achieving Chinese-style modernization development in drug regulation. This study focuses on the relevant issues of GRP standards and process construction, and utilizes the Social Network Analysis (SNA) method to analyze the management system of key tasks in the provincial 14th Five Year Plan. The article proposes a construction framework for GRP standards system (consisting of 8 management systems) at the national, provincial, and city/county levels. Additionally, policy recommendations are provided, including digital supervision, territorial responsibility assessment, integration of international mutual recognition agreements, and demonstration practices.
關(guān)鍵詞 Key words
藥品監(jiān)管質(zhì)量管理規(guī)范(GRP);管理體系;標(biāo)準(zhǔn)和流程;政策性建議
Good Regulatory Practice (GRP); management system; standard and process; policy recommendations
世界衛(wèi)生組織(WHO) 于2021 年4 月正式發(fā)布《藥品監(jiān)管質(zhì)量管理規(guī)范》(GRP),提出九大原則,要求監(jiān)管體系具有合法性、公平性、一致性、均衡性、靈活性、有效性、高效性、清晰性和透明性,有助于增強(qiáng)政府部門(mén)執(zhí)行力和公信力、提升藥品事中事后監(jiān)管能力、推進(jìn)醫(yī)藥產(chǎn)業(yè)轉(zhuǎn)型升級(jí)和推動(dòng)監(jiān)管數(shù)字化轉(zhuǎn)型。建立和完善我國(guó)GRP 體系標(biāo)準(zhǔn)和流程,對(duì)提升我國(guó)藥品監(jiān)管體系和能力現(xiàn)代化進(jìn)程具有重要意義。2021 年5 月發(fā)布的《WHO醫(yī)療產(chǎn)品國(guó)家監(jiān)管體系評(píng)估全球基準(zhǔn)工具(GBT)》, 提出國(guó)家監(jiān)管體系(RS)、注冊(cè)和上市許可(MA)、藥物警戒(VL) 等9 個(gè)板塊 268 項(xiàng)指標(biāo),也為我國(guó)GRP 建設(shè)提供制度移植基礎(chǔ)。
2019 年修訂的《藥品管理法》提出“審評(píng)、檢驗(yàn)、核查、監(jiān)測(cè)與評(píng)價(jià)”等藥品專(zhuān)業(yè)技術(shù)機(jī)構(gòu),為藥品監(jiān)管工作提供技術(shù)支撐。2021 年5 月,《國(guó)務(wù)院辦公廳關(guān)于全面加強(qiáng)藥品監(jiān)管能力建設(shè)的實(shí)施意見(jiàn)》提出了提高技術(shù)審評(píng)能力、完善檢查執(zhí)法體系、強(qiáng)化監(jiān)管部門(mén)協(xié)同、提高檢驗(yàn)檢測(cè)能力、建設(shè)國(guó)家藥物警戒體系等18 項(xiàng)重點(diǎn)任務(wù);2021 年12 月,《“十四五”國(guó)家藥品安全及促進(jìn)高質(zhì)量發(fā)展規(guī)劃》提出“完善藥品安全治理體系”和“積極參與全球藥品安全治理”,以及持續(xù)深化審評(píng)審批制度改革、加強(qiáng)智慧監(jiān)管體系和能力建設(shè)、建立健全藥物警戒體系等主要任務(wù),彰顯了我國(guó)政府對(duì)提升國(guó)家藥品監(jiān)管能力的決心。GRP 與GMP、GSP、GCP、GVP 等制度框架相并列,為我國(guó)藥品質(zhì)量保障制度奠定基礎(chǔ)。
1、 我國(guó)的GRP 建設(shè)與考核概述
GRP 和《醫(yī)藥產(chǎn)品監(jiān)管互信質(zhì)量管理規(guī)范》(GRelP)是WHO 促進(jìn)全球監(jiān)管合作、透明、可靠的國(guó)際互認(rèn)協(xié)議內(nèi)容之一,以凸顯成員國(guó)藥品監(jiān)管體系的合規(guī)和有效。當(dāng)前,我國(guó)已運(yùn)用WHO 發(fā)布的全球基準(zhǔn)評(píng)估工具(GBT)推進(jìn)實(shí)施了疫苗國(guó)家監(jiān)管體系評(píng)估。
1.1 GRP 建設(shè)原則和框架概述
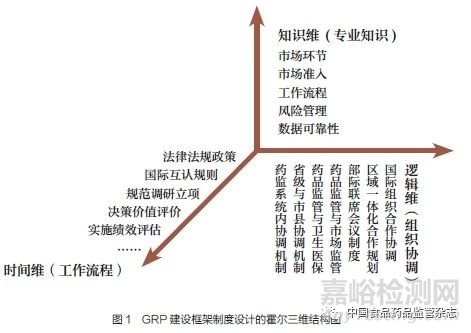
依據(jù)WHO 提出的GRP建設(shè)九大原則和相應(yīng)建設(shè)框架,GRP 體系標(biāo)準(zhǔn)和流程的建設(shè),具有促進(jìn)產(chǎn)業(yè)高質(zhì)量發(fā)展、消除貿(mào)易壁壘、優(yōu)化監(jiān)管資源配置等重大意義。GRP 建設(shè)的目標(biāo):一是在于監(jiān)管部門(mén)合作、協(xié)調(diào)、透明化、信息共享和國(guó)際互認(rèn)等;二是在于消除國(guó)際醫(yī)藥市場(chǎng)中的技術(shù)性貿(mào)易壁壘。基于霍爾三維結(jié)構(gòu)通過(guò)時(shí)間維、邏輯維、知識(shí)維,為解決大型復(fù)雜社會(huì)系統(tǒng)的規(guī)劃、組織、管理問(wèn)題提供了一種系統(tǒng)分析方法。因此,提出基于國(guó)家互認(rèn)協(xié)議(ICH、PIC/S、IPRP)、區(qū)域一體化規(guī)劃、國(guó)家部際聯(lián)席會(huì)議制度、市場(chǎng)監(jiān)管(信用、大數(shù)據(jù)、網(wǎng)格化、“雙隨機(jī)、一公開(kāi)”)的霍爾三維結(jié)構(gòu)GRP系統(tǒng)框架(圖1):邏輯維(組織協(xié)調(diào))、時(shí)間維(工作流程)、知識(shí)維(專(zhuān)業(yè)知識(shí))。
1.2 GRP 合規(guī)管理與責(zé)任考評(píng)
藥品監(jiān)管責(zé)任考評(píng)是一項(xiàng)全面考量的系統(tǒng)工程,可以從法律法規(guī)、監(jiān)管內(nèi)容與效果、社會(huì)效果與國(guó)際化等角度進(jìn)行評(píng)價(jià)。公眾安全用藥和合法權(quán)益的保障體系不僅僅是要求醫(yī)藥企業(yè)合規(guī),同時(shí)需要藥品監(jiān)管體系具備合規(guī)性和有效性,二者缺一不可。相對(duì)于醫(yī)藥企業(yè)的合規(guī)管理要求,對(duì)藥品監(jiān)管部門(mén)的合規(guī)性和有效性要求,也將是藥品供應(yīng)保障、安全有效質(zhì)量可控的不可或缺方面。正如醫(yī)藥產(chǎn)品的合格是建立在檢驗(yàn)設(shè)備合格基礎(chǔ)之上一樣,企業(yè)質(zhì)量體系是否合規(guī),也必然是建立在監(jiān)管部門(mén)GRP 合規(guī)基礎(chǔ)之上。
2、 GRP 體系標(biāo)準(zhǔn)和流程建設(shè)現(xiàn)狀
GRP 體系標(biāo)準(zhǔn)和流程建設(shè)內(nèi)容,一是對(duì)當(dāng)前藥品監(jiān)管業(yè)務(wù)流程的優(yōu)化,二是針對(duì)政府監(jiān)管行為的合規(guī)管理。首先,GRP 的體系流程,主要包括國(guó)家層面的注冊(cè)上市、省級(jí)層面的生產(chǎn)許可和市縣層面的經(jīng)營(yíng)許可,即研發(fā)、生產(chǎn)和經(jīng)營(yíng)環(huán)節(jié),并實(shí)施監(jiān)督性抽檢、質(zhì)量體系檢查和藥品不良反應(yīng)監(jiān)測(cè)評(píng)價(jià)等。其次,當(dāng)前地方藥品監(jiān)管工作已經(jīng)運(yùn)用WHO發(fā)布的GBT 對(duì)疫苗國(guó)家監(jiān)管體系實(shí)施評(píng)估,且多數(shù)地方(核查中心)完成了ISO 質(zhì)量體系認(rèn)證評(píng)估。
2.1 我國(guó)藥品監(jiān)管體系標(biāo)準(zhǔn)和流程建設(shè)進(jìn)程
2.1.1 對(duì)標(biāo)國(guó)際與國(guó)家監(jiān)管體系評(píng)估工作
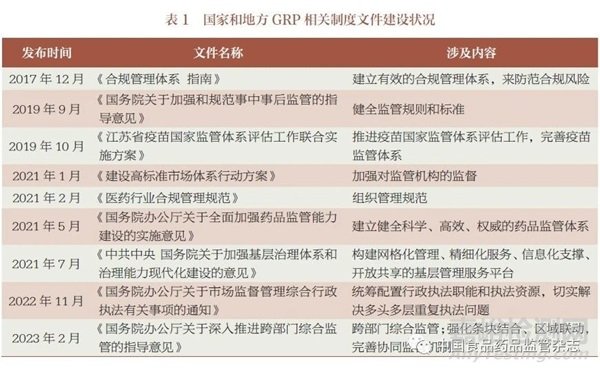
根據(jù)WHO 疫苗國(guó)家監(jiān)管體系能力建設(shè)要求和國(guó)家市場(chǎng)體系行動(dòng)方案, 國(guó)家和地方藥品監(jiān)管部門(mén)已在推進(jìn)實(shí)施WHO組織的疫苗國(guó)家監(jiān)管體系評(píng)估工作, 進(jìn)一步提升了我國(guó)疫苗監(jiān)管體系和監(jiān)管能力建設(shè)水平(表1)。
2.1.2 GRP 的地方性實(shí)踐
近年來(lái),部分地方藥品監(jiān)管部門(mén)進(jìn)行了GRP 的地方性實(shí)踐探索,部分地方藥品審核查驗(yàn)中心進(jìn)行了ISO 9001 質(zhì)量體系認(rèn)證工作(表2)。在地方監(jiān)管體系機(jī)構(gòu)改革和制度變遷方面,2020年11 月沈陽(yáng)將藥品經(jīng)營(yíng)許可證、醫(yī)療器械經(jīng)營(yíng)許可證、食品經(jīng)營(yíng)許可證、第二類(lèi)醫(yī)療器械經(jīng)營(yíng)備案憑證等許可證合并為一張載明相關(guān)行政許可信息的行業(yè)綜合許可證;山東、廣東和北京等省市已經(jīng)將醫(yī)療器械許可、藥品許可,甚至是化妝品許可合并為統(tǒng)一行政許可,均在探索城市公共管理一致性的機(jī)構(gòu)改革。
2.2 GRP 體系標(biāo)準(zhǔn)和流程建設(shè)的問(wèn)題
2.2.1 全生命周期管理與分段監(jiān)管之間矛盾
目前國(guó)內(nèi)藥品監(jiān)管工作主要是采取分段監(jiān)管方式,并逐步建立“產(chǎn)品主線+ 質(zhì)量體系”全鏈條模式推進(jìn)藥品全生命周期管理[1]。國(guó)家層面實(shí)施中央集權(quán)制的產(chǎn)品上市許可,以確立產(chǎn)品審評(píng)審批標(biāo)準(zhǔn)的統(tǒng)一權(quán)威;但從另一個(gè)視角看,卻增加了藥品分段監(jiān)管與全生命周期管理之間的矛盾。目前亟需解決的問(wèn)題,包括職權(quán)劃分、專(zhuān)業(yè)化水平、資源配置和政企風(fēng)險(xiǎn)溝通等方面。基于以上的實(shí)踐經(jīng)驗(yàn)和相關(guān)問(wèn)題,提出國(guó)家、省、市縣三級(jí)層面的GRP 體系流程建設(shè)方案( 圖2), 為我國(guó)GRP 體系標(biāo)準(zhǔn)編制提供參考。
2.2.2 GRP 體系標(biāo)準(zhǔn)和流程建設(shè)的核心問(wèn)題
當(dāng)前,市場(chǎng)監(jiān)管屬地化管理中省級(jí)對(duì)市縣級(jí)是屬地管理模式,市縣級(jí)對(duì)基層市場(chǎng)監(jiān)管所是垂直管理方式;藥品監(jiān)管歸口于市場(chǎng)監(jiān)管部門(mén),大部分省級(jí)藥品監(jiān)管部門(mén)組建了稽查局和(或)區(qū)域性藥品核查中心,強(qiáng)化了藥品監(jiān)管模式中“條”“塊”的屬地化和垂直化監(jiān)管相結(jié)合的體系和能力(圖3)。GRP 體系標(biāo)準(zhǔn)和流程建設(shè)中需要適應(yīng)藥品監(jiān)管業(yè)務(wù)流程優(yōu)化和“條”“塊”模式重構(gòu)的要求。首先,協(xié)調(diào)機(jī)制中的國(guó)際互認(rèn)協(xié)議、部際聯(lián)席會(huì)議、區(qū)域一體化規(guī)劃、省市級(jí)市場(chǎng)監(jiān)管4 個(gè)層級(jí),以及藥品監(jiān)管系統(tǒng)內(nèi)部協(xié)調(diào)等發(fā)生變化,亟需采用監(jiān)管體系標(biāo)準(zhǔn)和流程建設(shè)推進(jìn)藥品監(jiān)管工作的規(guī)范化和權(quán)威性。其次,藥品監(jiān)管的真正意義和價(jià)值判斷方面,有專(zhuān)家提出GRP 體系標(biāo)準(zhǔn)和流程建設(shè),應(yīng)是基于提升監(jiān)管形象和推進(jìn)產(chǎn)業(yè)高質(zhì)量發(fā)展的目標(biāo);也有專(zhuān)家提出生物醫(yī)藥產(chǎn)業(yè)發(fā)展的多部門(mén)政策的悖論現(xiàn)象,即生物醫(yī)藥發(fā)展的政策合力相互抵消并不能有效發(fā)揮的現(xiàn)象。
3、GRP 體系流程分析
采用國(guó)家和地方藥品監(jiān)管工作“十四五”主要任務(wù)作為GRP體系標(biāo)準(zhǔn)和流程建設(shè)的基礎(chǔ),研判和探索適合藥品監(jiān)管體系規(guī)范的范本,進(jìn)而推進(jìn)藥品監(jiān)管體系能力現(xiàn)代化和產(chǎn)業(yè)高質(zhì)量發(fā)展進(jìn)程,促進(jìn)國(guó)家和地方藥品監(jiān)管體系的合規(guī)而有效。
3.1 基于“十四五”規(guī)劃GRP 體系流程概況
采用“十四五”規(guī)劃重點(diǎn)任務(wù)對(duì)GRP 體系流程進(jìn)行分析,可以最大限度適應(yīng)省級(jí)藥品監(jiān)管部門(mén)的GRP 體系建設(shè)目標(biāo)和趨勢(shì)預(yù)判。選擇28 個(gè)省級(jí)“十四五”規(guī)劃中的主要任務(wù),構(gòu)建了省市和主要任務(wù)的詞匯社會(huì)網(wǎng)絡(luò)圖,以及主要任務(wù)的關(guān)鍵詞匯和重要詞匯的社會(huì)網(wǎng)絡(luò)圖,上海、北京、廣東等省市“十四五”規(guī)劃主要任務(wù)聚類(lèi)為“技術(shù)支撐”“社會(huì)共治”“智慧監(jiān)管”和“風(fēng)險(xiǎn)防控”等高頻詞匯(圖4、圖5)。根據(jù)重點(diǎn)詞匯的聚類(lèi)結(jié)果遴選了風(fēng)險(xiǎn)防控、應(yīng)急管理、監(jiān)管體系、法規(guī)標(biāo)準(zhǔn)、技術(shù)支撐、智慧監(jiān)管、社會(huì)共治、人才隊(duì)伍的8 個(gè)重點(diǎn)任務(wù)體系,并分別對(duì)8 個(gè)任務(wù)體系做進(jìn)一步分析,提出業(yè)務(wù)流程設(shè)計(jì)和標(biāo)準(zhǔn)建設(shè)路徑。按照系統(tǒng)工程“硬件”“軟件”“斡件(orgware)”分析方法,在這8項(xiàng)管理體系中,技術(shù)支撐、人才隊(duì)伍和監(jiān)管體系中的組織框架應(yīng)屬于“硬件”,風(fēng)險(xiǎn)防控、法規(guī)標(biāo)準(zhǔn)、應(yīng)急管理和監(jiān)管體系中的檢查、稽查應(yīng)歸口于“軟件”制度性安排,“斡件”是協(xié)調(diào)硬件和軟件的技術(shù),可包括社會(huì)共治、智慧監(jiān)管和監(jiān)管體系中的協(xié)調(diào)合作等。基于當(dāng)前省級(jí)以下藥品監(jiān)管“塊”狀屬地管理特征,構(gòu)建協(xié)調(diào)于“硬件”“軟件”的“斡件”,即社會(huì)共治、智慧監(jiān)管等協(xié)調(diào)合作機(jī)制更為重要,是特別有助于當(dāng)前屬地管理所強(qiáng)調(diào)的“誰(shuí)主管,誰(shuí)負(fù)責(zé)”行政管理的有效工作流程優(yōu)化措施之一。

當(dāng)前,國(guó)家藥品監(jiān)管部門(mén)是以產(chǎn)品為主線的監(jiān)管體制,包括檢驗(yàn)、監(jiān)測(cè)、審評(píng),需要將上市后藥品風(fēng)險(xiǎn)發(fā)現(xiàn)機(jī)制與上市前審評(píng)審批相融合,實(shí)現(xiàn)產(chǎn)品全生命周期監(jiān)管的第一次融合。從風(fēng)險(xiǎn)管理視角看,政務(wù)信息公開(kāi)、投訴舉報(bào)、輿情監(jiān)測(cè)、藥品廣告、科普宣傳等屬于風(fēng)險(xiǎn)溝通,實(shí)現(xiàn)二次融合;風(fēng)險(xiǎn)防控、應(yīng)急管理(處置)和藥物警戒屬于藥品安全風(fēng)險(xiǎn)的預(yù)警處置;智慧監(jiān)管屬于技術(shù)支撐、信息化數(shù)據(jù)化應(yīng)用場(chǎng)景相結(jié)合,屬于藥品安全風(fēng)險(xiǎn)的數(shù)據(jù)流管理范疇,實(shí)現(xiàn)第三次融合。因此,藥品安全“十四五”規(guī)劃中的8 項(xiàng)體系,應(yīng)從風(fēng)險(xiǎn)管理、風(fēng)險(xiǎn)溝通等方面進(jìn)行制度設(shè)計(jì),以適應(yīng)《藥品管理法》確立的“風(fēng)險(xiǎn)管理、全程管控、社會(huì)共治”原則。
3.2 基于市場(chǎng)監(jiān)管環(huán)節(jié)的體系流程分析
地方性市場(chǎng)監(jiān)管實(shí)踐和相關(guān)政策文件,為GRP 體系流程分析提供了可借鑒的制度和經(jīng)驗(yàn)。2022 年5 月,吉林省市場(chǎng)監(jiān)督管理廳印發(fā)《關(guān)于在全省市場(chǎng)監(jiān)管系統(tǒng)推行“五段式”行政執(zhí)法模式的指導(dǎo)意見(jiàn)(試行)》,分別為法規(guī)宣傳、教育引導(dǎo)、告誡說(shuō)理、行政處罰、監(jiān)督整改5 個(gè)階段,分步驟漸進(jìn)式的工作過(guò)程;提出普遍適用原則、首違不罰原則、過(guò)罰相當(dāng)原則、自我規(guī)范原則的4 項(xiàng)原則,清單化、圖標(biāo)化、手冊(cè)化、模板化、機(jī)制化的“五化”工作機(jī)制。
《國(guó)務(wù)院辦公廳關(guān)于全面加強(qiáng)藥品監(jiān)管能力建設(shè)的實(shí)施意見(jiàn)》明確“對(duì)標(biāo)國(guó)際通行規(guī)則”“持續(xù)推進(jìn)監(jiān)管創(chuàng)新”“提升藥品監(jiān)管工作科學(xué)化、法治化、國(guó)際化、現(xiàn)代化水平”等政策要求,并提出了重點(diǎn)任務(wù),包括法律法規(guī)體系、檢查執(zhí)法體系、藥物警戒體系、應(yīng)急管理體系和信息化追溯體系等18 項(xiàng)。
4、 GRP 體系標(biāo)準(zhǔn)編制
根據(jù)“ 十四五” 規(guī)劃中對(duì)GRP 體系流程分析結(jié)果,確立風(fēng)險(xiǎn)防控、應(yīng)急管理、法律標(biāo)準(zhǔn)、智慧監(jiān)管等8 方面體系,進(jìn)而實(shí)施GRP 體系標(biāo)準(zhǔn)編制方案。GRP 體系標(biāo)準(zhǔn)編制應(yīng)遵循合規(guī)性、規(guī)范性、適用性和過(guò)程原則。GRP 體系標(biāo)準(zhǔn)編制,一方面根據(jù)WHO 相關(guān)的GRP 體系和GBT工具相關(guān)指標(biāo),另一方面也需要與ISO 9000 質(zhì)量體系標(biāo)準(zhǔn)相一致。
4.1 GRP 體系標(biāo)準(zhǔn)編制的制度文件
根據(jù)藥品監(jiān)管工作的協(xié)調(diào)機(jī)制,包括國(guó)際組織、政府部門(mén)、區(qū)域一體化、省級(jí)藥監(jiān)市場(chǎng)監(jiān)管4 個(gè)層級(jí),以及藥品監(jiān)管系統(tǒng)內(nèi)部協(xié)調(diào)機(jī)制等制度框架,GRP 體系標(biāo)準(zhǔn)編制的制度文件,包括國(guó)際互認(rèn)協(xié)議、部際聯(lián)席會(huì)議、區(qū)域一體化規(guī)劃、省市級(jí)市場(chǎng)監(jiān)管工作制度和內(nèi)部協(xié)調(diào)制度文件等(表3)。
GRP 體系標(biāo)準(zhǔn)編制的制度文件,還包括管理體系標(biāo)準(zhǔn),例如《合規(guī)管理體系 要求及使用指南》(GB/T 35770—2022)、《標(biāo)準(zhǔn)編寫(xiě)規(guī)則 第11 部分:管理體系標(biāo)準(zhǔn)》(GB/T 20001.11—2022)、《同線同標(biāo)同質(zhì) 檢驗(yàn)檢疫機(jī)構(gòu)監(jiān)管指南》(RB/T 155—2017)等,以及《“雙隨機(jī)、一公開(kāi)”監(jiān)管工作規(guī)范》(DB22/T 3218—2021)等技術(shù)標(biāo)準(zhǔn)文件(表4)。
4.2 GRP 體系標(biāo)準(zhǔn)編制的省級(jí)部門(mén)“兩品一械”組織結(jié)構(gòu)
2018 年,中共中央印發(fā)《深化黨和國(guó)家機(jī)構(gòu)改革方案》,藥品經(jīng)營(yíng)銷(xiāo)售等行為的監(jiān)管由市(縣)市場(chǎng)監(jiān)管部門(mén)統(tǒng)一承擔(dān),各省(自治區(qū)、直轄市)形成了“大市場(chǎng)、專(zhuān)藥品”的監(jiān)管新格局[2]。采用社會(huì)網(wǎng)絡(luò)分析方法(SNA)探索了30 個(gè)省級(jí)藥品監(jiān)管部門(mén)“兩品一械”組織結(jié)構(gòu)情況,SNA 結(jié)果顯示:藥品注冊(cè)處、藥品生產(chǎn)處、藥品流通處,仍為地方藥品監(jiān)管部門(mén)的主要業(yè)務(wù)處室(圖6),機(jī)構(gòu)改革制度變遷具有慣性特征;同時(shí),各地藥品監(jiān)管處室名稱(chēng)和職能有所不同,出現(xiàn)“職責(zé)異構(gòu)”現(xiàn)象,增加了企業(yè)與政府風(fēng)險(xiǎn)溝通成本。藥品注冊(cè)處、藥品生產(chǎn)處、藥品流通處和中藥民族藥處成為省級(jí)藥品監(jiān)管部門(mén)的重要設(shè)置部門(mén),藥品經(jīng)營(yíng)處機(jī)構(gòu)設(shè)置數(shù)量明顯少于藥品生產(chǎn)處、藥品注冊(cè)處(圖7)。
4.3 國(guó)家、省、市縣三級(jí)監(jiān)管崗位職責(zé)
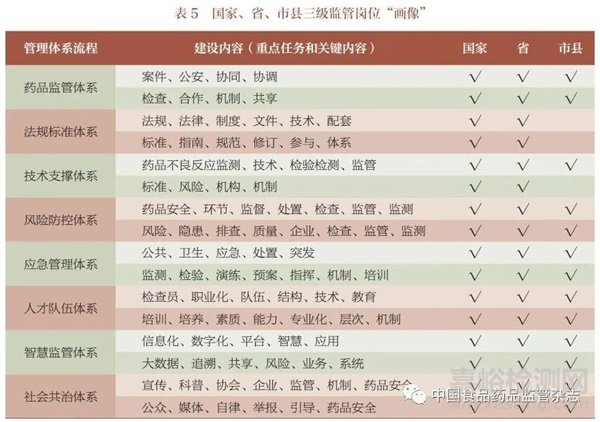
當(dāng)前,地方藥品監(jiān)管工作實(shí)行屬地化管理方式,并且省級(jí)以下藥品監(jiān)管工作歸口市場(chǎng)監(jiān)管部門(mén)。因此,采用國(guó)家、省、市縣三級(jí)管理崗位,8 方面管理體系流程,設(shè)置GRP 體系流程,實(shí)施藥品監(jiān)管體系中的國(guó)家、省、市縣三級(jí)監(jiān)管崗位“畫(huà)像”(表5)。
5、 GRP 體系標(biāo)準(zhǔn)和流程建設(shè)的政策性建議
國(guó)家、省、市縣三級(jí)的GRP體系標(biāo)準(zhǔn)建設(shè),一是實(shí)施WHO、ICH、PIC/S 等GRP 制度移植。二是基于“四個(gè)最嚴(yán)”“創(chuàng)新發(fā)展”“營(yíng)商環(huán)境”等背景,探索4個(gè)協(xié)調(diào)層級(jí)(國(guó)際互認(rèn)、區(qū)域一體化、部際聯(lián)席會(huì)議、地方部門(mén)間)和監(jiān)管工作流程等相結(jié)合的方式方法。三是采用數(shù)字化轉(zhuǎn)型、屬地責(zé)任落實(shí)、多層級(jí)協(xié)調(diào)機(jī)制等路徑,推進(jìn)我國(guó)藥品監(jiān)管體制機(jī)制改革進(jìn)程。
5.1 全流程全鏈條的GRP 數(shù)字化監(jiān)管
以藥品全生命周期藥物警戒體系為全流程全鏈條GRP 數(shù)字化監(jiān)管的建設(shè)主線。構(gòu)建藥品全生命周期藥物警戒體系,一方面是以信息化和數(shù)字化手段為支撐條件,另一方面是以監(jiān)管業(yè)務(wù)流程的規(guī)范化和標(biāo)準(zhǔn)化為改造方向,即通過(guò)監(jiān)管規(guī)則的流程化和標(biāo)準(zhǔn)化,推動(dòng)藥品監(jiān)管方式轉(zhuǎn)型升級(jí);將合規(guī)而有效的地方藥品監(jiān)管體系,與醫(yī)藥企業(yè)合規(guī)而高質(zhì)量發(fā)展進(jìn)行對(duì)標(biāo)和(或)比對(duì),彰顯公眾的健康和合法權(quán)益的政企保障體系是有效和值得信賴(lài)的。智慧監(jiān)管的發(fā)展方向是,GRP 流程和標(biāo)準(zhǔn)化是隨時(shí)間越來(lái)越固化,并逐步滲透到信息系統(tǒng)或硬件之中。因此,根據(jù)產(chǎn)品上市、質(zhì)量體系和市場(chǎng)主體分類(lèi)方法,對(duì)國(guó)家、省、市縣藥品監(jiān)管體制機(jī)制進(jìn)行多維度分析,例如依據(jù)產(chǎn)品上市的審評(píng)審批、產(chǎn)品檢驗(yàn)檢測(cè)、產(chǎn)品藥物警戒/ 不良反應(yīng)監(jiān)測(cè)的產(chǎn)品數(shù)據(jù)流,形成監(jiān)管數(shù)字化轉(zhuǎn)型升級(jí)核心要素。合規(guī)而有效的地方藥品監(jiān)管體系與企業(yè)合規(guī)而高質(zhì)量的質(zhì)量體系相銜接,構(gòu)建藥品安全質(zhì)量保障體系的區(qū)塊鏈,并以智能合約方式,形成全流程全鏈條的GRP 數(shù)字化監(jiān)管新模式。
5.2 開(kāi)展GRP 體系標(biāo)準(zhǔn)的屬地責(zé)任考核評(píng)議
當(dāng)前,我國(guó)藥品監(jiān)管體制突出表現(xiàn)為屬地市場(chǎng)監(jiān)管的“塊”,屬地管理是以管理范圍為主要?jiǎng)澐謽?biāo)準(zhǔn),要求事發(fā)地政府在問(wèn)題發(fā)生時(shí), 首先承擔(dān)起管理職責(zé)并督促問(wèn)題的后續(xù)解決[3]。基于GRP 體系標(biāo)準(zhǔn)的屬地責(zé)任考評(píng)體系,可以包括定期檢查、抽查審計(jì)、公眾評(píng)價(jià)等方式實(shí)施過(guò)程監(jiān)督和結(jié)果監(jiān)督。因此,將GRP 體系標(biāo)準(zhǔn)和流程建設(shè)嵌入國(guó)家、省、市縣三層級(jí)的藥品監(jiān)管各層級(jí)監(jiān)管業(yè)務(wù)之中。強(qiáng)化省、市縣兩級(jí)監(jiān)管目標(biāo)的統(tǒng)一性,以GRP 制度文件為依據(jù),強(qiáng)化基層監(jiān)管行為的合規(guī)管理。借鑒GBT,全面評(píng)估藥品監(jiān)管能力,找差距、補(bǔ)短板,提升監(jiān)管效能。探索建立藥品安全治理綜合評(píng)價(jià)標(biāo)準(zhǔn)和藥品安全治理績(jī)效評(píng)價(jià)方法,綜合應(yīng)用多形式多維度績(jī)效評(píng)價(jià)手段,形成以目標(biāo)為引領(lǐng)、結(jié)果為導(dǎo)向、內(nèi)外部結(jié)合的治理效能評(píng)價(jià)體系,促進(jìn)藥品安全治理效能持續(xù)改進(jìn)。
5.3 GRP 標(biāo)準(zhǔn)與ISO、ICH 協(xié)議等相融合
GRP 標(biāo)準(zhǔn)與ISO、ICH 協(xié)議等相融合,助力提升藥品監(jiān)管體系對(duì)標(biāo)國(guó)際、對(duì)標(biāo)產(chǎn)業(yè)、對(duì)標(biāo)監(jiān)管資源的有效性。一是GRP為ISO 9001 質(zhì)量管理體系(GB/T 19001)、為藥品監(jiān)管的流程和標(biāo)準(zhǔn)化工作提供了指南。二是GRP 體系標(biāo)準(zhǔn)編制,可以借鑒ICH、PIC/S 等國(guó)際互認(rèn)文件指南中的具體技術(shù)要求與指引,如ICH 指南中質(zhì)量評(píng)價(jià)、PIC/S 中監(jiān)管環(huán)境等內(nèi)容,均可納入GRP體系標(biāo)準(zhǔn)與流程規(guī)范。三是GRP標(biāo)準(zhǔn)與ICH、PIC/S 指南的緊密融合,有利于不同國(guó)家和地區(qū)之間的國(guó)際互認(rèn)與協(xié)作。GRP 體系標(biāo)準(zhǔn)和流程建設(shè),建議國(guó)家、省、市縣三級(jí)管理崗位,8 方面管理體系流程,設(shè)置GRP 體系流程,實(shí)施三級(jí)崗位“畫(huà)像”;在GRP體系標(biāo)準(zhǔn)的框架結(jié)構(gòu)上,兼收并蓄I(lǐng)SO 質(zhì)量體系、WHO 互認(rèn)協(xié)議、ICH 互認(rèn)協(xié)議等, 與ISO、ICH、PIC/S 等國(guó)際互認(rèn)協(xié)議等相融合,適應(yīng)政府部門(mén)機(jī)構(gòu)改革、職能轉(zhuǎn)變和數(shù)字化轉(zhuǎn)型等制度變遷進(jìn)程中的客觀要求。
5.4 GRP 體系標(biāo)準(zhǔn)與流程優(yōu)化的試點(diǎn)實(shí)踐
醫(yī)藥科技創(chuàng)新活動(dòng)與新業(yè)態(tài)、新模式的出現(xiàn),以及醫(yī)藥產(chǎn)品結(jié)構(gòu)和治理結(jié)構(gòu)的復(fù)雜性問(wèn)題,迫切需要藥品監(jiān)管流程優(yōu)化和技術(shù)專(zhuān)業(yè)化分工的不斷深入。GRP 是藥品監(jiān)管工作“條”轉(zhuǎn)為“塊”進(jìn)程中監(jiān)管體系標(biāo)準(zhǔn)化的有效實(shí)踐活動(dòng)。調(diào)研中,有專(zhuān)家建議通過(guò)GRP 體系試點(diǎn)實(shí)踐工作,積累GRP 體系流程與標(biāo)準(zhǔn)化模式的實(shí)施經(jīng)驗(yàn),采用地方標(biāo)準(zhǔn)、國(guó)家標(biāo)準(zhǔn)或者國(guó)際互認(rèn)標(biāo)準(zhǔn)等形式,將GRP 體系標(biāo)準(zhǔn)和流程有效固化下來(lái),以驗(yàn)證地方藥品監(jiān)管體系的合規(guī)性和有效性,形成政府企業(yè)兩者均合規(guī)的公眾安全用藥和合法權(quán)益保障體系;并采用智慧平臺(tái)和監(jiān)管區(qū)塊鏈新模式推廣應(yīng)用GRP 體系標(biāo)準(zhǔn)與流程,助力提升國(guó)家和地方藥品監(jiān)管工作的高質(zhì)量發(fā)展和監(jiān)管合規(guī)有效性。
引用本文
胡駿.我國(guó)藥品監(jiān)管質(zhì)量管理規(guī)范(GRP)體系標(biāo)準(zhǔn)和流程建設(shè)研究[J].中國(guó)食品藥品監(jiān)管,2023(9):80-89.