a.BCS分類系統(tǒng)
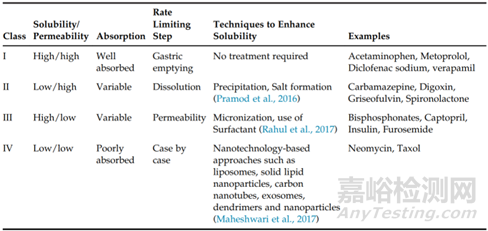
生物利用度(Bioavailability BA)是反映藥物活性成分吸收進(jìn)入體內(nèi)的程度和速度的指標(biāo)。為了仿制藥質(zhì)量和療效一致性評(píng)價(jià)中口服固體常釋制劑申請(qǐng)生物等效性(Bioequivalence)豁免,提出了生物藥劑學(xué)分類系統(tǒng),即BCS分類系統(tǒng),重點(diǎn)強(qiáng)調(diào)了藥物的溶解性和滲透性在藥物吸收過程中的重要作用。指導(dǎo)原則中重點(diǎn)強(qiáng)調(diào)了化合物在pH1.0—6.8范圍內(nèi)的水溶性介質(zhì)中溶解情況,如若單次給藥的最高劑量在上述pH范圍內(nèi)可完全溶解于250ml介質(zhì),表明化合物具有高溶解性;當(dāng)一個(gè)口服藥物采用質(zhì)量平衡測(cè)定的結(jié)果或是相對(duì)于靜脈注射的參照劑量,顯示在體內(nèi)的吸收程度≥85%以上(并且有證據(jù)證明藥物在胃腸道穩(wěn)定性良好),則可說明該藥物具有高滲透性。除了上述應(yīng)用,BCS分類系統(tǒng)在制藥行業(yè)也被廣泛應(yīng)用于在早期處方開發(fā)中對(duì)候選化合物進(jìn)行分類,因?yàn)锽CS還提供了一個(gè)框架來考慮可能影響體內(nèi)性能的關(guān)鍵因素(劑量、溶解度、滲透性和溶出)。這些因素的重要性比確定適合生物豁免的藥物產(chǎn)品更廣泛,因?yàn)樗鼈兺ㄟ^推斷還定義了決定體內(nèi)性能的關(guān)鍵質(zhì)量屬性(CQA)。
圖1.BCS分類系統(tǒng)圖示,根據(jù)藥物的滲透性和溶解性對(duì)藥物進(jìn)行分類。當(dāng)存在于最高濃度速釋制劑中的藥物量在胃腸道pH值(1.2-7.5)的可能范圍內(nèi)可溶于250毫升水中時(shí),化合物被定義為高溶解性。高滲透性化合物定義為吸收率為>90%或通過體外或體內(nèi)方法評(píng)估的滲透性等于或高于吸收率為90%的參考化合物的化合物。(來源于參考文獻(xiàn)1)
b.改良版本BCS分類系統(tǒng)-DCS分類系統(tǒng)
因?yàn)槿艹龆仍囼?yàn)的重要應(yīng)用是預(yù)測(cè)固體口服固體制劑的體內(nèi)性能。然而,通常用于質(zhì)量控制溶出度試驗(yàn)的簡(jiǎn)單緩沖水溶液并不代表胃腸道(GI)生理狀況的所有方面,通常最多只能提供與體內(nèi)數(shù)據(jù)的經(jīng)驗(yàn)相關(guān)性。預(yù)測(cè)近腸端管腔內(nèi)性能通常需要充分模擬胃和小腸近端區(qū)域的條件。所以溶解度測(cè)試不僅考慮藥物在水中的溶解度,還考慮在生物相關(guān)介質(zhì)中的溶解度,例如禁食狀態(tài)模擬腸液(FaSSIF)和使用含有膽鹽和卵磷脂粉末的相應(yīng)進(jìn)食狀態(tài)模擬介質(zhì)(FeSSIF)。這種基于生物相關(guān)溶解度可以進(jìn)一步改良BCS分類系統(tǒng),這對(duì)藥物發(fā)現(xiàn)和早期制劑供應(yīng)有意義。獲得空腸溶解度的估計(jì)值很重要,因?yàn)樵谛∧c上部,藥物溶解的液體體積達(dá)到最大值,并且這也是大多數(shù)速釋藥物被吸收的地方。人類空腹腸道溶解度的估計(jì)值(例如,通過使用FaSSIF)作為體內(nèi)溶解度的主要衡量標(biāo)準(zhǔn),可用于預(yù)測(cè)范圍人體吸收。
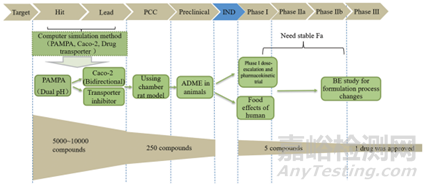
為了在開發(fā)的早期階段對(duì)藥物進(jìn)行分類,不僅改良了FDA對(duì)于溶解度的定義,而且還改良了對(duì)于滲透性的定義。我們可以看到很多公司使用基于例如Caco-2細(xì)胞通透性或甚至腸通透性的物理化學(xué)藥物預(yù)測(cè)因子來預(yù)測(cè)藥物吸收限制。在新藥研究的不同階段,可以采用不同的研究方法獲知藥物滲透性信息,以提高新藥開發(fā)效率,推進(jìn)新藥向前。新藥不同研究階段,常用滲透性預(yù)測(cè)方法見圖2。在新藥的藥物開發(fā)過程中,可以通過多種技術(shù)來評(píng)估滲透性。盡管根據(jù)BCS定義的吸收分?jǐn)?shù)在高滲透率和低滲透率之間使用截?cái)嗍强赡芮液侠淼模魬?zhàn)在于找到與吸收分?jǐn)?shù)具有足夠相關(guān)性的合適滲透率測(cè)量,且執(zhí)行簡(jiǎn)單。文獻(xiàn)中報(bào)道的方法包括基于計(jì)算機(jī)藥物特性的那些方法,例如logD和氫鍵勢(shì),被動(dòng)擴(kuò)散穿過人工膜,體外細(xì)胞系滲透性,穿過切除的人類或動(dòng)物組織和通過原位灌注技術(shù)確定的滲透性。在產(chǎn)品開發(fā)的早期階段和用于評(píng)估候選藥物時(shí),首選更簡(jiǎn)單的方法,而在后期開發(fā)中可能會(huì)執(zhí)行更復(fù)雜的測(cè)量。對(duì)于正式的BCS分類,在使用的方法和方法驗(yàn)證方面,關(guān)于什么是可接受的滲透率評(píng)估方法有具體的指導(dǎo)。
圖2.新藥發(fā)現(xiàn)和開發(fā)不同階段的體外滲透性模型。PCC:臨床前候選化合物;IND:研究性新藥申請(qǐng);ADME:吸收、分布、代謝和消除;PK:藥代動(dòng)力學(xué);BE:生物等效性(來源于參考文獻(xiàn)3)
圖3改良版本BCS分類系統(tǒng),即DCS分類系統(tǒng)(來源于參考文獻(xiàn)4)
根據(jù)化合物BSC分類系統(tǒng)所屬類別,可以根據(jù)類別分配不同的資源和開發(fā)時(shí)間表。如果分子表現(xiàn)出高溶解性和滲透性(即BCSⅠ類),則更簡(jiǎn)單的PIB或PIC制劑方法通常滿足化合物臨床試驗(yàn)。其他藥物類別通常需要更嚴(yán)格的處方,尤其是BCSIV(低溶解性和低滲透性)化合物,可能需要其他制劑開發(fā)策略,具體策略見圖4。
圖4基于BCS分類系統(tǒng)可采取的制劑開發(fā)策略(來源于參考文獻(xiàn)5)
圖5基于BCSⅠ/Ⅱ類分類藥物制劑開發(fā)策略(來源于參考文獻(xiàn)1)
對(duì)于每種制劑方法,都有幾種工藝技術(shù)可用于制造藥物產(chǎn)品。關(guān)于如何從戰(zhàn)略上進(jìn)行,當(dāng)然需要指導(dǎo),一個(gè)好的起點(diǎn)確實(shí)是BCS分類系統(tǒng)(圖5)。當(dāng)化合物水溶性看起來相當(dāng)沒有問題,即>0.3mg/ml時(shí),根據(jù)劑量和流動(dòng)特性,將BCSI化合物物配制成簡(jiǎn)單的粉末混合物。如果不滿足溶解度標(biāo)準(zhǔn),則用表面活性劑配制干混合物。在流動(dòng)性問題的情況下,優(yōu)選使用壓輥壓實(shí)(RC)將藥物制粒。
圖5進(jìn)一步表明,給定的BCSII藥物將使用離子化標(biāo)準(zhǔn)進(jìn)行初步評(píng)估。劑量體積DV是通過將人體劑量除以弱堿性化合物在pH6下的溶解度或弱酸性或中性化合物在pH5下的溶解度來計(jì)算的。DV≤250ml的可電離藥物按BCSI標(biāo)準(zhǔn)處理。對(duì)于較高的DV值(但仍低于5000ml),建議使用含表面活性劑的濕法或wax制粒。表現(xiàn)出最高DV值(>5000ml)的化合物肯定更難配制。如果基于脂質(zhì)的載體能夠?yàn)轭A(yù)期劑量提供足夠的溶解度和穩(wěn)定性,則考慮將液體填充到膠囊中。其他具有高DV的藥物很難溶解在廣泛的輔料及其混合物中。當(dāng)藥物在載體中的溶解度Svehicle不能以膠囊的典型體積溶解劑量時(shí),則需要其他替代制劑。這些藥物被提議用于無定形固體分散體ASD(例如通過熔融擠出)或納米晶體制劑。最后,BCSIII和IV藥物需要來自大鼠灌注研究或Caco-2實(shí)驗(yàn)的估計(jì),以獲得相應(yīng)的決策樹。使用美托洛爾作為參考考慮相對(duì)有效滲透率值。如果藥物的有效滲透性低于該參考值的5%,則推薦口服以外的給藥途徑。然而,相對(duì)滲透率值在5%和50%之間的候選藥物是使用促滲劑制備的。具有大于50%的相對(duì)滲透性的BCSIV化合物被像BCSII藥物一樣處理。在低于該滲透極限的情況下,只有當(dāng)溶液(含促滲劑)可以在膠囊中穩(wěn)定時(shí),才建議口服BCSIV化合物。關(guān)于公司如何制定自己篩選戰(zhàn)略,這項(xiàng)開創(chuàng)性的工作需要在理論與實(shí)踐中不斷地摸索。
改良版本的BCS分類系統(tǒng),即“可開發(fā)性分類系統(tǒng)”(DCS),其考慮了生物相關(guān)的溶解度(在FaSSIF中)以及以目標(biāo)藥物粒度表示的溶出速率。此外,在DCS中使用了溶解度限制可吸收劑量(SLAD),這改變了先前報(bào)道的最大可吸收劑量的概念。生物相關(guān)溶解度通常高于相應(yīng)的水溶液值,并且考慮增加胃腸液體積(500ml)用于藥物溶解。因此,BCS的溶解度分界線在DCS中被轉(zhuǎn)移到更高的極限,以區(qū)分藥物類別。可開發(fā)性系統(tǒng)根據(jù)藥物吸收的溶出限制(IIa)或溶解度極限(IIb)進(jìn)一步區(qū)分II類化合物。這種定義對(duì)于處方的選擇是有意義的。盡管DCS已被引入作為一種可開發(fā)性評(píng)估工具,具有一定溶出限制的BCSII化合物可以用基于顆粒尺寸減小、濕法制粒和/或添加表面活性劑的相當(dāng)簡(jiǎn)單的處方來開發(fā)。然而,DCSIIb類別中的其他BCSII化合物可能需要使能處方,例如LBF或ASD。似乎,為了選擇基于生物藥劑學(xué)分類系統(tǒng)的早期處方策略,DCS提供了一個(gè)比BCS更詳細(xì)的開發(fā)方向。
參考文獻(xiàn)
1.Strategies to Address Low Drug Solubility in Discovery and Development
2.人體生物等效性試驗(yàn)豁免指導(dǎo)原則
3.藥物通透性在新藥發(fā)現(xiàn)和開發(fā)階段的評(píng)估策略
4.The developability classification system: application of biopharmaceutics concepts to formulation development。
5.Physicochemical,Pharmaceutical,and Biological Considerations in GIT Absorption of Drugs
6.Methodology of oral formulation selection in the pharmaceutical industry。
7.化學(xué)藥物制劑人體生物利用度和生物等效性研究技術(shù)指導(dǎo)原則
8.Dissolution media simulating conditions in the proximal human gastro intestinal tract: an update.