您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2023-08-25 11:29
一次性使用腹膜透析導管用于對腎功能衰竭患者進行腹膜透析建立治療通路,屬于一次性使用無菌產品。
根據《醫療器械分類目錄》,一次性使用腹膜透析導管的分類編碼為10-04-04,管理類別為Ⅱ類。
一、一次性使用腹膜透析導管的結構組成
一次性使用腹膜透析導管通常由管路、連接端口、保護帽等組成。一般采用高分子材料制成。根據臨床需要,產品的管路結構會有所不同。常見的產品結構包括帶有雙滌綸套的直管型(見圖1)、卷曲管型(見圖2)、鵝頸直管型(見圖3)、鵝頸卷曲管型(見圖4)等型式。所列圖示不代表固定的結構設計,可以為其他設計類型。

圖1 直管型
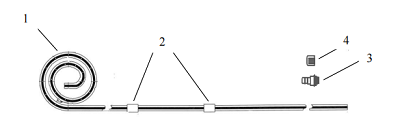
圖2 卷曲管型
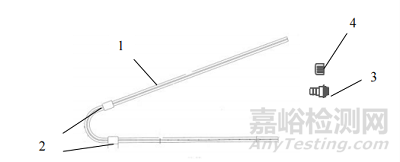
圖3 鵝頸直管型

圖4 鵝頸卷曲管型
1-管路;2-滌綸套;3-連接端口;4-保護帽
二、一次性使用腹膜透析導管的主要風險
除無源醫療器械已識別的共性風險外,對于一次性使用腹膜透析導管產品,至少還需關注以下危險(源):
1.設計
產品中管路組件的設計流量低于相關標準要求,會降低腹膜透析效率和質量。
2.原材料選擇
產品中管路組件在自由彎曲或對折后易發生彎折或變形,導致臨床使用時的流速降低;
原材料的生物學和化學危害,如材料與藥物的相互作用、材料變更等產生的風險。
3.生產加工
腹膜透析導管的腹內段,存在過大的銳邊、毛刺等,置入患者腹腔后容易劃傷組織;
產品中各連接件密封不嚴,導致灌注或引流過程發生液體泄漏;
生產過程中的加工助劑殘留;
產品未完全滅菌;
滅菌過程產生的有害物質(如環氧乙烷);
熱原污染;
組件、成品缺陷。
4.產品說明書及標簽
說明書中沒有提供日常維護方法(如適用)、使用前的檢查建議等信息;
沒有維護或使用了不恰當或者不正確的維護方法;
產品或包裝上標識不明確、不清晰,說明書編輯不當、未警示全部使用風險及注意事項所導致的使用風險。
5.臨床使用
未遵循規定使用;
包裝破損導致的無菌屏障破壞;
使用中保護帽組件意外脫落;
聯合使用時,一次性使用腹膜透析導管全系統的密閉性無法保持。
三、一次性使用腹膜透析導管性能研究實驗要求
1、性能指標
性能指標引用標準應當為現行有效版本,常見的參考標準包括:YY/T 0030《腹膜透析管》、YY/T 0586《醫用高分子制品X射線不透性試驗方法》、GB/T 15812.1《非血管內導管第1部分:一般性能試驗方法》等,建議參考上述標準中適用條款制定產品的性能指標要求。如產品有特定設計,還需根據產品設計特征設定相應的性能指標,并將其列入產品技術要求。
產品技術要求中的性能指標包括但不限于以下幾點。
外觀:外表面、潔凈度、無雜質;
尺寸;
流量;
抗彎曲性;
連接強度;
峰值拉力、座(如適用)、動力注射、側孔、末端頭端、透明度、標識等;
無泄漏;
射線可探測性;
無菌、內毒素;
耐腐蝕性(如適用);
化學性能(如管路為硅橡膠材質,應參考YY/T 0334適用部分)。
2、產品性能研究
應當開展產品性能研究,明確有效性、安全性指標的確定依據、所采用的標準或方法、采用的原因及理論基礎等。
如產品預期與其他醫療器械產品聯合使用,開發人應當開展證明聯合使用安全有效的研究,如連接部位的適配性、長期使用時的阻菌性驗證等研究。
如一次性使用腹膜透析導管產品為雙層設計,考慮其臨床應用中可能存在的斷裂和分層的風險,開發人需開展產品斷裂力、剝脫力和雙層拉力性能的驗證研究。如有除產品技術要求性能指標以外的其他特殊設計,需一并開展相關驗證研究。
3、生物學特性研究
應對終產品與患者直接或間接接觸的組件進行材料表征。參照GB/T 16886.1的要求,根據接觸性質、接觸時間判斷產品的類別,對其進行生物學評價,生物學評價的終點可參考其附錄A中“表A.1 生物學風險評定終點”。
一次性使用腹膜透析導管屬于“植入醫療器械”中與組織直接接觸的醫療器械,接觸時間通常為持久接觸。
應進行細胞毒性、致敏反應、刺激反應、熱原、急性全身毒性、亞慢性毒性、植入反應、遺傳毒性評價。
4、產品滅菌工藝研究
一次性使用腹膜透析導管產品以無菌形式提供,開發人應明確其滅菌工藝(方法和參數)和無菌保證水平(SAL),并開展滅菌驗證及確認的相關研究。如采用的滅菌方法容易出現殘留物,應當明確殘留物信息及采取的處理方法,并開展相關研究。如產品或組件涉及兩次或多次滅菌的情形,應當開展產品滅菌工藝耐受性的研究。
5、穩定性研究
5.1貨架有效期
應當開展產品貨架有效期和包裝研究,證明在貨架有效期內,在生產企業規定的運輸貯存條件下,產品可保持性能功能滿足使用要求,并保持無菌狀態。
產品貨架有效期的驗證可選擇加速穩定性試驗或實時穩定性試驗,具體需根據產品特性選擇驗證方式。無論加速穩定性試驗還是實時穩定性試驗,開發人均需在試驗方案中設定測試項目、測試方法及判定標準。貨架有效期驗證項目通常包括產品技術要求中與有效期密切相關的條款,以及包裝完整性。加速老化研究的具體要求可參考YY/T 0681.1《無菌醫療器械包裝試驗方法第1部分:加速老化試驗指南》等標準。提交包裝驗證報告,常見驗證項目包括但不限于:包裝完整性、包裝強度和微生物屏障性能等。
5.2使用穩定性
應當開展使用穩定性/可靠性研究,證明在生產企業宣稱的使用期限內,在正常使用、維護條件下,產品的使用性能滿足要求。
5.3包裝及包裝完整性
在宣稱的有效期內以及運輸儲存條件下,保持包裝完整性的依據。需開展產品包裝驗證和運輸驗證研究。運輸穩定性應證明在生產企業規定的運輸條件下,運輸過程中的環境條件不會對醫療器械的特性和性能,包括完整性和清潔度等,造成不利影響。產品包裝驗證可依據有關國內標準進行(如GB/T 19633系列標準、YY/T 0681系列標準等),開展產品的效期末包裝驗證研究。在進行加速老化試驗研究時需注意:產品選擇的環境條件的老化機制需與宣稱的運輸儲存條件下真實發生的產品老化的機制相匹配一致。對于在加速老化研究中可能導致產品變性而不適于選擇加速老化試驗方法研究的情況,需以實時老化方法測定和驗證。
6.其他研究
如產品為列入《免于臨床評價醫療器械目錄》(以下簡稱《目錄》)的一次性使用腹膜透析導管產品,開發人應當按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》的要求,將產品相關信息與《目錄》所述內容的進行對比、產品與《目錄》中已獲準境內注冊醫療器械進行對比,從基本原理、結構組成、性能、安全性、適用范圍等方面,證明產品的安全有效性。

來源:嘉峪檢測網


